817种鸡群非典型新城疫的综合诊断
王本琢 丁壮 郭光 孙胜元 (①吉林大学畜牧兽医学院 吉林 长春 130062 山东无棣县畜牧兽医局)
817种鸡群非典型新城疫的综合诊断
王本琢①②丁壮①*郭光②孙胜元②(①吉林大学畜牧兽医学院 吉林 长春 130062 ②山东无棣县畜牧兽医局)
通过对两个疑似患非典型新城疫的817肉鸡种鸡群进行了病理学、血清学及病原学综合检测。检测结果表明:两发病鸡群的均表现有呼吸道症状、消化道症状及产蛋性能下降等非典型新城疫的基本症状;重症病鸡的胃肠道及呼吸道黏膜出血性卡他性炎症,卵泡充血、出血,输卵管萎缩等剖检病变均符合新城疫的特征性剖检病变;镜检均见病毒性脑炎、淋巴组织坏死等证病意义的新城疫组织病变;发病后HI抗体显著升高,分离到新城疫病毒及免疫组织学检测新城疫阳性,综合诊断两患病鸡群为非典型新城疫。
817种鸡 非典型新城疫 诊断
目前新城疫依然是影响我国家禽养殖业发展的最主要疫病之一,近年来由于免疫制度的不断完善和疫苗质量的改进,免疫强度的不断加大,新城疫的发生已逐渐呈现非典型化趋势,尤其是产蛋鸡群主要表现产蛋性能下降为特征的非典型新城疫,剖检病变不明显,临床诊断比较困难。本研究对两个用于“817”肉杂鸡种蛋生产的患病商品代母群进行了病理学、血清学及病原学综合检测,以便做出确切诊断。
1 材料与方法
1.1 材料
1.1.1 发病鸡群及病料采集 鸡群A为30周龄产蛋高峰期(90%以上)用于生产 “817”肉杂鸡的海兰褐商品蛋鸡;鸡群B为34周龄产蛋高峰期“817”肉杂鸡种母鸡。两鸡群隶属于两个鸡场,分别于2011年3月、4月先后发病,发病情况基本相同,症状相似。发病初期鸡群采事量下降,有轻度呼吸道症状,个别甩头,有些鸡排绿色稀粪,产蛋量每天下降5%~10%,蛋的形状和质量稍有变化,颜色略淡,软壳蛋、薄壳蛋增多。破蛋率升高,产蛋量下降了30%~40%,持续10几天后开始恢复,恢复期有一定的死亡率,死淘率4%左右。取A、B鸡群病死鸡及症状明显鸡10余,发病后2周左右自发病鸡群各采集血液40份,分离血清,低温冰箱保存。
1.1.2 试验材料 96孔“V"型血凝板(上海医用分析仪器厂生产)、8道可调移液器(德国生产)、新城疫血凝抗原及标准阳性血清(购自中国兽药监察所)、SPF鸡胚(购自山东省家禽研究所)、冰冻切片机(德国莱卡公司)、正置荧光显微镜(德国莱卡公司)、新城疫单抗(由山东农业大学动科院临床病理学实验室刘思当老师惠赠)、FITC标记的兔抗鸡IgG(购自博美科生物技术有限公司)。
1.2 方法
1.2.1 病理剖检及病理组织学检查 取病死鸡及症状明显鸡,按常规方法剖检,观察眼观病变,取病鸡脑、脾、肠道等组织器官,10%福尔马林固定,常规石蜡切片、HE染色,光镜下观察。
1.2.2 鸡胚接种 无菌取病鸡脾、肺和脑新鲜病料。将病料置于消毒的匀浆器内,研磨成乳剂,加入灭菌生理盐水10倍稀释成悬浮液,静置或离心后取上清液,加入青霉素和链霉素各500IU/ml,置37℃温箱作用30~ 60min。以上清液0.1ml接种于9~10日龄SPF鸡胚尿囊腔,每胚0.2m1,每组样品接种5枚鸡胚。接种后的鸡胚放在37℃温箱内继续孵育,并每天检查鸡胚一次。石蜡封孔后37℃继续孵化,弃去24h内死亡的鸡胚,以后每6h照蛋一次,并及时将死亡的鸡胚置4℃冰箱冷藏。有明显病变者取其胚液,检测其HA滴度,若能凝集鸡红细胞,则进行HI试验。
1.2.3 血凝试验(HA)及血凝抑制试验(HI) 按常规方法进行HA、HI试验。
1.2.4 新城疫病毒间接免疫荧光检测 将待检测组织(病鸡的脾、肺、肝)及阴性组织(健康对照鸡的脾)冰冻切片后立刻放入冷丙酮中固定10min,取出后放入0.01mol/ LpH7.4的PBS液中,轻轻漂洗3~4次,5min/次,加新城疫抗体37℃孵育45min,用pH7.4的PBS液浸洗3次,5min/次,再在组织切片表面滴加FITC标记的兔抗鸡IgG荧光抗体,继续37℃孵育45min,用pH7.4的PBS液浸洗3次,5min/次,加甘油缓冲液,用盖玻片封片镜检,观察组织细胞特定区域内是否有明亮的黄绿色或翠绿色荧光。
2 结果
2.1 病理学检查
2.1.1 剖检病变 剖检病死鸡,可见喉头、气管黏膜充血、黏液增多(图1);腺胃黏膜附有黏液,个别病死鸡腺胃乳头出血(图2)。整个肠道发生卡他性炎症,肠腔充满黏液,十二指肠近末端、空肠中部(卵黄遗迹后)、回肠起始部、盲肠扁桃体可见局部黏膜(淋巴组织集中部位)肿胀、充血或出血(图3,图4)。直肠点状、条纹状出血,泄殖腔黏膜出血。输卵管黏膜附有很多黏液(图5),卵泡充血、出血、液化或破裂(图6)。后期死亡的病鸡常表现卵黄性腹膜炎、输卵管炎、心包炎、气囊炎等继发感染病变。
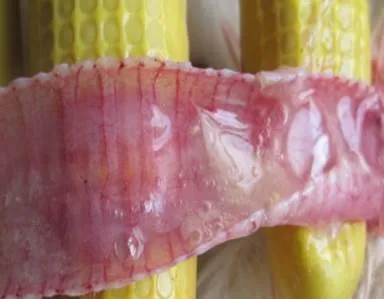
图1 气管黏膜充血、附有黏液

图2 腺胃黏膜溃疡、出血
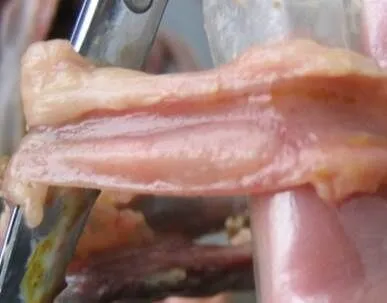
图3 十二指肠淋巴滤泡处肿胀

图4 空肠淋巴滤泡处肿胀
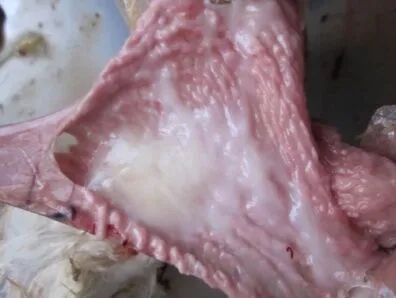
图5 输卵管卡他性炎症

图6 卵泡充血、出血
2.1.2 组织病理学病变 脑膜充血、淋巴细胞浸润,脑血管充血,血管周围淋巴细胞袖套样浸润,神经元变性、坏死,胶质细胞灶状或弥漫性增生,并形成卫星现象和噬神经元现象,呈轻度病毒性脑炎病变。肠黏膜上皮细胞坏死、脱落,固有层充血、出血、水肿,淋巴滤泡内淋巴细胞坏死、崩解。脾脏淋巴细胞广泛性坏死、崩解。输卵管黏膜上皮细胞变性、坏死,腺体上皮细胞变性、坏死。
2.2 血清学检查
发病鸡群A、B的HI试验结果见表1、表2。2鸡群发病后HI抗体效价均发生显著升高,且离散度较大。

表1 发病鸡群A新城疫抗体水平检测结果

表2 发病鸡群B新城疫抗体水平检测结果
2.3 病毒分离鉴定
在病料接种后48-72h就发现有鸡胚死亡,致死的鸡胚,胚体全身充血、出血,以头、翅和趾部尤为明显。将死亡的鸡胚的尿囊液收集,细菌检查阴性,将鸡胚尿囊液作红细胞凝集试验(HA)阳性,血凝价达8个滴度,与已知抗鸡新城疫病毒的阳性血清进行血凝抑制试验(HI)阳性,证明有新城疫病毒存在。
2.4 免疫组化检测
在荧光显微镜下观察,病鸡的肾(图7)、胰腺(图8)和肝组织均见发翠绿色荧光的新城疫病毒感染细胞,阴性对照未见荧光(图9)。

图7 肾脏阳性
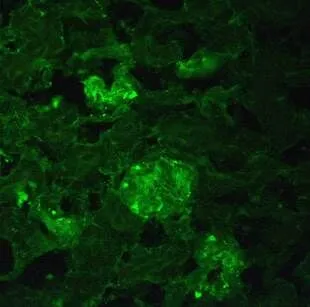
图8 胰腺阳性

图9 阴性对照
3 讨论与结论
3.1 疾病诊断
两发病群鸡的临床表现均有呼吸道症状、消化道症状及产蛋性能下降的非典型新城疫的基本症状;重症病鸡的胃肠道及呼吸道见出血性卡他性炎症,卵泡充血、出血,输卵管萎缩等剖检病变,均符合新城疫的特征性剖检病变;病毒性脑炎、淋巴组织坏死为具有证病意义的新城疫组织病变;发病后HI抗体检测结果对新城疫的判定具有重要的证病意义;结合新城疫的病毒分离鉴定及免疫组学检测的阳性结果,结合临床症状、剖检病变及实验室检测综合判定两“817”肉鸡种母鸡群所患疾病为非典型新城疫。
3.2 发病原因分析
3.2.1 病毒严重污染 “817”肉杂鸡种母鸡群养殖环境差,鸡场被强毒新城疫病毒污染后,即使鸡群有一定抗体水平,但难于抵抗强毒的侵袭而感染发病。
3.2.2 忽视局部免疫 新城疫免疫保护包括体液免疫和呼吸道局部黏膜免疫两部分,两者都要有足够的免疫水平,才能有效防止新城疫的发生,其中呼吸道黏膜的局部免疫极为重要。但实践中往往忽视呼吸道弱毒疫苗的免疫(滴眼、滴鼻、气雾免疫)而偏重饮水免疫或灭活苗注射免疫,导致呼吸道黏膜抗体水平低而易通过呼吸道感染发病。
3.2.3 免疫抑制病干扰 若鸡群早期发生过传染性法氏囊病、网状内皮细胞增殖病、白血病或传染性贫血等免疫抑制性病毒性疾病,使免疫系统遭到严重破坏,产生免疫抑制。黄曲霉毒素中毒、球虫病、慢性呼吸道病等一些慢性疾病,都可以使鸡群免疫力下降,而导致免疫失败。另外,使用毒力偏强的传染传染性法氏囊病疫苗,也可破坏机体的免疫功能,后期易发生非典型新城疫的发生。
3.2.4 其他因素 如鸡体的营养状态(如缺少某种营养成分),开产、免疫接种、季节变换、天气突然变化、高温等应激诱发因素影响,免疫方法不合理(如饮水免疫的不均衡性),饲养管理及卫生状况差等。受一种或多种因素的影响,鸡体免疫力下降,群内易感鸡比例增高,新城疫强毒一旦入侵鸡群,在鸡群内长期循环传播,从而极易发生非典型的新城疫。
综上所述,“817”肉杂鸡产蛋种鸡群发生非典型新城疫有病毒致病力强、污染重的因素,传播途径复杂、难以控制的因素,人工受精诱发,鸡群抵抗力弱,应激因素多,其他病原感染等因素。所以,两鸡群的发病是众多因素使然。只有采取综合防制措施才能有效控制产蛋鸡非典型新城疫的发生。
[1] 殷震, 刘景华主编. 动物病毒学[M]. 北京:科技出版社, 1997.
[2] 浙江省农业厅畜牧管理局. 浙江省畜禽疫病志[M]. 杭州: 浙江大学出版社, 1993.
[3] 农业部畜牧兽医司. 中国动物疫病志[M]. 北京: 科学出版社, 1993.
[4] 刁有祥, 张万福等.禽病学. 北京: 中国农业科学技术出版社. 2005.
[5] 卡尔尼卡主编. 高福, 刘文军主译. 禽病学(第9版)[M]. 北京: 北京农业大学出版社, 1991.
[6] 刘华雷, 王永刊, 严维巍等. 中国部分地区新城疫病毒的分子流行病学研究闭[J]. 杨州大学学报(自然科学版), 2001, 4(1): 35-40.
[7]宋长绪, 刘福安. 用PCR检测鸡NDV的初步试验[J]. 中国兽医学报闭, 1995, 5(10): 20.
[8] 甘孟候, 王永坤等. 中国禽病学[M]. 北京: 中国农业出版社, 1999.
[9] 薛伟光. 抗体检测在防制鸡新城疫中的作用[J]. 养禽与禽病防治, 1992(4): 30-31.
[10]苏威生化科技(中国)有限公司. 肉鸡新城疫的免疫程序及影响因素[J]. 养禽与禽病防治, 1995(11): 42-43.
[11]Linghua Zhang, Meirong Zhang, Jiaoqing Li,et al .Enhancement of mucosal immune responses by intranasal co-delivery of Newcastle disease vaccine plus CpG oligonucleotide in SPF chickens in vivo[J].. Research in Veterinary Science, Volume 85, Issue 3, December 2008, Pages 495-502.
(2012–09–19)
通讯作者
S858.31
A
1007-1733(2012)10-0016-03

