二乙酰姜黄素金属(铜,铂)配合物的合成及其与ctDNA的键合作用
姜 波, 魏 冬, 范九良, 汪佳凤, 周双生
(安徽中医学院 药学院,安徽 合肥 230031)
现代药理学研究表明,姜黄素不仅能行气、驱虫、散风活血、通经止痛等,常用于治疗皮肤病、鼻炎、肝胆疾患、风湿病,而且还具有抑制肿瘤细胞的生长和增殖、诱发肿瘤细胞凋亡等广泛的药理活性,毒性又小,是一种很有发展前景的抗肿瘤药物[1,2]。但由于其稳定性差、体内生物利用度低、用药量大而限制了其推广使用。
近年来研究发现,由于金属离子与DNA的某些亲核基团(如磷酸氧位点或碱基氮、氧位点)直接螯合,引起癌细胞的DNA损伤,使DNA在复制和转录时受到障碍,从而阻止了癌细胞的生长和分裂,并导致其死亡[3]。小分子与DNA之间的相互作用有三种方式(嵌插作用,沟槽作用和静电引力作用),通过了解小分子与DNA键合作用机制,就能为以DNA为靶点的新型高效抗癌药物的设计提供指导性和可行性信息[4]。
为了进一步研究和探讨姜黄素类物质的生物活性,本文以姜黄素为起始原料,设计并合成了配体二乙酰姜黄素(H2L)及其金属[铜(Ⅱ)和铂(Ⅱ)]配合物(CuL2和PtL2, Scheme 1),其结构经1H NMR, IR, MS和元素分析确认。采用紫外可见光谱法和循环伏安法研究了CuL2和PtL2与小牛胸腺DNA(ctDNA)的相互作用。结果表明,CuL2和PtL2与ctDNA的作用属嵌插作用模式。


ML2(M=Cu, Pt)
Scheme1
1 实验部分
1.1 仪器与试剂
UV-2450型紫外光谱仪;752PC型紫外分光光度计;Bruker 400 MHz型超导核磁共振仪(CDCl3为溶剂,TMS为内标);Nicolet Avatar 370DTGS型红外光谱仪(KBr压片);Perkin-Elmer 2400CHN型元素分析仪;PHS-3CA型精密酸度计;CHI660B型电化学分析仪;LK2005A型电化学工作站。
姜黄素,国药集团;ctDNA, Sigma;其余所用试剂均为分析纯;实验用水为二次蒸馏水。
1.2 合成
(1) H2L的合成[6]
在圆底烧瓶中加入姜黄素1 g(2.7 mmol),二氯甲烷75 mL,加热搅拌使其溶解;加入吡啶5 mL和乙酸酐8 mL(84.8 mmol),回流反应3.5 h[溶液由橘红色变为淡黄色;TLC检测,展开剂:V(乙酸乙酯) ∶V(石油醚)=1 ∶1]。蒸除大部分溶剂后加甲醇100 mL,冷却析晶得黄色固体,用混合溶剂[V(二氯甲烷) ∶V(甲醇)=3 ∶2]重结晶得淡黄色晶体H2L,产率71.7%, m.p.157 ℃~158 ℃;1H NMRδ: 7.62~7.12(m, 6H, ArH), 7.07~6.68(d,J=7.8 Hz, 4H, =CH), 3.88(s, 6H, ArOCH3), 2.39(s, 6H, COCH3), 2.26(s, 2H, CH2); IRν: 1 712, 1 598, 1 508, 1 435, 1 254, 1 028; ESI-MSm/z: 452(M+); Anal.calcd for C25H24O8: C 66.36, 5.35; found C 66.67, H 5.73。
(2) CuL2和PtL2的合成[7,8]
在圆底烧瓶中依次加入H2L 0.14 g(0.3 mmol),无水乙醇35 mL及1 mol·L-1氢氧化钠溶液0.3 mL,搅拌下于室温滴加醋酸铜30.0 mg(0.15 mmol)的乙醇(3 mL)溶液,滴毕,回流(80 ℃)反应6 h。过滤,滤饼依次用二氯甲烷(3×15 mL)和水(3×15 mL)洗涤,于60 ℃真空干燥12 h得黄色粉末CuL2。
用四碘合铂酸钾代替醋酸铜,用类似方法合成棕色粉末PtL2。
CuL2: 收率74.5%, m.p.>280 ℃;1H NMRδ: 7.72~7.18(m, 6H, ArH), 7.13~6.72(d,J=7.8 Hz, 4H, =CH), 3.95(s, 6H, ArOCH3), 2.45(s, 6H, COCH3), 2.30(s, 2H, CH2); IRν: 1 593, 1 525, 1 507, 1 447, 1 297, 1 255, 1 195, 546 cm-1; Anal.calcd for C50H46O16Cu(Mr=965.5): C 62.14, H, 4.80, Cu, 6.57; found C 61.88, H 5.02, Cu 6.62。
PtL2: 收率57.1%, m.p>280 ℃;1H NMRδ: 7.74~7.19(m, 6H, ArH), 7.15~6.71(d,J=7.8 Hz, 4H, =CH), 3.93(s, 6H, ArOCH3), 2.46(s, 6H, COCH3), 2.31(s, 2H, CH2); IRν: 1 592, 1 526, 1 508, 1 446, 1 295, 1 259, 1 196, 544 cm-1; Anal.calcd for C50H46O16Pt(Mr=1097.1): C 54.70, H 4.22, Pt 17.76; found C 54.56, H 4.32, Pt 17.83。
1.3 CuL2和PtL2与ctDNA的相互作用测定
将配合物用混合溶剂A{5 mmol·L-1Tris-HCl[三(羟甲基)氨基甲烷-盐酸]100 mL+50 mmol·L-1NaCl(pH 6.86)缓冲溶液900 mL}配成浓度(c)为1.0×10-4mol·L-1溶液。 ctDNA用A配成不同浓度的溶液,于4 ℃保存待用。 ctDNA在260 nm和280 nm处的吸光度比值为1.85,表明ctDNA达到实验要求[5]。
用混合溶剂A作空白对照液,测定时样品池和空白池分别装3 mL溶液,用微量注射器分别加入50 μL的ctDNA溶液,充分混合后静止5 min,在200 nm~350 nm内扫描,观察UV吸收曲线变化。
设置CHI660B电化学分析仪参数:扫描电压-1000 mV~1000 mV,扫描速率100 mV·s-1,扫描次数3次,间隔时间10 s。取Tris-HCl(pH 6.86)的NaCl缓冲溶液于电解池中,注入50 μL待测配合物溶液,浸入电极,通N2,搅拌5 min;在设置的条件下测定其未加ctDNA的循环伏安曲线;每次以递增方式加入50 μL的ctDNA溶液,共测3次,观察循环伏安曲线的变化。
2 结果与讨论
2.1 表征
H2L的IR分析结果表明,位于3 412 cm-1处的姜黄素酚羟基伸缩振动峰消失,只在1 712 cm-1和1 598 cm-1处出现羰基吸收峰,表明酚羟基上的氢已被乙酰基取代;在1 712 cm-1附近出现比较弱的吸收峰,是羰基的伸缩振动,强度很弱;1 598 cm-1附近是烯醇式异构体羰基伸缩振动,峰形强且尖锐。两个配合物的IR谱图相似,表明结构相似。CuL2的羰基伸缩振动吸收峰在1 593 cm-1(PtL2在1 592 cm-1)处,相对于L的烯醇式异构体的羰基峰稍稍蓝移,说明L以烯醇式异构体与M2+发生螯合配位,降低了羰基振动频率[9];其次,L在1 028 cm-1附近的νO-H┈O烯醇式伸缩振动峰消失,而在1 525 cm-1附近处出现较强的νC=C伸缩振动峰,这是烯醇负离子发生M-O配位的特征[10]。另外,在CuL2中出现了新的546 cm-1峰(PtL2在544 cm-1),归属于β-二酮的羰基氧与金属键合吸收峰[11]。配合物的1H NMR分析结果与H2L比较发现,形成配合物后,L的各种质子的化学位移均向低场发生了不同程度的位移,这也说明了L与M2+发生了配位作用[12]。
以DMF为溶剂,于25 ℃下在浓度为1.0×10-3mol·L-1溶液里测得CuL2和PtL2的摩尔电导值分别为27.8 s·cm2·mol-1和25.6 s·cm2·mol-1,表明它们均为非电解质。
结合元素分析和1H NMR结果,配合物的可能结构推断如Scheme 1所示。
2.2 CuL2和PtL2与ctDNA的键合作用
(1) UV-Vis法测定
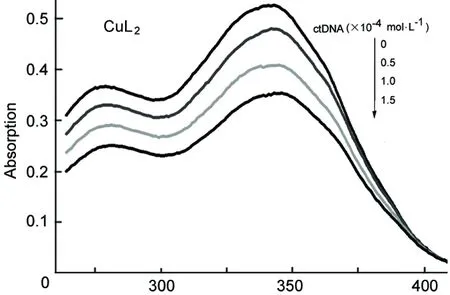
λ/nm图1 CuL2与ctDNA在缓冲溶液(pH 6.86)中的UV-Vis谱图*Figure 1 UV-Vis spectra of CuL2 with ctDNA at pH 6.86 buffer solution*c(CuL2)=1.0×10-4 mol·L-1, c(ctDNA)=(0.0, 0.5, 1.0, 1.5)×10-4 mol·L-1
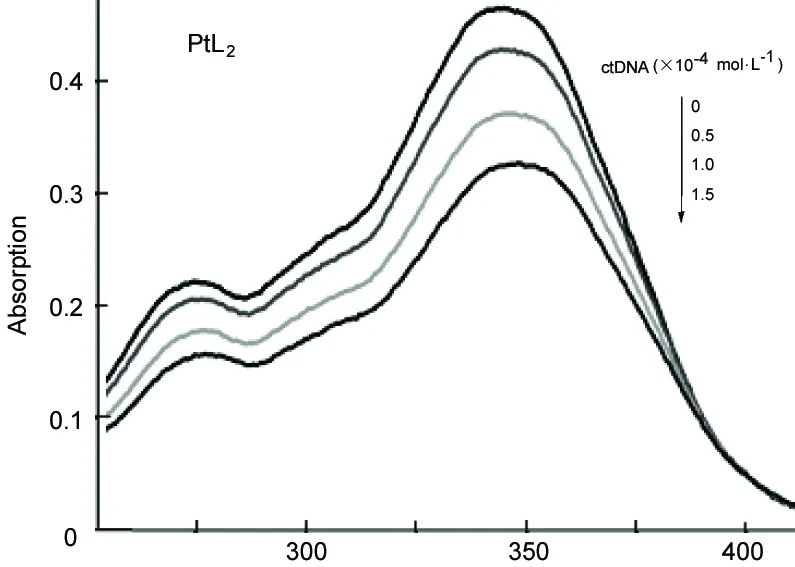
λ/nm图2 PtL2与ctDNA在缓冲溶液(pH 6.86)中的UV-Vis谱图*Figure 2 UV-Vis spectra of PtL2 with ctDNA at pH 6.86 buffer solution*同图1
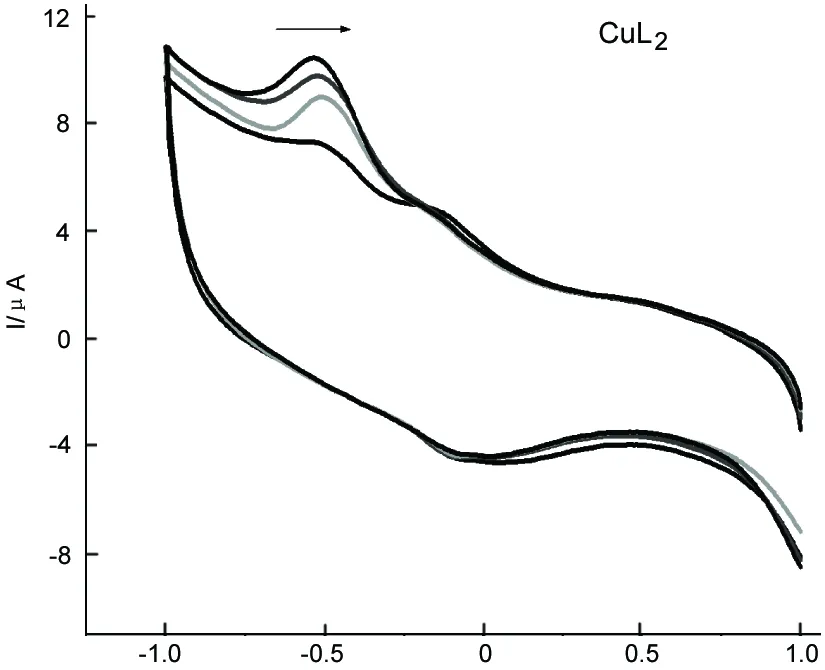
E/V图3 CuL2与ctDNA在缓冲溶液(pH 6.86)中的循环伏安曲线*Figure 3 Cyclic voltammogram curve of CuL2 with ctDNA at pH 6.86 of buffer solution*同图1
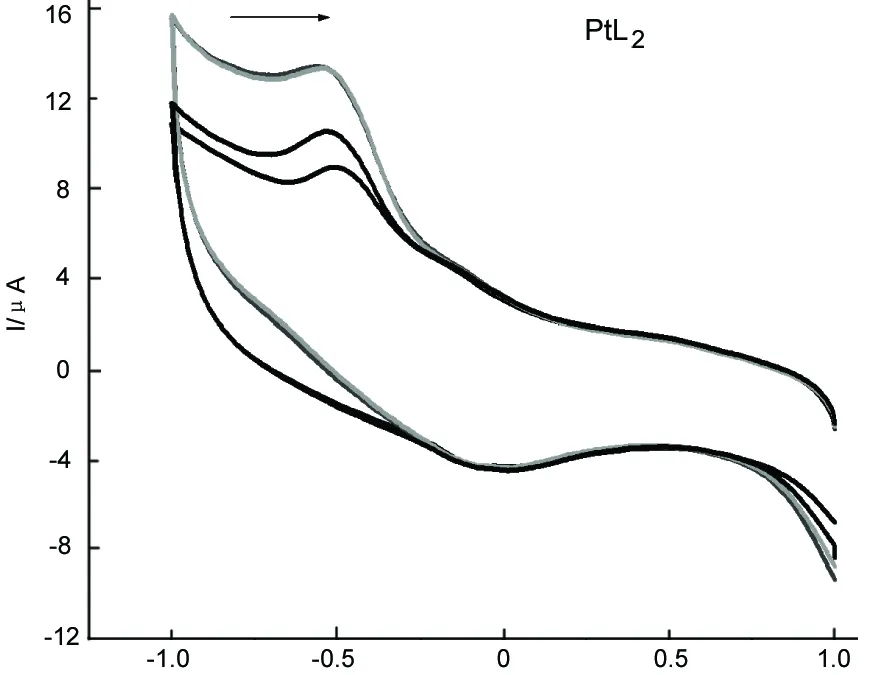
E/V图4 PtL2与ctDNA在缓冲溶液(pH 6.86)中的循环伏安曲线*Figure 4 Cyclic voltammogram curve of PtL2 with ctDNA at pH 6.86 of buffer solution*同图1
图1和图2为CuL2和PtL2与ctDNA的键合作用UV-Vis光谱图。从图1和图2可见,随着c(ctDNA)增大,各配合物在275 nm和350 nm附近处的峰明显不断减小,且最大吸收波长表现出红移现象,按照Long E.C[13]理论,推测配合物与ctDNA键合作用属于嵌插模式。
(2) 循环伏安法测定
图3和图4为CuL2和PtL2与ctDNA的键合作用的循环伏安曲线。从图3和图4可见,小分子的伏安峰电位升高、正移,表明配合物与ctDNA作用是嵌入作用[14],这与UV-Vis法结论相一致。另外,氧化还原峰电流(Ipa)随着c(ctDNA)的增加而逐渐降低,这是因为配合物结合了分子量大且扩散速率慢的ctDNA分子的缘故[15]。
[1] 仲明远,全山丛,胡晋红. 姜黄素制剂学研究进展[J].中成药,2007,29(2):255-258.
[2] 许刚,黄文,张亚历. 姜黄素防治肿瘤的机制研究进展[J].国外医学·生理、病理科学与临床分册,2003,23(2):152-154.
[3] 潘国凤,张晓东,朱晓新. 姜黄素的抗肿瘤作用及其机制研究最新进展[J].中药药理与临床,2007,23(5):247-252.
[4] M Concepcion Lozada, Raul G Enriqueez, Carlos E Lobato,etal. Synthesis and structure of new heterocyclic derivatives of curcumin[J].Heterocyclic,2005,65(1):49-58.
[5] Marmur J. A procedure for the isolation of deoxyribonucleic acid form microorganisms[J].J Mol Biol,1961,3:208-218.
[6] 杨功俊,徐静娟,陈洪渊. 儿茶酚胺衍生物与DNA之间相互作用的光谱和电化学法研究[J].高等学校化学学报,2004,25(7):1235-1239.
[7] 周永红,田玉鹏,吴杰颖. 稀土配合物型激光材料的设计、合成及结构[D].合肥:安徽大学,2004.
[8] 许军鹏,刘景旺,朱早龙,等. 稀土-姜黄素·菲啰啉配合物荧光和抑茵活性研究[J].中国稀土学报,2009,27(1):67-75.
[9] 周双生,薛璇,汪佳凤,等. 二乙基姜黄素稀土配合物的合成及其光学性质[J].中国稀土学报,2011,29(2):140-145.
[10] Basseff A P, Maqennis S W, Glove P B,etal. Hightly luminesenent,triple and quadruple-stranded,dinuclear Eu,Nd and Sm lanthanide complexes based on bis diketonate ligands[J].J Am Chem Soc,2004,126:9413-9424.
[11] 陈莉敏,刘洋,李光文,等. 姜黄素金属配合物的合成、表征和抗肿瘤活性研究[J].中国新药杂志,2008,17(19):1676-1678.
[12] 张金超,龚钰秋,郑小明. 碘桥双核铂配合物的合成及其抗肿瘤活性[J].科学通报,2006,51(7):796-801.
[13] Long E C, Barton J K. On demonstrating DNA intercalation[J].Acc Chem Res,1990,23(9):271-273.
[14] Carter M T, Rodriguez M, Bard A J. Voltammetric studies of the interaction of metal chelates with DNA[J].J Am Chem Soc,1989,111(24):8901-8911.
[15] Sun J, Solaiman D K Y. The cyclic voltametric study of iron-tallysomycin in the absence and presence of DNA[J].J Inorg Biochem,1990,40(3):271-277.

