肿瘤坏死因子-α增加肾入球动脉平滑肌细胞胞内钙离子浓度的机制
金旭鹏 郭莲怡 (辽宁医学院基础学院,辽宁 锦州 121000)
肿瘤坏死因子-α(TNF-α)是单核-巨噬细胞产生的具有多种生物活性的细胞因子,参与抗感染、发热、休克等多种病理生理过程〔1〕。TNF-α也是引起重症肝病发生发展的重要因子〔2〕。肝肾综合征(HRS)是继发于重症肝病的肾衰竭,多种因素参与其发病〔3〕。肾血管收缩引起的肾血流量锐减是HRS的主要发病因素。肾血流量受肾小球入球小动脉收缩和舒张的控制,而肾入球动脉平滑肌细胞(RASMCs)内Ca2+水平高低与肾入球动脉的舒缩功能直接相关。本研究观察TNF-α对RASMCs内钙离子浓度(〔Ca2+〕i)的影响及机制。
1 材料与方法
1.1 实验动物 200~250 g普通级雄性SD大鼠(由辽宁医学院实验动物中心提供),许可证号:SCXK(辽2003-0007),开放系统饲养,实验前禁食12 h。进行原代RASMCs的分离与培养。
1.2 主要试剂 Fluo-3/AM乙酰甲酯、TNF-α、2-氨基乙基二苯硼酸盐(2-APB)、内皮素(美国 Sigma公司)、PSS缓冲液(PSS:0.1 mmol CaCl2,125.0 mmol NaCl2,5.0 mmol KCl,1.0 mmol MgCl2,10.0 mmol Glucose,20.0 mmol HEPES)。
1.3 主要实验器材 CK30-12PHP相差显微镜,日本OLYMPUS;JEM-1200EX电镜,日本;激光共聚焦显微镜(Uitma212型),Meridina公司;MetaFlour4.5软件,德国Carl Zeiss公司。
1.4 方法
1.4.1 参照文献〔4〕行大鼠RASMCs的分离与培养 戊巴比妥钠(30 mg/kg)腹腔注射麻醉大鼠,摘除肾脏,留取皮质,应用筛网和酶消化法分离RASMCs,最后加入完全营养液,并以1×104细胞数接种于25 cm2培养瓶内,于CO2孵箱中培养,前3 d每天换液,以后隔天换液,1 w后可行细胞传代。相差显微镜观察细胞生长情况,取3~10代细胞用于实验。
1.4.2 RASMCs电镜标本制备 培养瓶中细胞生长至单层融合后,加1 ml胰酶消化、吹打,将细胞收于1 ml EP管中,1 500 r/min 4℃ 离心 4 min,弃上清,小心加入 1 ml PBS,1 500 r/min 4℃离心4 min,弃上清,小心加入1 ml 2.5%戊二醛固定2 h,1%锇酸后固定1 h,常规丙酮脱水,经浸透、树脂包埋、超薄切片,醋酸铀染色,JEM-1200EX电镜观察。
1.4.3 实验分组 TNF-α处理(0 h,24 h)分2组:ET刺激组(A1):实验中加入 ET(100 nmol/L)刺激,不加 TNF-α;TNF-α +ET 刺激组(A2):实验前24 h 加入 TNF-α(100 μg/L),实验中加入 ET(100 nmol/L)刺激。2-APB阻断分2组:2-APB+ET刺激组(B1):加 ET前10 min加入2-APB,实验中加入ET(100 nmol/L)刺激;TNF-α+2-APB+ET刺激组(B2):实验前24 h加入 TNF-α(100 μg/L),加 ET前 10 min加入 2-APB(30 μmol/L),实验中加入 ET(100 nmol/L)刺激。
1.4.4 细胞内钙离子浓度的测定〔5〕各组细胞均加入钙离子荧光探针Fluo-3/AM(5 μmol/L),Fluo-3/AM可以和钙离子结合,产生较强的荧光,采用confocal显微镜测定单个活细胞内Ca2+荧光强度(发射波长505 nm,激发波长488 nm)。动态观察各组细胞胞内钙荧光强度(FI)的变化。采用LSM510软件对数据、图形进行实时动态测量与分析,根据给药前后单个细胞的FI值计算出细胞内〔Ca2+〕i。每组设2个平皿,并用不同代细胞重复3次。依据Grynkiewicz公式,计算〔Ca2+〕i。
1.5 统计学分析 采用SPSS17.0统计软件分析,计量数据以s表示,组间比较采用方差分析。
2 结果
2.1 RASMCs的鉴定 原代培养的RASMCs大小不等,形状多样,呈梭形或者三角形等形状;传代培养的RASMCs形态多呈梭形或者长梭形。透射电镜见细胞胞质内大量纵行束样分布的肌丝,上述结果表明所获细胞为RASMCs。见图1。

图1 RASMCs的生长情况
2.2 RASMCs内〔Ca2+〕i的测定 各组细胞加ET刺激前,即静息状态下〔Ca2+〕i无显著差异(P>0.05),亦未发生自主性上升,只是因指示剂的衰减,荧光强度略有递减的趋势。加ET刺激后,A1组RASMCs在短时间内(约1 min)钙离子浓度迅速、显著增加(即峰值升高相),与加 ET前比较有显著差异(P<0.01);A2组RASMCs内〔Ca2+〕i上升明显增强,与 A1组比较差异显著(P<0.01)。B1及B2组RASMCs内〔Ca2+〕i无明显变化,与加ET前比较无显著差异(P>0.05);与A1组加ET后比较差异显著(P<0.01)。见表1。
表1 各组RASMCs内〔Ca2+〕i的变化( s,nmol/L)
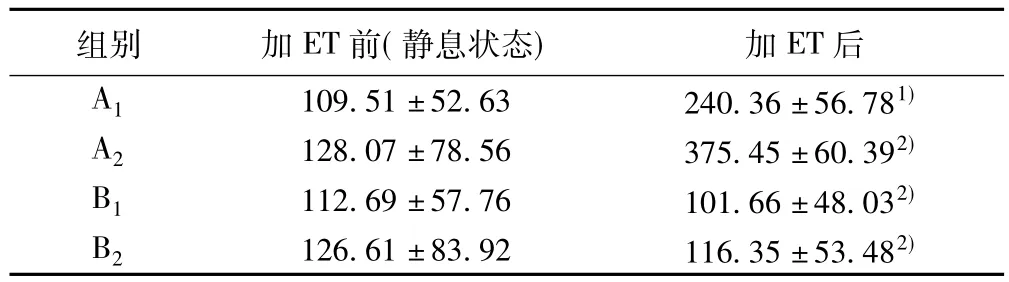
表1 各组RASMCs内〔Ca2+〕i的变化( s,nmol/L)
与加ET前比较:1)P<0.01;与A1组加ET后比较:2)P<0.01
组别 加ET前(静息状态)加ET后A1 109.51±52.63 240.36±56.781)A2 128.07±78.56 375.45±60.392)B1 112.69±57.76 101.66±48.032)B2 126.61±83.92 116.35±53.482)
3 讨论
HRS是重型肝炎和严重肝病最常见的并发症〔6〕。肾入球动脉平滑肌的舒缩对于肾皮质血流量的调节具有直接作用。本研究探讨TNF-α对RASMCs收缩及胞内Ca2+的影响。应用酶消化及筛网技术提取RASMCs,并进行原代培养,通过透射电镜观察胞质内的肌丝证实已成功分离培养RASMCs。
当HRS发生时,患者血清中内皮素等多种缩血管活性物质水平明显增高,并可直接或通过间接途径引起肾血管收缩,是导致肾血流灌注和肾功能紊乱的重要介质。血管平滑肌的舒缩直接受细胞内Ca2+水平的影响〔7〕,高浓度Ca2+可引起细胞收缩,低浓度Ca2+可引起细胞舒张,因此监测细胞内〔Ca2+〕i变化能反映细胞的舒缩状态。最近的实验研究发现,许多细胞因子可以使细胞内Ca2+水平增高,使效应细胞发生生物反应〔8〕。本实验结果说明 TNF-α可使内皮素刺激后的胞内〔Ca2+〕i增高。
1,4,5-三磷酸肌醇受体(IP3R)是平滑肌细胞内主要的Ca2+释放通道,当某些缩血管活性物质作用于细胞膜上的相应受体后,细胞内出现高水平的IP3,增高的IP3与IP3R结合,导致细胞内储备Ca2+释放,结果使效应细胞发生生物反应〔9〕。当HRS发生时,许多缩血管活性物质(如内皮素、血管紧张素Ⅱ、血管加压素、血栓素A2、白三烯等)明显增高〔10〕,作用于平滑肌细胞,引起胞内IP3水平增高,而致肾血管收缩。本研究结果显示,TNF-α增强内皮素刺激引起胞内Ca2+释放的作用可被2-APB阻断。故认为TNF-α间接影响胞内〔Ca2+〕i,是通过IP3R来起作用的。综上所述,内皮素刺激可使RASMCs在短时间内胞内〔Ca2+〕i迅速、显著增加。TNF-α作用后上述效应明显增强,且此效应可被2-APB阻断,证明了TNF-α可增强内皮素刺激引起的胞内钙离子释放进而增强细胞收缩,引起肾小球入球小动脉收缩,肾血流量减少,肾小球滤过率降低,参与HRS发生。上述研究不仅证明内皮素是通过激动IP3R而产生效应的;也证明了TNF-α可增强内皮素刺激引起的胞内Ca2+释放,且这一作用也是通过IP3R来调节的。
1 Yasuda H.Pathophysiology of sepsis induced acute kidney injury〔J〕.Nippon Jinzo Gakkai Shi,2010;52(5):562-5.
2 KiKi I,Yilmaz O,Erdem F,et al.Relationship between circulating levels of tumour necrosis factor-alpha and child-pugh scores in liver cirrhosis〔J〕.Int J Chin Pract,2007;61(3):20-7.
3 Rivera HS,Sanchez AR,Covarrubias PA,et al.Renal dysfunction as a consequence of acute liver damage by bile duct ligation in cirrhotic rats〔J〕.Exp Toxicol Pathol,2006;58(2-3):185-95.
4 Fuller AJ,Hauschild BC,Gonzalez-Villalobos R,et al.Calcium and chloride channel activation by angiotensinⅡ-AT1 receptors in preglomerular vascular smooth muscle cells〔J〕.Am J Physiol Renal Physiol,2005;289(1):F760-7.
5 Che Q,Carmines PK.Src family kinase involvement in rat preglomerular microvascular contractile and〔Ca2+〕i responses to ANG Ⅱ〔J〕.Am J Physiol Renal Physiol,2005;288(4):F658-64.
6 Wadei HM,Mai ML,Ahsan N,et al.Hepatorenal syndrome:pathophysiology and management〔J〕.Clin J Am Soc Nephrol,2006;1(5):1066-79.
7 Gerthoffer WT.Mechanisms of vascular smooth muscle cell migration〔J〕.Circ Res,2007;100(5):607-621.
8 Ida T,Hara M,Nakamura Y,et al.Cytokine-induced enhancement of calcium-dependent glutamate release from astrocytes mediated by nitric oxide〔J〕.Neurosci Lett,2008;432(3):232-6.
9 Mikoshiba K.IP3 receptor/Ca2+channel:from discovery to new signaling concepts〔J〕.J Neurochem,2007;102(5):1426-46.
10 Aulakh GK,Sodhi RK,Singh M.An update on non-peptide angiotensin receptor antagonists and related RAAS modulators〔J〕.Life Sci,2007;81(8):615-39.

