抑制COX-2/PGE2通路对胶质瘤细胞免疫抑制因子表达的影响
张向萍 张洪涛 修春明 迟 楠 崔广强 王云波 汤国太
(青岛大学医学院附属烟台毓璜顶医院药剂科,山东 烟台 264000)
胶质瘤是中枢神经系统最常见的肿瘤预后差,复发率高。环氧化酶-2(COX-2)在包括胶质瘤在内的多种人体肿瘤中均有较高水平的表达,而且与肿瘤的增殖、凋亡、血管生成、转移及免疫缺陷等有密切的关系;前列环素E2(PGE2)是COX-2的主要代谢产物〔1〕,因此COX-2/PGE2通路是肿瘤生物治疗的一个重要靶点。免疫逃逸是胶质瘤发生发展的一个重要因素,肿瘤微环境中分泌的免疫抑制因子是导致肿瘤免疫逃逸的主要原因。主要的免疫抑制因子包括转化生长因子-β(TGF-β)、血管内皮生长因子(VEGF)以及PGE2等〔2〕。本课题组前期研究发现胶质瘤COX-2表达上调,与肿瘤病理级别及增殖呈正相关〔3〕。本文观察选择性COX-2抑制剂celecoxib阻断COX-2/PGE2通路后对胶质瘤细胞主要免疫抑制因子表达的影响,探索COX-2抑制剂在胶质瘤免疫治疗中的作用机制。
1 材料与方法
1.1 主要材料 胶质瘤C6细胞株购自上海中国科学院生命科学研究所。RPMI1640粉剂为Gibco公司产品,RT-PCR试剂盒购自Takara公司,ELISA试剂盒购自晶美公司,COX-2单克隆抗体购自Santa Cruz公司,Western印迹试剂盒购于武汉博士德生物制品公司,celecoxib购自西尔公司(美国);10%小牛血清购自杭州四季青公司。
1.2 方法
1.2.1 Western印迹检测 celecoxib作用后C6细胞COX-2表达 取对数生长期的C6细胞,制备单细胞悬液(2×105个细胞/ml),按3 ml/孔接种于6孔板,待细胞贴壁后,分别更换含不同浓度(0,10,25,50,100 μmol/L)celecoxib 的培养基,继续培养24 h,胰酶消化收获各浓度药物作用的细胞,加入200 μl用冰预冷的细胞裂解液制备细胞总蛋白,Bradford方法测定蛋白质浓度。取蛋白溶液进行十二烷基硫酸钠-聚丙烯酰胺凝胶(SDS-PAGE)电泳分离,将凝胶中的蛋白电转移到硝酸纤维素滤膜上,5%脱脂奶粉中室温封闭1 h,随后加入抗COX-2抗体、抗β-肌动蛋白(β-actin)抗体,4℃孵育过夜,用磷酸盐缓冲液(PBS)洗3次,加入辣根过氧化物酶(HRP)标记的二抗,二氨基联苯胺(DAB,0.05%)-H2O2(0.01%)显色,对染色的蛋白质谱带进行扫描分析读取吸光度(A),计算其与β-actin的比值。
1.2.2 RT-PCR检测VEGF、TGF-β mRNA表达 取对数生长期的C6细胞,制备单细胞悬液(2×105个细胞/ml),按3 ml/孔接种于6孔板,待细胞贴壁后,更换含50 μmol/L celecoxib的培养基,继续培养48 h,对照组仅更换培养基。按照Trizol试剂说明书提取细胞总RNA,测其浓度,取总RNA 4 μg进行逆转录。PCR 反应体系为 50 μl,扩增条件:94℃ 5 min,94℃ 30 s、55℃ 1 min、72℃ 1 min×32个循环,72℃ 10 min(引物设计见表1)。取5 μl反应产物进行2%琼脂糖凝胶电泳,紫外灯下观察照相,凝胶成像系统分析灰度值,结果取目的基因条带与βactin条带灰度值的比值。
1.2.3 ELISA法检测celecoxib作用C6细胞后PGE2、VEGF、TGF-β分泌水平 C6细胞的制备同 RT-PCR实验,加入50 μmol/L celecoxib后,继续培养48 h,离心提取C6细胞上清液,根据 ELISA试剂盒说明操作,检测细胞上清中 PGE2、VEGF、TGF-β水平,每组设3个复孔,结果取3孔均值。

表1 引物设计
1.3 统计学方法 采用SPSS13.0软件进行分析,数据以s表示,多组均数比较采用完全随机设计资料的方差分析。
2 结果
2.1 celecoxib对C6细胞COX-2蛋白表达的影响 celecoxib作用后可明显下调 C6细胞 COX-2蛋白表达,10、25、50、100 μmol/L组及对照组 COX-2表达量分别为 0.81±0.03、0.68±0.02、0.32 ±0.02、0.19 ±0.02、0.92 ±0.03;且随 celecoxib浓度增加其作用更加明显。见图1。
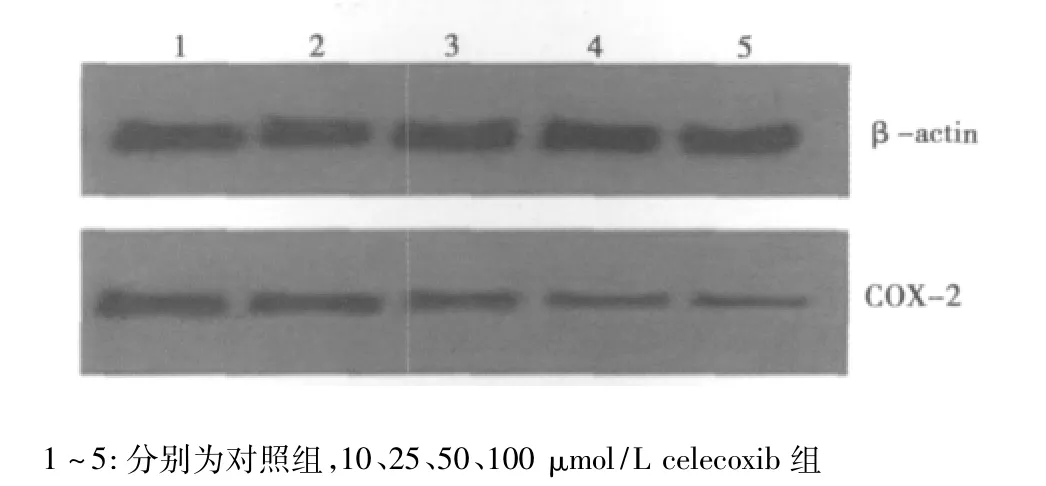
图1 不同浓度celecoxib对C6细胞COX-2表达的影响
2.2 celecoxib对 C6细胞VEGF、TGF-β mRNA表达的影响以50 μmol/L celecoxib 作用于 C6 细胞 48 h 后,VEGF、TGF-β mRNA的表达(0.65±0.67、0.58±0.49)均下调,与对照组(1.06±0.79、0.86±0.65)相比,其灰度比值明显降低(P<0.01)。
2.3 celecoxib对 C6细胞上清中 PGE2、VEGF、TGF-β 含量的影响 以50 μmol/L celecoxib作用于C6细胞48 h后,C6细胞上清中 PGE2、VEGF、TGF-β 水平(43.2 ±7.15、72.05 ±7.67、66.51±5.42)与对照组(95.71±14.02、116.0±12.45、104.15±10.67)比较均明显下降(P<0.01)。
3 讨论
近年来发现,以树突细胞(DC)为基础的免疫治疗可改善脑胶质瘤患者预后,是对胶质瘤传统治疗的一个重要补充。但由于肿瘤免疫逃逸现象的存在,极大地影响了胶质瘤免疫治疗的效果。因此,逆转胶质瘤免疫逃逸是改善胶质瘤治疗效果的有效途径。胶质瘤产生免疫逃逸现象与多种机制有关,其中一个重要机制是肿瘤微环境中可分泌大量的免疫抑制因子,包括PGE2、VEGF、TGF-β、双加氧酶(IDO)、白细胞介素-10(IL-10)、一氧化氮合酶2(NOS-2)等,均具有抑制免疫反应的功能,影响免疫细胞对肿瘤的杀伤作用。TGF-β在胶质瘤中具有较高的表达活性,可抑制T细胞、自然杀伤(NK)细胞、B细胞、单核细胞及巨噬细胞等免疫细胞的增殖,并诱导B细胞及T细胞凋亡,还可抑制胶质瘤组织相容性复合物(MHC-Ⅱ类分子)的表达以及抑制抗原提呈细胞活性〔2,4〕。TGF-β的存在可显著促进IL-10的分泌,IL-10能降低DC的表面分子如 MHC-Ⅱ、CD80及CD86等的表达率,抑制DC的分化成熟,抑制DC的抗原提呈能力,使其无法激活T细胞识别和杀伤肿瘤细胞,从而导致肿瘤细胞的免疫逃逸〔5〕。VEGF是一种34~42 kD的蛋白,可在早期影响DC前体细胞的发育分化,导致DC成熟障碍〔6〕。大量研究证实,COX-2在包括胶质瘤在内的多种恶性肿瘤中均有较高的表达水平,并影响肿瘤细胞的增殖、凋亡、转移、血管生成〔1〕;近来还发现COX-2与肿瘤免疫缺陷有密切的关系〔7〕。肿瘤组织高表达的COX-2可通过其催化产物PGE2,导致抗肿瘤免疫系统功能缺陷,使其无法有效识别和杀伤肿瘤细胞〔8〕。PGE2可提高细胞内cAMP水平,抑制巨噬细胞、自然杀伤细胞、T杀伤细胞的活性,抑制干扰素(IFN)-γ、IL-1、IL-2等细胞因子产生,进而抑制机体免疫反应;COX-2/PGE2可以调控TGF-β 及 VEGF 的表达〔9〕。
本课题组在前期研究中,同样证实了COX-2在高级别胶质瘤组织中具有较高的表达水平,并发现PGE2可改变DC表面分子的表达谱,使其抗原提呈能力减弱,而celecoxib可以部分逆转这一作用。本文进一步观察到,celecoxib可抑制胶质瘤细胞COX-2的表达,使其分泌PGE2减少,并可下调 TGF-β及VEGF mRNA的表达,进而减少TGF-β、VEGF分泌。通过这一途径,可以明显改善胶质瘤免疫微环境,阻断其免疫逃逸的发生,并增强其对DC疫苗等免疫治疗的效应。进而我们设想,celecoxib联合DC疫苗可能会具有更好的抗肿瘤效应,或许是提高胶质瘤治疗效果的有效途径。
1 El-Sayed M,Taha MM.Immunohistochemical expression of cycloxygenase-2 in astrocytoma:correlation with angiogenesis,tumor progression and survival〔J〕.Turk Neurosurg,2011;21(1):27-35.
2 Pellegatta S,Cuppini L,Finocchiaro G.Brain cancer immunoediting:novel examples provided by immunotherapy of malignant gliomas〔J〕.Expert Rev Anticancer Ther,2011;11(11):1759-74.
3 张洪涛,修春明,田 苗,等.环氧化酶-2和表皮生长因子受体在星形细胞瘤中表达的意义〔J〕.中国医师杂志,2010;12(2):185-7.
4 Zagzag D,Salnikow K,Chiriboga L,et al.Downregulation of major histocompatibility complex antigens in invading glioma cells:stealth invasion of the brain〔J〕.Lab Invest,2005;85(3):328-41.
5 Teicher BA.Transforming growth factor-beta and the immune response to malignant disease〔J〕.Clin Cancer Res,2007;13(21):6247-51.
6 Johnson BF,Clay TM,Hobeika AC,et al.Vascular endothelial growth factor and immunosuppression in cancer:current knowledge and potential for new therapy〔J〕.Expert Opin Biol Ther,2007;7(4):449-60.
7 Kalinski P.Regulation of immune responses by prostaglandin E2〔J〕.J Immunol,2012;188(1):21-8.
8 El-Sayed M,Taha MM.Immunohistochemical expression of cycloxygenase-2 in astrocytoma:correlation with angiogenesis,tumor progression and survival〔J〕.Turk Neurosurg,2011;21(1):27-35.
9 Tian M,Schiemann WP.PGE2 receptor EP2 mediates the antagonistic effect of COX-2 on TGF-beta signaling during mammary tumorigenesis〔J〕.FASEB J,2010;24(4):1105-16.

