成年和老年大鼠脑出血后海马齿状回神经干细胞增殖分化的比较
文玉军 王登科 孙 征 刘海洋 张莲香 王效军 秦 毅
(宁夏医科大学基础医学院人体解剖与组织胚胎学系,宁夏 银川 750004)
脑出血后(TCH),出血灶内神经元坏死,出血灶周围神经细胞大量凋亡,患者出现明显的神经功能障碍。减少出血灶周围神经元的凋亡,促进脑内神经干细胞(NSCs)增殖并向神经元分化对脑出血后患者的神经功能恢复有重要意义。脑出血多发于老年人,而目前大部分的研究是以成年动物为模型进行的〔1〕,因此,本研究比较成年和老年大鼠脑出血后海马齿状回NSCs的增殖、分化,探讨脑出血后NSCs的变化规律。
1 材料与方法
1.1 动物分组与模型制备 选用健康成年(3月龄,250~300 g)和老年(18~24月龄,400~550 g)SD大鼠,由宁夏医科大学实验动物中心提供,动物合格证号 SCXK(宁)20050001,分组如下:(1)检测细胞增殖的分组:实验组选用制备成功的成年和老年脑出血模型大鼠各30只,每组随机分为3、7、14、21、28 d五个亚组,每亚组 6 只;正常组成年和老年大鼠各6只;假手术组成年和老年大鼠各6只,术后7 d取材。全部按脉冲法标记。(2)检测细胞分化的分组:正常组和实验组成年和老年大鼠各6只,按累计法标记,术后28 d取材。(3)大鼠脑出血模型的制备:参照Rosenberg等〔2〕的方法加以改良,即选用0.5 U/μlⅦ型胶原酶和 6.25 U/μl肝素的混合液0.22 μl立体定位注射到大鼠尾状核建立脑出血模型。假手术组注入等量生理盐水,正常组大鼠不作任何手术处理。(4)大鼠行为学评分:参照Bederson评分标准〔3〕对造模后大鼠进行评分,选取1~4分大鼠用于后续实验。
1.2 BrdU标记增殖细胞 (1)脉冲标记:大鼠处死前24 h腹腔注射5 mg/ml的BrdU溶液,注射剂量为50 mg/kg,间隔4 h注射1次,连续注射3次,最后一次注射后24 h处死动物。此法用于标记NSCs的增殖变化。(2)累积标记:大鼠腹腔注射5 mg/ml的BrdU溶液,注射剂量为50 mg/kg,每天1次,连续注射3、28 d后处死大鼠。此法能标记较多的BrdU阳性细胞,用于检测增殖细胞的分化情况。
1.3 细胞增殖和分化的检测
1.3.1 BrdU免疫组化染色 经脉冲标记的各组大鼠按时间点常规心内灌注取脑,石蜡包埋,以注射针道为中心连续冠状切片,片厚7 μm,进行免疫组化(SP法)检测。切片60℃烘烤过夜,常规脱蜡至水正常山羊血清封闭(20 min,不冲洗),加入小鼠抗大鼠BrdU抗体(1∶100,4℃过夜),生物素标记的二抗工作液(37℃,30 min),HRP标记的链霉卵白素工作液(37℃,30 min),DAB显色,苏木素复染,脱水,中性树胶封片。小鼠抗大鼠BrdU抗体购自北京中杉公司,选择推荐的乳腺癌标本作阳性对照、PBS代替一抗作阴性对照。
1.3.2 BrdU/神经元核抗原(NeuN)和BrdU/胶质纤维酸蛋白(GFAP)双标染色 经累计标记的各组大鼠按时间点常规灌注取脑,石蜡包埋,以注射针道为中心连续冠状切片,片厚7 μm,进行免疫组化双标(SAP/SP法)检测。BrdU染色除不滴加3%H2O2外,余步骤同前,用碱性磷酸酶复合物代替HRP复合物,滴加NBT/BCIP显色30 min(深蓝色)。然后分别行NeuN和GFAP染色DAB显色。小鼠抗大鼠NeuN抗体和兔抗大鼠GFAP抗体均购自北京中杉公司,PBS代替一抗作阴性对照。
1.4 结果观察及数据处理 每只大鼠选3~5张切片,在400镜下,每张切片取血肿周围海马齿状回5个不重复视野区,计数BrdU阳性细胞数和BrdU/NeuN或BrdU/GFAP双标细胞数,利用SPSS12.0统计软件进行数据统计,实验数据用s表示,进行方差齐性检验,方差齐采用多组间两两比较的方差分析q检验,方差不齐时采用秩和检验。
2 结果
2.1 大鼠行为学变化和脑出血灶病理学改变 模型组大鼠在术毕清醒后即可观察到神经功能缺损症状,出现脑出血灶对侧偏瘫症状,表现为肢体活动迟缓,进食减少,多数大鼠易倒不能卧立,有拖步行走或旋转爬行等神经功能缺损表现。术后6~24 h神经功能障碍最为明显,行为学评分值多为4分。脑组织HE染色显示患侧尾状核部位神经元大量坏死,形成出血坏死灶,周围脑组织疏松,细胞肿胀,有炎性细胞浸润,毛细血管管壁肿胀、破裂。
2.2 成年和老年大鼠海马齿状回BrdU阳性细胞数的变化及相互比较 正常组、假手术组和各出血组成年和老年大鼠的双侧海马齿状回均可见BrdU阳性细胞,主要分布在颗粒下区(SGZ),细胞形态圆而规则,着色均匀。正常组、假手术组大鼠BrdU阳性细胞较少,散在分布,胞核呈圆形淡染,两组阳性细胞数量无显著性差异(P>0.05),但成年大鼠两组BrdU阳性细胞明显多于老年大鼠(P<0.01)。见图1。
成年和老年各出血组BrdU阳性细胞明显增加,与正常组、假手术组相比有显著性差异(P<0.01)。出血侧SGZ区的BrdU阳性细胞数在术后3 d明显增多,7 d达到峰值,14 d后BrdU阳性细胞逐渐减少,28 d时仍高于正常组和假手术组,且成年大鼠各时间点BrdU阳性细胞均高于老年大鼠(P<0.01)。出血对侧SGZ区也可见BrdU阳性细胞增多,7 d时达到峰值,之后逐渐下降,与正常组、假手术组相比,各时段均有显著性差异(P<0.01),且成年大鼠阳性细胞数均高于老年大鼠,差异有统计学意义(P<0.01)。出血对侧BrdU阳性细胞增加的幅度均较相应出血侧低,两侧比较有显著性差异(P<0.01)。见图2,图 3,见表 1。
表1 成年和老年大鼠脑出血后双侧SGZ区BrdU阳性细胞数变化(个/单位面积,n=6,s)

表1 成年和老年大鼠脑出血后双侧SGZ区BrdU阳性细胞数变化(个/单位面积,n=6,s)
与老年大鼠比较:1)P<0.01;与正常组比较:2)P<0.01;与假手术组比较:3)P<0.01;与出血对侧比较:4)P<0.01
组别 成年大鼠脑出血侧43.97±4.29 44.57±3.20假手术组 54.17±3.481) 52.47±4.67 45.60±3.38 45.10±3.52脑出血后3 d 102.53±2.981)2)3) 61.27±3.991)2)3)4) 80.07±5.271)2) 54.70±4.051)2)3)脑出血后7 d 171.20±5.011)2)3) 104.63±5.281)2)3)4) 129.20±7.941)2) 97.77±5.211)2)3)脑出血后14 d 119.33±5.701)2)3) 75.13±3.381)2)3)4) 110.63±5.561)2) 92.00±6.111)2)3)脑出血后21 d 99.00±4.611)2)3) 64.77±2.741)2)3)4) 68.03±6.251)2) 55.60±4.871)2)3)脑出血后28 d 65.17±3.241)2)3) 59.83±3.241)2)3)4) 55.13±3.811)2) 47.87±4.381)2)4)出血对侧正常组 52.30±3.491) 53.17±4.541)出血对侧成年大鼠脑出血侧
2.3 免疫组化双标结果 表2可见,和脉冲标记相比,累积标记的成年和老年大鼠脑内BrdU阳性细胞明显增多,在SGZ区、纹状体、胼胝体均可见大量的BrdU阳性细胞,而且成年大鼠多于老年大鼠。免疫组化双标结果显示,双标细胞主要见于SGZ周围,正常大鼠脑内可见少量散在双标细胞,脑出血后双标细胞数明显增加(P<0.01)。BrdU/NeuN双标细胞核大深染呈圆形,中央呈深蓝色BrdU阳性,周边呈棕色NeuN阳性(图4),BrdU/GFAP双标细胞核蓝色浅染呈椭圆形,突起呈棕色长短不一(图5)。其中老年大鼠BrdU/GFAP双标细胞阳性率明显高于成年大鼠,而BrdU/NeuN双标细胞阳性率则明显低于成年大鼠,两组比较均有显著性差异(P<0.01)。
表2 成年和老年大鼠脑出血后SGZ区双标阳性细胞数变化(个/单位面积,n=6,s)

表2 成年和老年大鼠脑出血后SGZ区双标阳性细胞数变化(个/单位面积,n=6,s)
与正常组比较:1)P<0.01;与成年大鼠比较:2)P<0.01
8.63±1.52 20.20±3.08 5.77±1.10 13.37±1.33 28 d组 24.60±3.341) 23.90±2.991)15.77±2.051)2)26.27±3.421)2)BrdU/NeuN BrdU/GFAP正常组组别 成年大鼠BrdU/NeuN BrdU/GFAP 老年大鼠

图1 正常成年和老年大鼠海马齿状回SGZ区BrdU阳性细胞(SP法,×400)
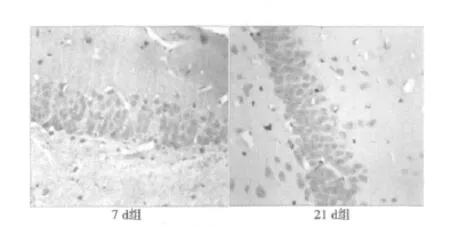
图2 成年大鼠脑出血后出血侧SGZ区BrdU阳性细胞(SP法,×400)

图3 老年大鼠脑出血后出血侧SGZ区BrdU阳性细胞(SP法,×400)
3 讨论
在成体中枢神经系统,NSCs主要存在于脑室的室管膜下层(SVZ)和海马齿状回SGZ〔4〕,NSCs具有星形胶质细胞的特性,从神经管至脑发育晚期一直存在,后形成放射状胶质,是新形成神经元的父本并指导新神经元的迁移〔5〕。NSCs在自然增殖过程中不断增殖分化,并迁移到特定区域,以取代老化的神经元,从而保护脑结构和功能的完整性〔6〕。生理状态下,成体脑内SVZ和SGZ的NSCs大部分处于静止期,在运动、学习、环境改变或脑缺血、缺血再灌注、脑梗死等病理性因素刺激下,其增殖分化可明显增强〔7〕。脑损伤能不同程度地激活脑内NSCs,促进其增殖、分化并迁移至受损部位,参与损伤后神经结构重建和功能恢复〔8〕。

图4 成年和老年大鼠脑出血后SGZ区BrdU/NeuN双标细胞(SAP/SP法,×400)

图5 成年和老年大鼠脑出血后SGZ区BrdU/GFAP双标细胞(SAP/SP法,×400)
本研究结果显示,随着出血时间的推移,出血灶不断机化、缩小,病理刺激减轻等因素有关。出血对侧BrdU阳性细胞数较出血侧少,但两侧细胞增殖的变化规律是一致的,提示虽然出血对侧受到的伤害性刺激相对较弱,但脑出血后机体处于应激状态,脑微环境的变化可能对双侧脑区NSCs的数量及其增殖活性均有很大影响,另外也可能与机体神经体液调节等作用有关〔9〕。Veizovic等〔10〕将标记的 NSCs植入成年大鼠缺血对侧的脑组织,经免疫组化染色发现缺血侧脑组织有移植的NSCs出现,结合本研究,提示成年后脑内可能还保留有早期的细胞迁移机制,并可在脑出血等脑损伤后得以活化、启动。
研究表明海马与学习、记忆密切相关,在SGZ每天可产生大量的新生神经元〔11〕,但随着年龄的增长SGZ的NSCs增殖能力会不断下降〔12〕。本研究结果提示脑老化后微环境的变化可能对相关脑区NSCs的数量或其增殖活性有影响。通过连续3 d给大鼠腹腔注射BrdU观察成年和老年大鼠脑出血后SGZ增殖细胞的分化情况,免疫组化结果显示,BrdU/NeuN和 BrdU/GFAP双标细胞主要见于SGZ周围脑区,脑出血后双标细胞数明显增加。在脑缺血、脑出血等脑损伤后,脑内会释放各种刺激因子,如SDF-1因子、凝血酶、促红细胞生成素等,同时与神经生长有关的生长因子、营养因子和细胞因子等也相继释放〔13〕,这些因素可促进SGZ干细胞的增殖与分化,除了分化产生新生神经元以补充神经元的丢失外,还产生大量的胶质细胞参与病灶的瘢痕修复。与成年相比,老年后脑内微环境的变化使某些营养因子缺乏,有害物质积聚,使得NSCs的增殖分化受到抑制,另外,老年后脑内毛细血管明显减少,其超微结构及血管形状发生明显变化,脑血流量也显著下降,这些变化不仅可导致原有神经元的退行性变,还直接影响新生神经元的增殖和存活〔14〕。
1 Li Y,Chopp M.Temporal profile of nestin expression after focal cerebral ischemia in adult rat〔J〕.Brain Res,1999;838(1-2):1-10.
2 Rosenberg GA,Mun-Bryce S,Wesley M,et al.Collagenase-induced intracerebral hemorrhage in rats〔J〕.Stroke,1990;21(5):801-7.
3 Bederson JB,Pitts LH,Tsuji M,et al.Rat middle cerebral artery occlusion:evaluation of the model and development of a neurologic examination〔J〕.Stroke,1986;17(5):472-6.
4 Doetsch F,Caille I,Lim DA,et al.Subventricular zone astrocytes are neural stem cells in the adult mammalian brain〔J〕.Cell,1999;97(6):703-16.
5 袁琼兰,刘小青.干细胞治疗缺血性脑损伤的研究进展〔J〕.解剖学杂志,2011;34(3):281-4.
6 Kuhu HG,Dickinson-Anson H,Gage FH.Neurogenesis in the dentate gyrus of the adult rat:age-related decrease of neuronal progenitor proliferation〔J〕.Neurosci,1996;16(6):2027-33.
7 Prickaerts J,Koopmans G,Blokland A,et al.Learning and adult neurogenesis:survival with or without proliferation〔J〕?Neurobiol Learn Mem,2004;81(1):1-11.
8 刘远新,苗常青.脑梗死与内源性神经干细胞的研究进展〔J〕.齐齐哈尔医学院学报,2007;28(8):963-5.
9 Udo H,Yoshida Y,Kino T,et al.Enhanced adult neurogenesis and angiogenesis and altered affective behaviors in mice overexpressing vascular endothelial growth factor〔J〕.J Neurosci,2008;28(53):14522-36.
10 Veizovic T,Beech JS,Stroemer RP,et al.Resolution of stroke deficits following contralateral grafts of conditionally immortal neuroepithelial stem cells〔J〕.Stroke,2001;32(4):1012-9.
11 Gage FH.Mammalian neural stem cells〔J〕.Science,2000;287(5457):1433-8.
12 汪建民,袁群芳,姚志彬.大鼠室管膜下区和齿状回神经前体细胞增殖的衰老性变化〔J〕.神经解剖学杂志,2002;18(1):17-20.
13 Hua Y,Keep RF,Hoff JT,et al.Brain injury after intracerebral hemorrhage:the role of thrombin and iron〔J〕.Stroke:2007;38(1):759-62.
14 Raddle DR,Sonntag WE,Lichtenwalner RJ.Microvascular plasticity in aging〔J〕.Aging Res Rev,2003;2(2):149-68.

