NF-κB和P53与外周动脉疾病的关系
陈 颖 胡有东 李 侠 徐培敬 (徐州医学院附属淮安医院老年科,江苏 淮安 223002)
外周动脉疾病(PAD)是除心脑动脉以外的动脉血管疾病。PAD是冠心病的等危症,患者不仅易出现行走能力受损等,而且增加冠心病、脑卒中等疾病死亡风险〔1,2〕。由于PAD基本机制为动脉粥样硬化,近期研究表明mimecan在动脉粥样硬化病变中发挥着重要作用〔3〕,但作用机制不明,而在mimecan基因的第1个内含子上有NF-κB和P53的结合位点,因此研究NF-κB和P53在动脉粥样硬化病变中的作用有着重要的意义。
1 材料与方法
1.1 研究对象和分组 选择2009年4月至2011年2月淮安市第二人民医院老年科PAD患者共84例,年龄50~75岁,男43例,女41例。所有患者均符合PAD的临床诊断标准〔4〕,按照Fontaine临床分级将所有入选病例分成四组,分别为Ⅰ级组23例,男12例,女11例,年龄50~67岁,平均(56.81±8.23)岁;Ⅱ级组22例,男 10例,女 12例,年龄 53~70岁,平均(57.8±7.57)岁;Ⅲ级组 24例,男 13,女 11例,年龄 55~75岁,平均(58.36±5.93)岁;Ⅳ级组15例,男8,女7例,年龄56~75岁,平均(58.21±6.39)岁。健康对照组20例,男10例,女10例,年龄50~75岁,平均(57.61±5.37)岁。各组间年龄、性别差异无统计学意义(P>0.05)。
1.2 方法 (1)踝臂指数(ABI)测定:ABI测量采用美国心脏病学会(AHA)推荐的方法,室温下,患者取仰卧位,使用鱼跃牌水银血压计常规测量双侧肱动脉收缩期血压并取其平均值,若两侧血压差值>10 mmHg,则以高值作为肱动脉收缩压。将袖带缚于小腿远端靠近踝关节处,以同样的方法测得同侧胫后动脉和足背动脉血压,取其中的高值作为踝部收缩压。最后用选定的踝部收缩压除以选定的肱动脉收缩压,所得的值即这一侧的ABI,双侧的 ABI均需测量,取其中的低值作为患者的ABI〔5〕。(2)NF-κB 和 P53 的检测:NF-κB 和 P53 的测定采用酶联免疫法(ELISA)检测(美国BIO-RAD伯乐酶标仪),试剂盒购自Diagnostic Systems Laboratories INC公司,操作严格按照说明书进行。
1.3 统计学方法 所有数据采用SPSS13.0统计软件进行分析,计量资料以s表示,采用单因素方差分析各组间差异。采用直线相关分析判断NF-κB和P53与外周动脉疾病严重程度的相关性。
2 结果
2.1 NF-κB和P53在不同程度PAD中的表达 PAD组NF-κB和P53明显高于对照组,(P<0.05),且各组间两两比较发现各组间差异均有统计学意义(P<0.05)。见表1。
2.2 NF-κB和 P53与 PAD严重程度的相关性 NF-κB和P53与PAD严重程度呈正相关,相关系数分别为0.76、0.68(P<0.05),即NF-κB和P53与PAD通过氧化应激等机制存在明显的正相关性,且随着外周动脉疾病严重程度的加重,所以通过检测NF-κB和P53的表达程度,对判断PAD的严重程度可能有一定益处。
2.3 NF-κB和P53在PAD间的相关性 在PAD中NF-κB和P53呈正相关(r=0.83,P<0.05),提示两者在外周动脉疾病中可能通过共同作用于mimecan基因的第1个内含子而起到相互促进的作用。
表1 NF-κB和P53在各组中的表达(s)
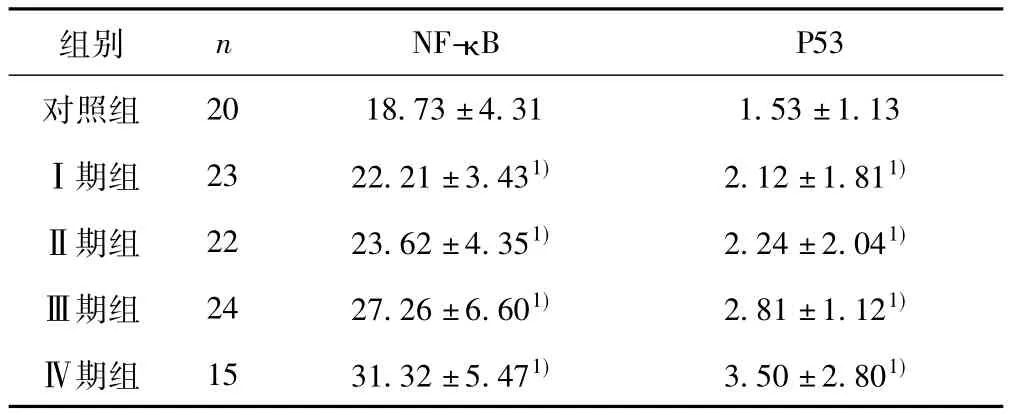
表1 NF-κB和P53在各组中的表达(s)
与对照组比较:1)P<0.05
P53对照组组别 n NF-κB 20 18.73±4.31 1.53±1.13Ⅰ期组 23 22.21±3.431) 2.12±1.811)Ⅱ期组 22 23.62±4.351) 2.24±2.041)Ⅲ期组 24 27.26±6.601) 2.81±1.121)Ⅳ期组 15 31.32±5.471) 3.50±2.801)
3 讨论
曾有多种学说从不同的角度来阐述动脉粥样硬化斑块的发病机制,从最早的脂肪浸润学说,到后来的损伤-反应学说,及细胞增殖学说等,均未阐述NF-κB、P53在动脉粥样硬化斑块中的相关作用,而在我们的研究中发现NF-κB、P53两者呈正相关,它们在动脉粥样硬化斑块形成中的作用机制可能是通过Minecan基因所实现。已有研究证实NF-κB是动脉粥样硬化斑块的启动因子〔6〕,静息状态下,NF-κB 与其抑制亚单位(IκB)结合与胞浆中,NF-κB的激活主要是通过降解IκB来实现的。各种危险因子(高脂血症、高血糖、糖尿病、感染源等)通过细胞膜激活IκB激酶,使IκB磷酸化,然后与多个泛素结合,进而由蛋白激酶降解NF-κB游离于胞质中,胞质中的NF-κB易位至细胞核,与脱氧核糖核酸(DNA)分子炎症反应调节蛋白Minecan基因中的NF-κB结合点相结合,调控各种炎症因子如肿瘤坏死因子(TNF)、干扰素(IFN)、IL-1、IL-6、血管细胞黏附分子-1(VCAM-1)、细胞间黏附分子(ICAM-1)、E-选择素趋化因子MCP-1等。这些细胞炎症因子通过各种相同或不同的信号通路来促进动脉粥样硬化斑块的发生发展。
P53抑癌基因是目前唯一研究较明确的、定位于细胞核内的抑制细胞增殖的抑癌基因,在生理情况下P53发挥其抑癌作用,抑制动脉血管平滑肌细胞、巨噬细胞等过度分裂〔7〕,进而抑制动脉粥样硬化斑块的形成,即它们处在一种动态平衡,但是当动脉内皮损伤或其他动脉粥样硬化斑块形成的危险因素出现时,这种平衡将被打破,动脉粥样硬化形成的危险因素超过P53作用时,P53将代偿性升高,与本文结果一致,即动脉粥样硬化严重组(Ⅳ期组)P53值高于对照组及其他实验组,当其失去代偿性能力时,动脉粥样硬化斑块形成速度将加快;另外,动脉粥样硬化斑块形成的各种危险因素也可能作用于P53,因此动脉粥样硬化斑块形成的机制可能是NF-κB和P53之间的动态平衡被打破的过程。
目前虽然对动脉粥样硬化斑块形成的机制研究较多,但对其形成确切机制仍不是很清楚,因此我们的研究从一个侧面表明NF-κB和P53可能在动脉粥样硬化斑块的形成中起着重要作用,为研究动脉硬化粥样斑块形成机制提供一个新的思路。
1 Sigvant B,Henriksson M,Lundin F,et al.Asymptomatic peripheral arterial disease:is pharmacological prevention of cardiovascular risk cost-effective〔J〕?Eur J Cardiovasc Prev Rehabil,2011;18(2):254-61.
2 Hussein AA,Uno K,Wolski K,et al.Peripheral arterial disease and progression of coronary atherosclerosis〔J〕.Am Coll Cardiol,2011;57(10):1220-5.
3 Tasheva ES,Koester A,Paulsen AQ,et al.Minecan/osteoglycind efficient mice have collagen fibril abnormalities〔J〕.Mol Vis,2002;31(8):407-15.
4 Cassar K.Peripheral arterial disease〔J〕.Clin Evid,2011;29(3):XI.
5 Potier L,Abi Khalil C,Mohammedi K,et al.Use and utility of ankle brachial index in patients with diabetes〔J〕.Eur J Vasc Endovasc Surg,2011;41(1):110-6.
6 Wilkins R,Tucci M,Benghuzzi H.Role of plant-derived antioxidants on NF-κB expression in LPS-stimulated macrophages-biomed 2011〔J〕.Biom Sci Instrument,2011;47(2):222-7.
7 Boesten LS,Zadelaar AS,van Nieuwkoop A,et al.Macrophage p53 controls macrophage death in atherosclerotic lesions of apolipoprotein E deficient mice〔J〕.Atherosclerosis,2009;207(2):399-404.

