骨骼肌特异性microRNA-206在骨骼肌卫星细胞再生过程中的表达
于新凯 左群
上海体育学院,运动健身科技省部共建教育部重点实验室(上海200438)
尽管运动性骨骼肌损伤 (Exercise-induced Skeletal Muscle Injury)和修复一直是运动医学界研究的热点问题之一,但是骨骼肌损伤后再生修复过程中的许多机制性问题并未解决。卫星细胞的发现推动了骨骼肌再生研究的飞速发展。现已证实,所有哺乳动物的骨骼肌都具有再生能力,卫星细胞是肌肉损伤后功能修复的唯一来源。卫星细胞位于肌细胞膜与基膜之间,正常生理状态下处于静息状态,肌肉损伤时被激活进入分裂期,不断增殖、融合为肌管,随后收缩蛋白和调节蛋白开始表达,胞质中出现肌原纤维,核移位于细胞边缘,分化成为成熟的肌纤维。近年来的研究表明,microRNA可能在卫星细胞的增殖分化过程中起到重要作用。
1 MicroRNA
1993年Lee等[1]发现了第一个非编码小分子RNA lin-4,2000 年 Reinhart[2,3]在 C.elegans 中发 现了let-7,并将这类能调控发育进程的内源性单链小分子非编码RNA命名为microRNA。目前已经发现的几百种microRNA中,仅少数microRNA功能和靶基因得到实验证实[4]。
探明这些microRNAs的功能以及靶mRNA对于人类疾病治疗有重要意义。和其他基因相同,MicroRNA也是由基因组编码和转录生成。MicroRNA首先转录生成一种大小在300~1000个核苷酸的初级microRNA,经细胞核中核糖核酸酶Drosha等剪切后进一步生成具有70~100个核苷酸的前体 microRNA,转运至胞浆后在另一种核糖核酸酶Dicer的作用下生成成熟的microRNA,成熟的microRNA长度约为19~22个核苷酸,其序列在物种间高度保守,目前尚未明确其降解机制。
MicroRNA通过与相应的靶mRNA的3’端非编码区域结合,阻止翻译的起始或破坏mRNA的稳定性,实现对基因表达的转录后调节,在调控生物体正常发育等生理过程中扮演重要角色。
2 MicroRNA-206的相关研究
2.1 MicroRNA-206在卫星细胞增殖分化过程中的作用
MicroRNA-206 最 初 是 由 Lagos-Quintana 等[5]在2003年从人和小鼠肌肉组织中克隆鉴定出来的,其长度为22个核苷酸,编码基因位于6号染色体。Chen等[6]在2006年通过基因芯片检测到microRNA-206在骨骼肌细胞分化成熟过程中表达增加,且呈现一定的时空特异性。
Yuasa等[7]观察了mdx小鼠和心毒素造成损伤的狗胫骨前肌中各种microRNA的表达,发现:microRNA-206表达显著提高,而microRNA-1和-133则无显著性变化;原位杂交结果显示microRNA-206位于新生成的中位核的肌管中以及再生的肌纤维中,在变性但完整的肌纤维中则未出现,提示microRNA-206可能具有激活再生和促进肌纤维成熟的作用。
John等[8]通过切除协同肌造成跖肌肥大,发现对照组无论是跖肌还是比目鱼肌中microRNA-206与primary microRNA-206的表达高度一致,有趣的是比目鱼肌中microRNA-206的表达量是跖肌的7倍,说明microRNA-206可能具有决定不同类型肌纤维的作用。但是在肥大的跖肌中primary microRNA-206的转录水平提高了18.3倍,而microRNA-206的表达则没有明显的改变。因作者选取的是肥大早期的肌肉,是否在此后的某时间点可能会出现二者相一致的变化,或者出现快肌向慢肌的转化?需要进一步研究探讨,如果出现,则说明microRNA-206可能参与调节肌纤维类型。
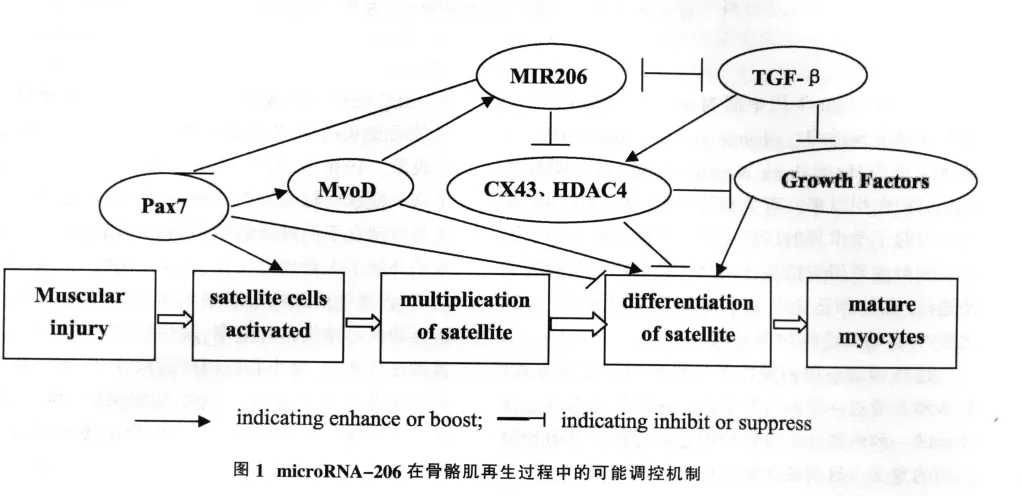
目前已发现多种转录因子能够激活并促进microRNA的转录过程,例如肌细胞分化因子(MyoD)能够促进横纹肌特异性microRNA的表达,促进心肌和骨骼肌的分化发育。已经证实MyoD可激活骨骼肌的分化,刺激microRNA-206的表达,Kim等[9]发现microRNA-206可通过下调MyoD的抑制因子MyoR等上调MyoD基因,这种microRNA与生肌转录调节因子之间的正反馈调节可使平衡向肌分化方向转化,导致肌细胞的永久分化。
Pax7转录因子是卫星细胞生物合成、存活和自我更新所必需的,在卫星细胞识别、激活上游bHLH转录因子MyoD家族过程中起到关键作用。大多数被激活的卫星细胞下调Pax7、维持MyoD的表达以进入分化阶段。Pax7上调则通过抑制MyoD诱导myogenin 的表达从而抑制肌肉合成[10,11]。
MicroRNA-206调节的直接靶基因包括connexin 43 (CX43)、HDAC4 等。 TGF-β 则与 microRNA-206之间存在相互的负反馈调节。骨骼肌成肌分化过程中CX43、HDAC4可抑制其特定基因的表达,microRNA-206通过抑制CX43、HDAC4诱导肌肉特定基因的表达,该过程可能涉及各种生长因子表达的上调 (如IGF-I),TGF-β 则通过抑制microRNA-206的表达来抑制成肌分化,TGF-β使HDAC4表达升高,随后肌肉特定基因表达受到抑制[12-14]。
2.2 运动与MicroRNA-206的相关研究
研究[15]发现:雄性C57Bl/6J小鼠进行一次耐力性运动(15 m/min,90 min)后3小时,股四头肌 microRNA-181,-1,-107分别升高 37%、40%和 56%,microRNA-23下降 84%,microRNA-133无变化。microRNA mRNA表达相关的Drosha、Dicer和DGCR8无变化,推测microRNA介导的转录后调节可能参与骨骼肌对耐力性运动适应的复杂调控网络。但遗憾的是作者并未观察骨骼肌特异性microRNA-206的变化,而且microRNA在运动后的变化究竟是对运动训练的适应还是由于损伤所导致并不清楚。
10名正常青年男性参与了高胰岛素正常葡萄糖钳夹实验、急性耐力训练和12周耐力训练[16],高胰岛素正常葡萄糖钳夹实验发现股外侧肌中microRNA-1、microRNA-133a、microRNA-133b和 microRNA-206在实验前后保持稳定;急性耐力训练microRNA-1、microRNA-133a训练前升高而不是训练后;12周耐力训练后四种microRNAs均下降。所有myomicroRNAs训练停止后14天均恢复到训练前水平。结果提示myomicroRNAs可对生理刺激作出反应,但在调节人体骨骼肌适应中的作用不清。
同化刺激[17](一次抗阻训练+20克富含亮氨酸的必需氨基酸补充)后,青年男性骨骼肌 primary和成熟microRNA表达对同化刺激更敏感,老年人则具有更高的基础primary microRNA表达,并对同化刺激反应失调(不敏感)。
太空飞行[18]会导致肌萎缩及向快型肌肉转化,腓肠肌中慢氧化性肌纤维中相关基因下调,Myostatin表达上调,同时也发现microRNA-206显著下降,可能也说明microRNA-206在调节肌纤维类型中具有一定的作用。
运动与microRNANA-206的相关研究较少,其具体机制也有待于进一步研究。
2.3 MicroRNA-206与相关疾病的研究
MicroRNA-1/206在横纹肌肉瘤RD细胞系中处于非常低的水平,将microRNA-1/206瞬时转染入培养的RD细胞中可导致细胞生长和迁移的显著下降。抑制microRNA-1/206功能会引起细胞增殖和迁移异常,导致横纹肌肉瘤的发生[19]。 Mishra 等[20]证实microRNA-1/microRNA-206在低分化型横纹肌肉瘤中丧失表达,但在成熟骨骼肌中特征性表达,恢复成肌分化过程、抑制肿瘤表型,提示microRNA的再表达疗法可能成为阻断肿瘤基因、抑制肿瘤发展的新方法。
近年来的一项研究[21]发现:血液中骨骼肌特异性miRNAs水平在横纹肌肉瘤患者中较其他肿瘤患者高。该结果说明循环中肌肉特异性microRNAs尤其是microRNA-206可作为鉴别界定横纹肌肉瘤的生物标记物,同时也提示:血液中microRNA-206是否也可作为检测骨骼肌损伤的特异性标记物?
肌肉损伤非常普遍,但是至今仍未建立最有效的疗法。有研究[22]在胫骨前肌撕裂伤后损伤部位注射双链 microRNA-1、-133、-206,1 周后发现 microRNAs促进了肌肉形态学和生理学再生,有效预防了纤维化。外源性双链microRNA-1、-133、-206注入 3、7天可诱导成肌标志物 MyoD1,myogenin,Pax7 mRNA和蛋白水平的表达,抑制myostatin的表达,结果提示局部注射microRNA-1、-133和-206可能成为治疗骨骼肌损伤的新方法。
3 总结与展望
从已有的研究可以看出:microRNA-206是骨骼肌特异性microRNA,在骨骼肌再生、分化等过程中起着重要作用,但其具体调节机制有待于进一步研究,生肌调节因子与microRNA-206的相互作用机理也并未阐明。目前的相关研究缺乏对正常骨骼肌组织中卫星细胞培养过程中microRNA-206变化的观察;针对骨骼肌损伤修复过程中作用和变化的在体研究较少,而有关运动性骨骼肌损伤修复过程中microRNA-206的研究则未见报道,今后可适当关注。
综合以上研究,我们总结了microRNA-206在骨骼肌再生过程中的可能调控机制如下图:
[1]Lee RC,Feinbaum RL,Ambros V.The C.elegans heterochronic gene lin-4 encodes small RNAs with antisense complementarity to lin-14.Cell,1993,75(5):843-854.
[2]Reinhart BJ,Slack FJ,Basson M,et al.The 21-nucleotide let-7 RNA regulates developmental timing in Caenorhabditis elegans.Nature,2000,403(6772):901-906.
[3]Pasquinelli AE,Reinhart BJ,Slack F,et al.Conservation of the sequence and temporal expression of let-7 heterochronic regulatory RNA.Nature,2000,408(6808):86-89.
[4]Bartel DP.MicroRNAs:genomics,biogenesis,mechanism,and function.Cell,2004,116,281–297.
[5]Lagos-Quintana M,Rauhut R,Meyer J,et al.New microRNAs from mouse and human.RNA,2003,9(2):175-179.
[6]Chen JF,Mandel EM,Thomson JM,et al.The role of microRNA-1 and microRNA-133 in skeletal muscle proliferation and differentiation.Nat Genet,2006,38(2):228-233.
[7]Yuasa K,Hagiwara Y,Ando M,et al.MicroRNA-206 is highly expressed in newly formed muscle fibers implications regarding potential for muscle regeneration and maturation in muscular dystrophy.Cell Struct Funct,2008,33(2):163-169.
[8]John J McCarthy,Karyn A.Esser MicroRNA-1 and microRNA-133a expression are decreased during skeletal muscle hypertrophy.J Appl Physiol,2007,(102):306-313.
[9]Kim HK,Yong SL,Umasundari S,et al.Muscle-specific microRNA miR-206 promotes muscle differentiation.JCB,2006,174(5):677–687.
[10]Dey BK,Gagan J,Dutta A.miR-206 and-486 induce myoblast differentiation by downregulating Pax7.Mol Cell Biol,2011,31(1):203-214.
[11]Chen JF,Tao Y,Li J,et al.microRNA-1 and microRNA-206 regulate skeletal muscle satellite cell proliferation and differentiation by repressing Pax7.J Cell Biol,2010,190(5):867-879.
[12]Chen JF,Callis TE,Wang DZ.MicroRNAs and muscle disorders.J Cell Sci,2009,1 (122):13-20.
[13]Curtis Anderson,Heath Catoe,Rudolf Werner.MIR-206 regulates connexin43 expression during skeletal muscle development.Nucleic Acids Res,2006,34 (20):5863–5871.
[14]Winbanks CE,Wang B,Beyer C,et al.TGF-{beta}regulates miR-206 and miR-29 to control myogenic differentiation through regulation ofhistone deacetylase 4(HDAC4).J Biol Chem,2011,286(16):13805-13814.
[15]Safdar A,Abadi A,Akhtar M,et al.miRNA in the regulation of skeletal muscle adaptation to acute endurance exercise in C57Bl/6J male mice.PLoS One,2009,4 (5):e5610.
[16]Nielsen S,Scheele C,Yfanti C,et al.Muscle specific microRNAs are regulated by endurance exercise in human skeletal muscle.J Physiol,2010,588(Pt 20):4029-4037.
[17]Drummond MJ,Glynn EL,Fry CS,et al.Essential amino acids increase microRNA-499, -208b,and-23a and downregulate myostatin and myocyte enhancer factor 2C mRNA expression in human skeletal muscle.J Nutr,2009,139(12):2279-2284.
[18]Allen DL,Bandstra ER,Harrison BC,et al.Effects of spaceflight on murine skeletal muscle gene expression.J Appl Physiol,2009,106(2):582-595.
[19]Yan D,Dong Xda E,Chen X,et al.MicroRNA-1/206 targets c-Met and inhibits rhabdomyosarcoma development.J Biol Chem,2009,284(43):29596-29604.
[20]Mishra PJ,Merlino G.MicroRNA reexpression as differentiation therapy in cancer.J Clin Invest,2009,119 (8):2119-2123.
[21]Miyachi M,Tsuchiya K,Yoshida H,et al.Circulating muscle-specific microRNA,miR-206,as a potential diagnostic markerforrhabdomyosarcoma.Biochem BiophysRes Commun,2010,400(1):89-93.
[22]Nakasa T,Ishikawa M,Shi M,et al.Acceleration of muscle regeneration by local injection of muscle-specific microRNAs in rat skeletal muscle injury model.J Cell Mol Med,2009,14(10):2495-2505.

