Cx43/Cx45异型缝隙连接通道参与实验性蛛网膜下腔出血后脑血管痉挛的实验研究
叶新运, 洪 涛
自发性蛛网膜下腔出血(subarachnoid hemorrhage,SAH)是常见而又严重的脑血管意外之一,脑血管痉挛(CVS)是SAH后的严重并发症。目前临床上针对CVS的预防及治疗虽有一定效果,但仍不能令人满意,所以在CVS的具体病理机制及相应治疗方面仍需深入研究,并成为当今国内外研究的热门课题之一[1]。缝隙连接(Gap junction,GJ)是相邻细胞间离子及小分子物质交换的直接通道,是细胞间信息传递的重要途径,允许离子、分子量小于1.2kDa、直径小于10nm的物质分子及一些第二信使通过,成为化学耦联通道和代谢耦联通道。通常情况下,很多细胞能表达多种Cx并形成至少包括两种不同的Cx的异型缝隙连接通道,为机体提供了一种能很好地调节缝隙连接通讯的方法[2]。我们前期研究结果表明GJ在SAH后CVS中发挥着重要的作用[3,4]。甘珀酸(carbenoxolone,CBX)作为一种公认特异性较强的GJ阻断剂将应用于本实验。本实验通过建立兔二次注血SAH模型,探讨SAH后缝隙连接蛋白Cx43-Cx45组成异型缝隙连接通道的变化,进一步探讨SAH后GJ参与CVS的发病机制。
1 材料与方法
1.1 材料 兔抗Cx43、Cx45多克隆一抗购自于Zymed公司(可用于免疫共沉淀);Preotein Agarose beads购自Santa Cruz公司,兔抗GAPDH一抗购自于Chemicon公司;甘泊酸(CBX)购自于Sigma公司,山羊抗兔二抗购自于Jackson公司;正常兔血清购自博士德公司,戊巴比妥、硝酸纤维素膜购于美国promega公司;照影剂 OMNIPAQUE(350mg/ml)为丹麦生产;DAB显影试剂盒购于北京中衫公司;WIP组织细胞裂解抽提试剂盒购自于北京赛驰生物科技有限公司,其余试剂为国产。新西兰大白兔由南昌大学医学院动物科学研究部提供。
1.2 体内CVS模型的建立 采用兔的二次注血致蛛网膜下腔出血模型[5]。方法如下:24只体重2.5~3.5kg的雄性新西兰大白兔被随机分为3组;分组情况为正常对照组、SAH-7d组及SAH-7d+CBX组,每组n=12只。注血组动物3%戊巴比妥(20mg/kg),耳缘静脉注射麻醉后,常规备皮消毒后,耳中动脉抽取自体血,穿刺枕大池,引出1ml脑脊液后注入0.5ml/kg自体动脉血;次日重复此操作。其中各组中4只用于脑血管造影,4只用于Cx43免疫共沉淀,4只用于Cx45免疫共沉淀。
1.3 脑血管造影及血管直径的测量 3%戊巴比妥(65mg/kg)耳缘静脉注射麻醉动物,保持其自主呼吸及心跳,然后取仰卧位。用软纱布条将其四肢固定于造影床,右侧腹股沟备皮并按无菌术要求消毒。于右侧腹股沟下方切开皮肤及软组织以暴露股动脉,带芯导引鞘管插入股动脉,拔除鞘管芯后立即将5F导管经鞘管插入股动脉,在透视下将导管送至主动脉弓,然后向左后上方转动导管将其送至左侧椎动脉入口。在相同放大率下注入OMNIPAQUE 2ml后行脑血管DSA造影。基底动脉的直径应用计算机影像分析系统(NIH Image version 1.62)进行测量;每个基底动脉图像取3个测量点:两侧椎动脉汇合点上方0.1mm处,基底动脉中点以及基底动脉顶端下方0.1mm处;3点测量的平均值作为基底动脉的直径值。
1.4 免疫共沉淀 在冰上使用洁净的工具用最快的速度切取待测的基底动脉,将组织放入圆底离心管中,浸入液氮以达到“snap freeze”后将组织冰浴,每5mg组织加入300μl WIP裂解液,使用匀浆器将组织匀浆,然后将组织液在4℃缓慢摇动3h,12000r/min 4℃离心20min。将上清吸出到新的预冷的离心管中(保持冰浴),弃沉淀 。取10~500μg细胞裂解物,加入Cx43/Cx45/正常兔血清10μl,4℃缓慢摇动孵育过夜,加入混匀的 100μl protein-Abeads,4℃缓慢摇动 4h,2500r/min(约 1000g)4℃离心5min,小心吸除上清,用裂解液洗涤沉淀3~5次,最后一次洗涤后,去除上清,加入250μl 4×SDS电泳上样缓冲液,95~100℃煮沸5min,离心后取上清,弃沉淀。得到的上清分装,-80℃保存。
1.5 Western Blot检测Cx43-Cx45在体内的相互作用蛋白表达变化 取方法4提取的蛋白,测定蛋白浓度,按每泳道加总蛋白30μg进行SDS-PAGE凝胶电泳,电泳后用湿转法转移至硝酸纤维素膜上,用5%脱脂奶粉封闭后加入1:125稀释的Cx43/Cx45多克隆抗体(Zymed公司)和GAPDH(Chemicon公司),4℃孵育过夜,洗膜后加入辣根过氧化物酶标记二抗孵育2h,用化学发光法在暗室中曝光,曝光后,显影定影,GADPH作为内参对照。蛋白条带结果采用Image J图像分析软件进行分析,以条带中正常对照组目的条带和GADPH条带灰度值之比作为Cx43与Cx45相互作用蛋白的相对含量。观察脑血管痉挛后Cx43与Cx45相互作用的程度。
1.6 统计分析 采用SPSS13.0进行统计学处理,所有计量指标数据以χ±s表示;采用t检验进行统计学处理;P<0.05为差异有显著性,P<0.01为差异有极显著性。
2 结果
2.1 动物体内CVS模型的建立 成功建立兔二次注血蛛网膜下腔出血模型(CVS模型)。正常组7d时二次造影与首次造影血管直径百分比97.2% ±1.5%,SAH组7d时二次造影与首次造影血管直径百分比 64.2% ±6.3%(P <0.01)),SAH组7d+CBX时二次造影与首次造影血管直径百分比92.4% ±3.7%(P >0.05),与正常组比较无明显差异(见图1)。
2.2 Cx43抗体免疫沉淀后检测Cx45的变化
各实验组均有Cx45蛋白表达,其中正常组为47.3% ±1.8%;SAH-7d 组为 82.5% ±5.4%(P <0.01),与正常组比较有显著差异性;Cx45蛋白在SAH-7d+CBX组的表达为52.6% ±4.8%,与正常组比较无差异性。
2.3 Cx45抗体免疫沉淀后检测Cx43的变化
各实验组均有Cx43蛋白表达,其中正常组为36.20% ±3.1%,在 SAH-7d组高表达为74.3% ±4.6%(P<0.01),与正常组比较具有显著差异性;而SAH+7d+CBX组为40.3% ±3.5%,与正常组比较无明显差异。
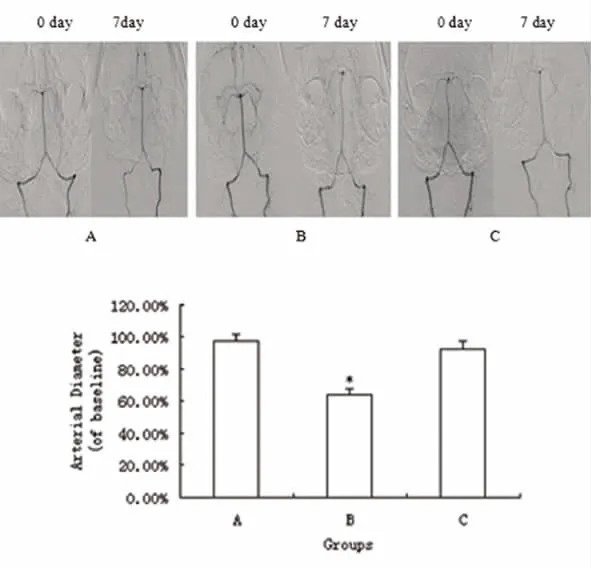
图1 不同实验组行DSA造影,比较基底动脉直径变化

图2 Cx43抗体免疫共沉淀检测SAH前后Cx45的变化
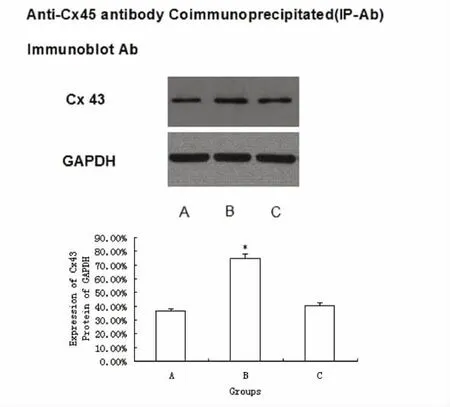
图3 Cx45抗体免疫共沉淀检测SAH前后Cx43的变化
3 讨论
脑血管痉挛(cerebral vaso spasm,CVS)是蛛网膜下腔出血(subarachno id hemo rrhage,SAH)最严重的并发症之一,其发生率高达30% ~90%,常引起严重局部脑组织缺血或迟发性缺血性脑损害,甚至导致脑梗死,成为致死和致残的主要原因。近年来随着研究的不断深入,认为CVS是多因素和多环节所致,已经认识到氧合血红蛋白、炎症反应、缩血管物质增多、离子通道紊乱、血管细胞增殖等在脑血管痉挛发病中起重要作用。
缝隙连接(gap junction,GJ)是细胞间直接进行物质交流的唯一通道,无论在脊椎还是无脊椎动物都发挥着重要的作用。GJ由相邻的两个细胞各提供一个特殊的由蛋白质构成的结构-连接子(connexon)两两对接而形成,连接子可由单一连接蛋白组成称同聚体连接子(homometic connexon),也可有几种连接蛋白构成异聚体连接子(heterometic connexon),由相同连接子组成的缝隙连接称作同型缝隙连接(homotypic gap junction),即12个Cx亚单位均相同;而由异聚体连接子参与组成的缝隙连接称作异型缝隙连接(heterotypic gap junction)。
通过生物化学技术可以将Cx45和Cx43进行免疫共沉淀,进一步表明这些Cx在体内存在非常密切的关系[6]。Jiang等[7]应用免疫共沉淀技术首次通过体内实验发现多种缝隙连接蛋白可组合成异型缝隙连接通道。我们应用免疫共沉淀方法分析了Cx43/Cx45在脑血管痉挛模型中的体内相互作用程度。本研究发现不仅抗Cx43抗体能将Cx45蛋白沉淀下来(见图2),而且抗Cx45抗体同样能将Cx43蛋白沉淀下来(见图3),而使用免疫前血清的泳道则没有检测到任何条带,这些结果表明 Cx43与Cx45在体内发生了相互作用。所以我们推测Cx43与Cx45在体内的相互作用促进了异型缝隙连接通道的形成,而我们实验发现在SAH-7d组较正常组Cx43与Cx45的相互作用程度有显著差异性,即Cx43与Cx45的相互作用蛋白在SAH-7d组较正常组显著增高(P<0.01),而当应用CBX时,SAH-7d组与正常组Cx43与Cx45的相互作用表达程度无显著差异性,我们推测在单纯SAH-7d组Cx43与Cx45形成的异型缝隙连接通道明显多于正常组及CBX+SAH-7d组,即缝隙连接阻断剂CBX能抑制这些蛋白表达的变化。本实验还发现Cx43与Cx45形成的异型缝隙连接通道的多少与CVS程度相一致,并且缝隙连接阻断剂CBX能缓解SAH后的CVS及抑制Cx43与Cx45的高表达。我们推测CBX可能是通过抑制Cx43与Cx45等蛋白的合成、组装、转运,最终影响它们之间的相互作用而减少异型缝隙连接通道的形成从而起到缓解CVS的作用。
在病理状态下出现的GJ蛋白表达数量的改变、表达类型的改变、分布的改变及结构异常称为重构(remodeling)[8]。GJ蛋白重构现象已得到广泛证实,在功能上可影响GJ的启闭、传导性和通透性,使细胞间的电、化学、代谢通道发生异常改变,引起传导信息的“选择性过滤”等,成为多种疾病发生的分子病理基础。而异型缝隙连接通道的这些在数量及类型上的变化正是属于缝隙连接重构的范畴。Hayrapetyan等[9]研究发现在Cx43/Cx45或 Cx40/Cx45组成的异型通道中,它们的跨膜电压(Vm)依赖性分别减少30%和50%。最近一篇报道显示Cx45/Cx43-Cx43异型通道更进一步降低了Cx43连接子的电压门控作用,表明这些异型Cx45/Cx43连接子具有更低的电导率并且诱导其相对连接子Cx43较小的电压降[10]。有研究表明异型通道的连接子电压门控特性发生了改变,因为由Cx45-Cx43组成的异型通道,这些异型连接子对接后抑制了Cx43的门控作用[11];钟国强等[12]在体外利用 Cx43 和 Cx45共同培养成单侧异型GJ通道,其偶联率取决于分子探针注射的方向,产生单向传导阻滞和慢传导的现象,可能与心律失常再折返的解剖学基础相关。因此,我们认为Cx43与Cx45形成的异型缝隙连接通道的多少与细胞间的信息交流密切相关,特别是在细胞间跨电压、化学门控机制及一些离子、小分子的通透性与选择性上存在差异。
在心血管系统中,血管内皮细胞可以同时表达Cx37、Cx40和Cx43,其中Cx37表达量最高。完整的内皮细胞是维持血管正常生理功能所必需的,而Cx43是维持内皮连续性及完整性所必需的,在大动脉和血流稳态被扰乱的区域Cx43的表达较高。血管平滑肌细胞可以协同表达 Cx43、Cx40、Cx45和Cx37,其中Cx43表达量最高,其他3种连接蛋白的表达量依次递减。不同类型的连接蛋白可以形成不同类型的连接子,不同类型的连接子可以形成不同类型的缝隙连接通道,而不同类型的缝隙连接在导率、通透性及门控通道等特性方面均有很大的差别,这样就构成了缝隙连接在结构组成和功能方面的多样性。
综上所述,我们推测在SAH模型中,Cx43和Cx45形成的异型缝隙连接改变了血管壁细胞间的信息传输,导致收缩因子的增加或舒张因子的减弱,最终参与CVS的形成。
[1]Bederson JB,Connolly ES Jr,Batjer HH,et al.Guidelines for the Management of Aneurysmal Subarachnoid Hemorrhage:A Statement for Healthcare Professionals From a Special Writing Group of the Stroke Council,American Heart Association[J].Stroke,2009;40:994-1025.
[2]Koval M.Pathways and control of connexin oligomerization[J].Trends Cell Biol,2006,16:159-166.
[3]Hong T,Wang Y.Inhibitory effect of gap junction blockers on cerebral vasospasm[J].J Neurosurg,2008,108(3):551-557.
[4]Hong T,Wang HT.Effects of gap junctional blockers on cerebral vasospasm after subarachnoid hemorrhage in rabbits[J].Neurolog Res,2009,31(3):238-244.
[5]Zuccarello M,Boccaletti R,Romano A,et al.Endothelin B receptor antagonists attenuate subarachnoid hemorrhage-induced cerebral vasospasm[J].Stroke,1998,29(9):1924-1929.
[6]Martinez AD,Hayrapetyan V,Moreno AP,et al.Connexin43 and connexin45 form heteromeric gap junction channels in which individual components determine permeability and regulation[J].Circ Res,2002,90:1100-1107.
[7]Jiang JX,Goodenough DA.Heteromeric connexons in lens gap junction channels[J].Proc Natl Acad Sci USA,1996,93(3):1287-1291.
[8]Robert S,Severs NJ,Gourdie RG.Altered patterns of cardiac intercellular junction distribution in hypertrophic cardiomyopathy[J].Heart,1996,76(5):412-417.
[9]Hayrapetyan V,Moreno AP.Gating of heterotypic connexin40 and connexin45 gap junction channels[J].Biophys J,2003,84:526.
[10]Zhong G,Hayrapetyan V,Moreno AP.The formation of mono-heteromeric Cx43–Cx45/Cx45 gap junction channels uncovers gating and selectivity properties of their channels[J].Biophys J,2003,82:633.
[11]Elenes S,Martinez AD,Delmar M,et al.Heterotypic docking of Cx43 and Cx45 connexons blocks fast voltage gating of Cx43[J].Biophys J,2001,81:1406-1418.
[12]钟国强,黄从新,刘唐威,等.异型缝隙连接通道和磷酸化对心脏缝隙连接的调变[J].中华心律失常学杂志,2003,7:229.

