大鼠静脉窦血栓形成后VEGF和VEGF mRNA的表达及意义
闫文浩, 吴 军
颅内静脉窦血栓形成(cerebral venous sinus thrombosis,CVST)是一种特殊类型的脑静脉系统血管疾病,成人发病率为3~4/100万,占所有卒中的0.5% ~1%[1],约 15% 的患者最终死亡或致残[2]。与脑动脉血栓相比,脑静脉系统血栓的研究比较少,近些年来随着临床医生对该病的重视及神经影像学的发展,使本病确诊率不断提高,颅内静脉系统血管病逐渐引起关注。血管内皮生长因子(vascular endothelial growth factor,VEGF)是一种特异性作用于血管内皮细胞的分泌性细胞因子,具有促进内皮细胞增殖和血管生成、增加血管通透性等多种功能,VEGF在脑动脉缺血中的相关研究国内外已有较多报道,但对于脑静脉缺血的报道较少,本研究采用大鼠颅内静脉窦血栓形成模型,观察颅内静脉窦血栓形成后VEGF及VEGF mRNA表达的变化过程,并探讨其可能意义。
1 材料与方法
1.1 动物分组 健康雄性 Sprague-Dawley(SD)大鼠60只(清洁级),体重 220~280g,由广东省实验动物中心提供,合格证号:SCXX(粤)2008-0002。实验动物随机分为2组:(1)CVST实验组(n=30):根据模型制作后不同时间又分为1d、3d、7d等3个亚组(每亚组10只);(2)假手术对照组(n=30),分为1d、3d、7d等 3 个亚组(每亚组10 只)。
1.2 动物模型 参考文献[3,4]方法并稍作改进,将大鼠用10%水合氯醛(340~360mg/kg)经腹腔注射麻醉,头部剃毛并固定于脑立体定位仪上,直肠内插入温度传感器,体温维持仪维持体温在37.0℃ ±0.5℃。消毒皮肤,以枕骨粗隆为起点,向额部做长度为1.5cm正中线皮肤切口,用棉签擦除骨膜,显露正中顶骨和枕骨鳞部,于Lambda、Bregma前端(即上矢状窦前后两端)以矢状缝为轴,分别设计骨窗3mm×3mm,手术显微镜下生理盐水持续冷却,高速颅钻磨除骨板,暴露硬脑膜及上矢状窦前后两端。CVST实验组用9-0显微缝合线结扎上矢状窦前后两端,尽量减少对脑组织的损伤,10min后微量注射泵以10μl/min的速度在上矢状窦(Superior Sagittal Sinus,SSS)近尾部结扎处向SSS腔内注射约100μl脑磷脂白陶土悬浮液(APTT试剂盒,4℃保存,购于广州倍新生物科技公司)。确定无出血后消毒,严密缝合头皮,腹腔注射青霉素15万u预防感染。回笼饲养,温度控制在24℃。24h内磁共振静脉血管成像(Magnetic resonance venography,MRV)未见上矢状窦显影证实模型成功(见图1),定为CVST实验组;假手术对照组开颅暴露硬脑膜及上矢状窦前后两端后用针线穿过上矢状窦下方,但不结扎上矢状窦及注入脑磷脂白陶土,余试验过程同模型组。
1.3 标本采集 术后1d、3d、7d分别将 CVST实验组和假手术对照组中的5只以10%水合氯醛腹腔注射麻醉,先用37℃ 0.9%生理盐水经左心室灌流,后迅速以4%多聚甲醛经左心室灌流固定,迅速断头取脑后固定,石蜡包埋,石蜡切片机上行5μm冠状位连续切片并编号备用;CVST实验组和假手术对照组每亚组中其余5只在相同时间点以10%水合氯醛腹腔注射麻醉,迅速断头取脑,立即取上矢状窦旁脑组织约100mg在1‰DEPC水中稍作漂洗,立即放入高温灭菌后EP管,液氮中保存备用提取RNA;另切取上矢状窦中1/3窦旁脑皮层组织约100mg,用于脑组织含水量的测定。
1.4 脑组织含水量测定 干湿法测定脑组织含水量,取上矢状窦中1/3窦旁脑皮层组织约100mg脑组织,迅速用滤纸吸除残水,称重后置于110℃恒温烤箱,烘干48h至恒重,称取干重。脑含水量=(湿重-干重)/湿重×100%。
1.5 VEGF免疫组化染色
1.5.1 试剂 VEGF兔源性单克隆抗体,二抗IGg(羊抗兔)试剂盒,DAB显色试剂盒,均购于北京中杉金桥生物技术有限公司公司,其余试剂由北京大学香港科技大学医学中心提供。
1.5.2 免疫组化实验步骤 实验按免疫组织化学二步法常规染色步骤进行:脱蜡,水化组织切片。3%过氧化氢孵育4min,以阻断内源性过氧化物酶。PBS洗1次3min。滴加适当稀释的一抗VEGF单克隆抗体(1:100),4℃孵育24h。弃一抗,用PBS冲洗3次。滴加二抗IGg(1:200),置室温下孵育 20min。PBS冲洗3次。二氨基联苯胺(DAB)显色,室温下光镜观察显色满意后自来水冲洗5min终止显色。常规复染,脱水,封片。用 PBS液替代一抗进行阴性对照染色。VEGF阳性细胞为胞浆呈黄色至棕黄色。图像分析在LEICADM4000B显微镜下进行,每张切片于低倍镜下从上矢状窦周围选取5个视野,然后在高倍镜下计数阳性细胞数。
1.6 RT-PCR法检测VEGF mRNA含量
1.6.1 主要试剂和仪器 Trizol(购自美国Invertrogen公司;逆转录试剂盒(PrimeScript RT reagent Kit Perfect RealTime)、荧光定量 PCR试剂盒(SYBR Premix ExTaqTM)购自 TaKaRa公司;VEGF及GAPDH引物序列设计参照文献[5]进行并由南京金斯瑞生物科技有限公司合成。Light Cycler realtime PCR扩增仪(Roche Diagnostics)由北京大学香港科技大学医学中心实验室提供。
1.6.2 RT-PCR检测VEGF mRNA的表达 大鼠各期脑组织按trizol裂解液说明书中操作步骤提取RNA;总的RNA浓度通过紫外分光光度法测定其260nm和280nm吸光度比值在1.8~2.2,以提取的RNA为模板,按照逆转录试剂盒说明操作获得cDNA,反转录反应条件:37℃,15min,85℃,5s 。进行实时(Real Time)PCR反应:按qRT-PCR试剂盒说明书在LightCycler Real Time PCR扩增仪上进行检测。反应条件:预变性 95℃,30s,变性 95℃,5s,退火延伸60℃,20s;共40次循环;同时设计RT质控和PCR扩增2个空白对照。融解曲线分析:65℃15 s,20℃/s。反应结束后确认Real Time PCR扩增曲线和融解曲线以及分析扩增基因表达情况。VEGF引物序列:上游 5-TGCTGGGGCTGGCATTGCTC-3,下游 5-TCCTTGCTGGGCTGGGTGGT-3’;内参照 GAPDH引物序列:上游5-ACCAGCGCAGCTATTGCCGT-3下游5-GACGTGGGCACGCACTCCAG-3’。各个样本目的基因和内参基因(GAPDH)循环阈值的差值为ΔCt,任选其中一个样本为对照样本,各样本和对照样本的Ct差值记作ΔCt目的基因相对表达量记作 2-ΔΔCt。
1.7 统计学处理 计量资料均以(χ±s)表示,采用SPSS13.0统计学软件对数据进行处理,两组间参数比较采用t检验。P<0.05表示差异有统计学意义。
2 结果
2.1 脑组织含水量 假手术对照组各组比较无显著性差异;与假手术对照组比较,CVST 1d、3d组脑组织含水量明显增加有显著性差异(P<0.05),CVST 7d组脑组织含水量与对照组比较无显著性差异(p>0.05)(见表1)。提示CVST后1d即存在明显脑水肿,CVST 3d脑水肿明显减轻,CVST 7d脑水肿消失。
2.2 VEGF蛋白的表达 免疫组化检测结果显示,假手术对照组脑组织仅少量VEGF阳性细胞(见图2A),CVST组各时间点上矢状窦周围脑组织里均发现大量VEGF免疫染色阳性细胞(见图2B),在CVST后1d、3d、7d有逐渐增强的趋势,数量均明显高于对照组(P<0.05)(见表2),并且在上矢状窦周围可见 VEGF免疫阳性着色的血管(见图2C)。
2.3 VEGF mRNA在脑组织中的表达 RTPCR结果显示,假手术对照组仅有少量VEGF mRNA表达。CVST后1d VEGF mRNA转录水平显著升高,之后VEGF mRNA转录逐渐增强,CVST后7d达高峰。CVST各组VEGF mRNA转录水平与对照组比较均有显著性差异(P<0.05)。CVST后VEGF mRNA转录水平是一个逐渐增强的过程。见图3。

表1 各组脑组织含水量(χ±s)

表2 各组大鼠不同时间点VEGF阳性细胞计数比较(χ±s个/视野)

图1 a:假手术对照组大鼠MRV,上矢状窦清晰可见(箭头所示);b:CVST组大鼠上矢状窦血栓形成模型建立后24h内MRV显示上矢状窦血流信号消失(箭头所示),上矢状窦闭塞
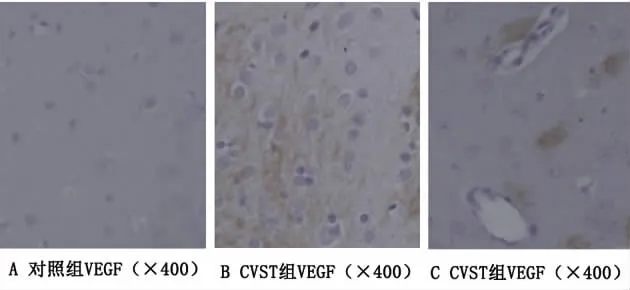
图2 大鼠脑组织VEGF免疫组化图片,可见 VEGF免疫阳性着色的血管

图3 VEGF mRNA动态变化
3 讨论
VEGF在病理条件下如脑缺血时无论在mRNA水平还是在蛋白水平均有过量表达,具有促进血管内皮细胞分裂与增殖、增加微静脉及小静脉的通透性、诱导血管生成等功能。有研究发现,VEGF表达与组织中微血管密度及新生血管的密度密切相关,VEGF参与了局部微血管形成和血液洪应的改善[6]。本实验结果显示,CVST后1d即存在VEGF蛋白及 VEGF mRNA的显著高表达,CVST后3d、7d,其表达逐渐增强。考虑可能是由于静脉血栓形成使静脉压增高,降低了毛细血管灌注压,最终减少了脑血容量,脑灌注压和脑血流量下降,导致颅内压增高、缺血、缺氧等病理改变,VEGF在低血氧和血管内压升高等刺激下高表达[7,8]。
国外有学者[9]通过对光化学诱导法建立大鼠静脉缺血模型,24h后在血管源性水肿区域观察到了VEGF的表达,并认为大鼠静脉血栓形成急性期VEGF的增高主要与血管源性脑水肿有关。国内研究者[10]通过影像学和病理学方法分析表观弥散系数值与血管内皮生长因子的关系,结果发现血管内皮生长因子表达与血管源性水肿相关,在表观弥散系数图上表现为高信号。本实验结果显示,CVST后1d、3d,脑组织含水量增高,CVST 1d脑组织含水量最高,CVST 3d时有所下降,7d时恢复正常,CVST 1d后脑水肿是一个逐步减轻的过程。同时,CVST 1d、3d,VEGF无论在蛋白水平还是mRNA水平均有显著高表达,提示急性期VEGF表达可能和脑水肿有关。可能是由于脑缺血缺氧时,VEGF增加血管通透性,通透性的增加可破坏内皮细胞间紧密连接结构,导致病变组织微血管结构破坏而血浆外渗,加重脑水肿的形成。但研究结果表明,CVST 1d脑组织含水量逐渐减少,脑水肿逐步减轻,但VEGF在蛋白水平和mRNA水平不但没有降低,反而显著增强,持续到CVST后7d仍有较高表达,提示CVST后期VEGF的高表达,可能与脑水肿关系不大。而VEGF不仅具有增加血管通透性作用,还有促进内皮细胞增殖作用,提示可能与促进血管新生有关。
CVST患者症状恢复的基本机制主要包括急性发作后静脉窦再通和侧支循环形成等,过去主要倾向于再通,临床也常常在早期观察到再通[11],但进一步的研究发现静脉窦再通或是持续的闭塞对于临床功能预后似乎影响不大[12],所以,CVST后侧支循环的形成就显得尤为重要[13]。血管内皮生长因子,是迄今为止已知的作用最强的促血管生长因子,其促血管生成作用已经被多个实验所证实[14]。本实验也显示,CVST后VEGF无论在蛋白水平还是mRNA水平都持续高表达,并且观察到上矢状窦闭塞脑组织周围可见VEGF免疫阳性着色的血管,国外Erwin Stolz等[5]研究观察亚急性静脉窦血栓形成大鼠CVST后新生血管等侧支循环的变化,发现CVST后6w皮质静脉的体积分数和数量显著增加,微血管网络连接到皮层静脉,伴随VEGF的强烈表达,均提示 VEGF在 CVST后可能与血管新生有关。VEGF与其受体结合,选择性地作用于血管内皮细胞刺激其增殖,并促使内皮细胞迁移及细胞间的相互作用和管腔的形成,增加缺血组织的血管新生,从而形成新的侧支循环或者有利于潜在侧支通路的开放或加强,而新生血管的形成直接关系到缺血区域血液循环改善,从而具有保护神经元、促进神经干细胞增殖的作用,在一定程度上可减少神经功能的缺损[15],从而为症状恢复提供有利条件。
我们的实验结果表明,VEGF在CVST急性期表达可能与脑水肿有关,但其长期表达可能与促进血管生成、侧支循环形成有关。进一步的研究需要探讨影响VEGF表达的因素及其调控机制,以及CVST后新生血管等侧支循环的形成过程,并进一步明确其与VEGF的相关性,对于明确其在静脉窦血栓治疗中的作用以及寻找特异性和靶向性的治疗药物具有重要意义。
[1]Bousser MG,Ferro JM.Cerebral venous thrombosis:an update[J].Lancet Neurol,2007,6(2):162-170.
[2]Ferro JM,Bacelar-Nicolau H,Rodrigues T,et al.Risk Score to Predict the Outcome of Patients with Cerebral Vein and Dural Sinus Thrombosis[J].Cerebrovasc Dis,2009,28(1):39-44.
[3]Ungersbock K,Heimann A,Kempski O.Cerebral blood flow alterations in a rat model of cerebral sinus thrombosis[J].Stroke,1993,24:569-570.
[4]Frerichs KU,Deckert M,Kempski O,et al.Cerebral sinus and venous thrombosis in rats induces long-term deficits in brain function and morphology-evidence for a cytotoxic genesis[J].Cereb Blood Flow Metab,1994,14:289-300.
[5]Stolz E,Yeniguen M,Kreisel M,et al.Angioarchitectural changes in subacute cerebral venous thrombosis:A synchrotron-based micro-and nano-CT study[J].Neuroimage,2011,54(3):1881-1886.
[6]Risau W.Mechanisms of angiogenesis[J].Natur,1997,386(6626):671-674.
[7]Wiesener MS,Turley H,Allen WE,et al.Induction of Endothelial PASDomain Protein-1 by Hypoxia:Characterization and Comparison With Hypoxia-Inducible Factor-1α[J].Blood,1998,92:2260-2268.
[8]Miano JM,Vlasic N,Tota RR,et al.Smooth muscle cell immediateearly gene and growth factor activation follows vascular injury:a putative in vivo mechanism for autocrine growth[J].Arterioscler Thromb,1993,13(2):211-219.
[9]Kimura R,Nakase H,Sakaki T,et al.Vasogenic edema and VEGF expression in a rat two-vein occlusion model[J].Acta Neurochir Suppl,2003,86:213-217.
[10]刘文源,许乙凯.血管内皮生长因子在大鼠静脉窦血栓模型水肿脑组织中的表达与影像学评估指标的关系[J].中国临床康复,2006,10(9):136-137.
[11]Dentali F,Gianni M,Crowther MA,et al.Natural history of cerebral vein thrombosis:a systematic review[J].Blood,2006,108:1129-1134.
[12]Putaala J,Hiltunen S,Salonen O,et al.Recanalization and its correlation to outcome after cerebral venous thrombosis[J].J Neurol Sci,2010,292:11-15.
[13]闫文浩,吴 军.颅内静脉窦血栓形成后静脉侧支循环状况的研究进展[J].中国脑血管病杂,2011,8(11):613-616.
[14]Lebherz C,von Degenfeld G,Karl A,et al.Therapeutic angiogenesis arteriogenesis in the chronic ischemic rabbit hindlimb:effect of venous basic fibroblast growth factor retroinfusion[J].Endothelium,2003,10(4-5):257-265.
[15]Jin K,Zhu Y,Sun Y,et al.Vascular endothelial growth factor stimulate neurogenesis in vitro and in vivo[J].Proc Nat Acad Sci USA,2002,99:119-146.

