138例糖尿病患者神经电图分析
杨 昉, 孔 丽, 戴加飞, 李 敏, 郭锐兵, 林 颖, 陈光辉, 刘 玲
据报道2000年全球已有1.5亿糖尿病患者[1],糖尿病周围神经病变(diabetic peripheral neuropathy,DPN)是糖尿病最常见的慢性并发症,是糖尿病的代谢障碍导致的周围神经病变,发病率高达40%~91%[2],大多数报道在60%左右,属于亚急性感觉运动麻痹综合征Ⅱ类[3]。DPN可与糖尿病同时发生,亦可为糖尿病的首发症状或是在糖尿病控制良好后出现,还可能是糖尿病前或糖耐量异常周围神经病和胰岛素介导的周围神经病[4]。肌电图检测神经传导速度(nerve conduction velocity,NCV)是DPN受损的直接证据,对DPN的早期诊断具有重要意义。然而,糖尿病神经病变发病机制尚未完全阐明,也无有效的治疗方法,了解糖尿病周围神经病变的神经损伤的特点及其发病相关因素对其防治有着积极的作用。
1 资料与方法
1.1 一般资料 2010年7月~2011年5月我院住院及门诊血糖控制良好的2型糖尿病患者138例,诊断符合1999年经WHO咨询委员会认可的2型糖尿病诊断标准,对于合并有其他原因可能导致周围神经病变的患者未纳入分析。138例患者中有周围神经病症状的45(32.61%)例,无症状者93(67.39%)例,男81例,女57例。发病年龄28~84岁,糖尿病病程20d~30y,病程<10年83例,≥10年55例。
1.2 方法 采用丹麦维迪公司Keypoint型肌电/诱发电位仪测定,室温保持20~28℃,患者皮温28~30℃之间。138例患者均行神经电图检测,选择所检神经包括:正中神经、尺神经、腓肠神经、胫神经和腓总神经,测定其感觉神经传导速度、潜伏期以及电位波幅;运动神经传导速度、潜伏期以及电位波幅。均采用超强刺激,记录和刺激电极均以表面电极记录。正中、尺神经感觉神经传导速度(SCV)测定刺激点分别为食指、小指,正中、尺、胫和腓总神经MCV测定记录点分别为拇短展肌(肘-腕)、小指展肌(肘-腕)、趾短伸肌(腘-踝)及拇短展肌(腘-踝)。腓肠神经感觉刺激点在跟骨上15cm处,外踝处粘贴表面电极逆向感觉技术记录。NCV判定标准运动传导速度和感觉传导速度比较,小于-2.5s为异常,未引出运动或感觉电位,及波幅下降大于50%为异常。
1.3 统计学分析 结果运用SPSS软件进行统计学分析,数据采用χ±s表示,两样本均数的比较用t检验(方差不齐使用t检验),两组患者NCV和潜伏期与波幅的关系用直线相关分析,以P<0.05为有显著性意义。
2 结果
2.1 不同病程的2型糖尿病患者一般情况比较 见表1。
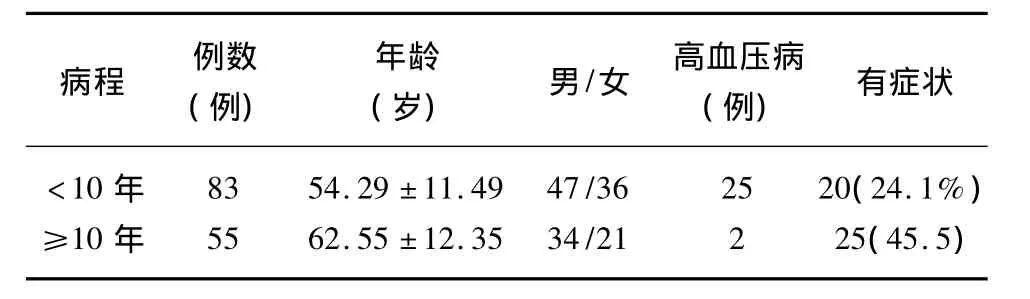
表1 两组基本情况比较(χ±s)
2.2 神经电图的异常变化及与病程的关系 所有患者中感觉神经异常神经数上肢(67/383)与下肢(55/239)无统计学差异(P=0.1690);而上肢运动神经异常率(59/517,11.4%)明显低于下肢(132/530,24.9%)(P <0.0001);感觉神经受累情况(122/622,19.6%)与运动神经(191/1047,18.2%)相似(P=0.5665);见表2。患糖尿病10年以上患者运动、感觉神经异常率(102/420,24.3%,61/185,33%)明显高于病程小于 10 年组(89/627,14.2%,61/437,14%)(P<0.001),见表2;病程大于10年组神经传导速度均较病程小于10年组减慢,正中神经、胫后神经运动传导速度和尺神经、腓肠神经感觉传导速度有统计学意义(P<0.05);同时除尺神经外所查运动神经近远端复合肌肉动作电位波幅(CAMP)病程≥10年组均明显低于病程<10年组;见表3、表4。
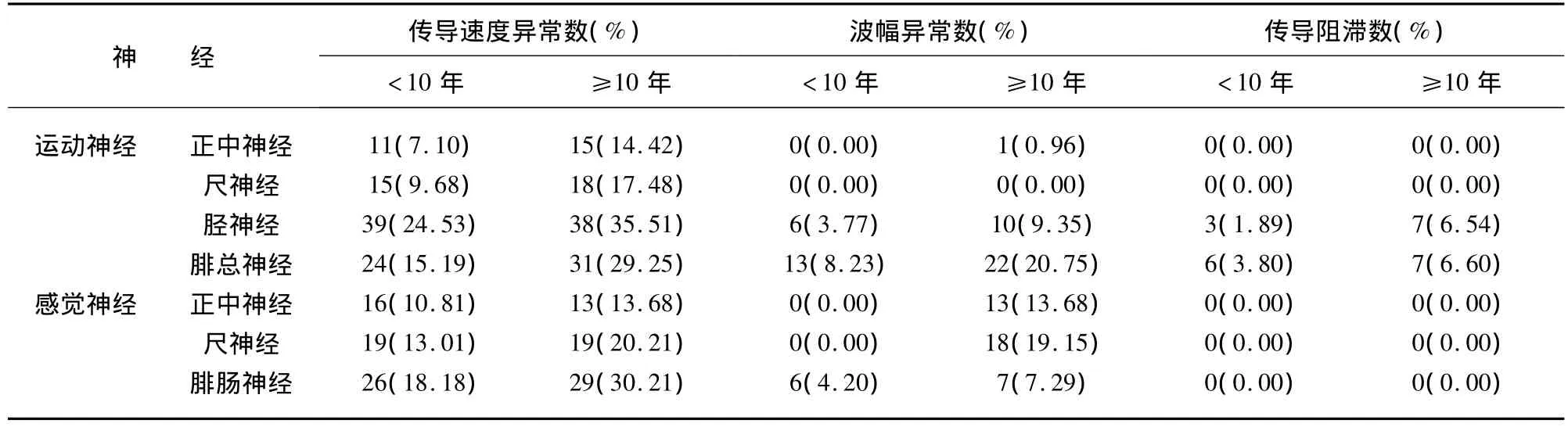
表2 神经传导异常的发生率
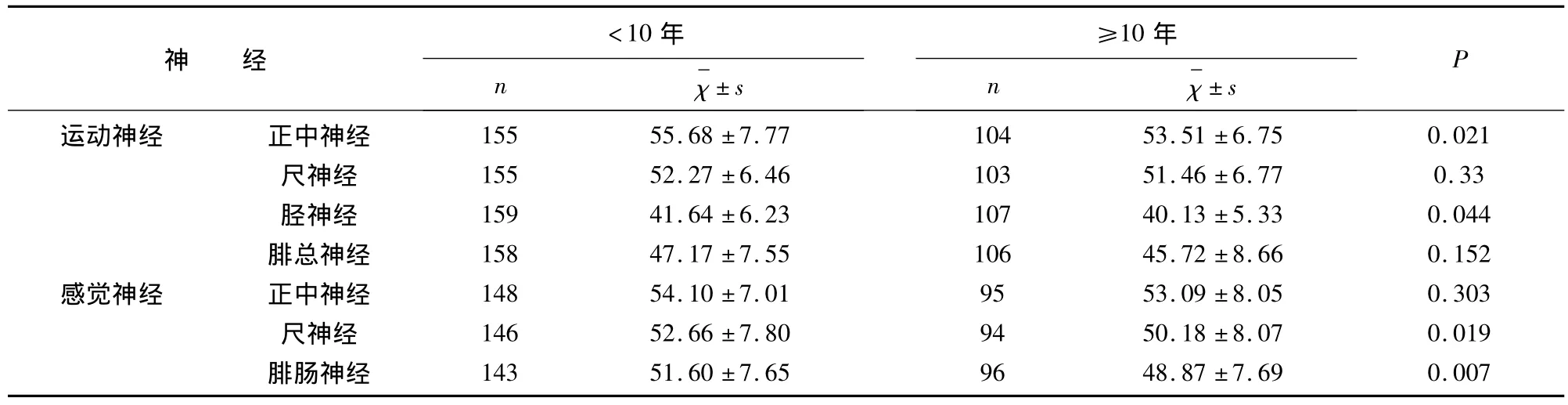
表3 神经传导速度(m/s)的比较
3 讨论
糖尿病周围神经病是糖尿病最常见的并发症之一,对周围神经的损害的判断,以往多靠病史及体格检查如跟腱反射及四肢深感觉的减低或消失,但因其受主观因素影响较大,且确立诊断时神经的病变多已较严重。NCV评价的是传导最快的大直径的有髓Aα和Αβ的纤维的功能,常作为“金标准”评价其他方法,也是现阶段DPN诊断的金标准,及早对无神经系统临床症状的糖尿病患者进行NCV检查,可早期发现DPN,以指导早期治疗。糖尿病周围神经病变类型,很难用某一种机制来解释所有的病变,微血管病变导致微循环障碍,引起神经内膜缺氧、神经纤维受损、多元醇通路代谢障碍、糖基化终末产物(AGE)形成,肌醇代谢异常、脂质代谢障碍、自由基损伤、神经营养因素缺乏等都与之有关[5]。DPN发病隐匿,病理表现为神经纤维的萎缩、多节段的脱髓鞘及神经内微循环的改变,早期即有神经内膜毛细血管异常,朗飞结节的肿胀和水肿,使神经受压、中毒或细胞死亡,引起轴索退行性变而出现NCV的减慢,还可有肌肉动作电位波幅的下降。本研究中,所有患者均血糖控制良好,周围神经传导速度异常率仍高达(17.69%),病程越长异常率越明显(14.10%比23.12%),因此仅控制好血糖并不能完全避免糖尿病周围神经病的发生;同时本组患者中有症状患者45 例(32.61%),无症状患者93 例(67.39%),而单一神经传导速度异常率最大者大于有症状患者比例,可见无麻木无力等周围神经病症状者也可出现周围神经的损害。
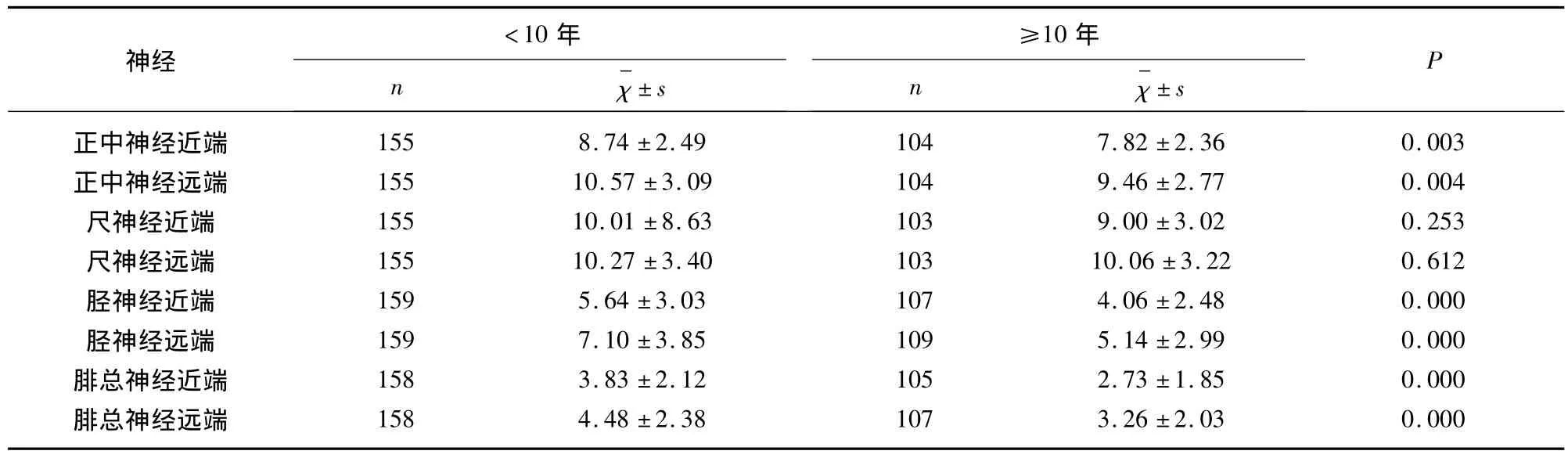
表4 两组CMAP波幅比较
DPN最常用的检测是神经传导速度(NCV)和动作电位的波幅,由于糖尿病患者整条神经纤维的全长均可出现弥漫性的传导异常,故传导距离越长异常可能表现越明显,因此往往较长的神经纤维如胫神经和腓肠神经的传导速度减慢的程度一般比正中神经、尺神经的更明显。下肢的异常率大于上肢,还可能是微血管病变造成循环障碍,神经失养,氧化自由基损害时,上肢的局部血液循环较下肢通畅,氧化自由基的损害相对于下肢小。以往的研究提示糖尿病周围神经病神经电图检查异常主要表现为程度一致的神经传导速度减慢和波幅降低,一般感觉较运动先受累,可能是传导最快的有髓大纤维先受累,因此感觉神经传导速度(SCV)异常率明显高于运动神经传导速度(MCV)[4,6,7]。我们的结果显示本组糖尿病患者上、下肢感觉神经受累情况相似,而在运动神经中下肢受累明显多于上肢,可能是我们在进行感觉检测时上下肢检测距离相似,而下肢运动神经的检测距离明显长于上肢,从而放大了运动神经的异常。同时本组患者中感觉神经受累比例与运动神经相似,但在病程大于10年的患者中感觉神经异常率高于运动神经,说明随病程延长,感觉神经受累较运动更明显,这与国内部分报道有所不同[8]。
本研究表明患糖尿病10年以上者运动、感觉神经异常率明显高于病程小于10年组,其神经传导速度均较病程小于10年组减慢,同时除尺神经外所查运动神经近远端复合肌肉动作电位波幅(CAMP)病程≥10年组均明显低于病程<10年组;可见病程是的糖尿病周围神经损害的危险因素,随着病程增加神经传导异常率和损伤严重程度增高[9]。
DPN已经成为目前尚无法治愈的一种高发病,早期病变呈相对可逆[5]。临床上诊断DPN主要依靠神经传导速度(NCV)检查,其较为客观、敏感、可靠,并且可以发现很多亚临床型周围神经病。糖尿病患者可常规进行NCV检测,以早期发现,早期治疗,减少并发症的发生,减轻患者的痛苦,提高患者生活质量。
[1]Wild S,Roglic G,Green A,et al.Global prevalence of diabetes:estimates for the year 2000 and projections for 2030[J].Diabetes care,2004,27:1047-1053.
[2]崔丽英.重视糖尿病周围神经病的诊治[J].中华老年医学杂志,2005,24(7):551.
[3]王维治,郭玉璞.神经病学[M].北京:人民卫生出版社,2006.394-396.
[4]Summer CJ,Sheth S,Griffin JW,et al.The spectrum of neuropathy in diabetic and impaired glucose tolerance[J].Neurology,2003,60:108-111.
[5]Vinik AI,Park TS,Stansberry KB,et al.Diabetic neuropathies[J].Diabetologia,2000,43:957-973.
[6]Zochodne DW.Diabetes mellitus and the peripheral nervous system:manifestations and mechanisms[J].Muscle Nerve,2007,36:144-166.
[7]Kles KA,Bril V.Diagnostic tools for diabetic sensorimotor polyneuropathy[J].Curr Diabetes Rev,2006,2:253-261.
[8]刘明生,胡蓓蕾,崔丽英,等.糖尿病周围神经病700例临床与神经电生理分析[J].中华内科杂志,2005,44(3):173-176.
[9]宋庆芳,宋光耀.2型糖尿病周围神经病变危险因素分析[J].中国老年学杂志,2009,29(1):222-224.

