皱纹盘鲍内脏β-1,3-葡聚糖酶的提取及其酶学性质研究
宫国君,朱蓓薇,杨静峰,米云龙
(大连工业大学食品学院,辽宁大连116034)
皱纹盘鲍内脏β-1,3-葡聚糖酶的提取及其酶学性质研究
宫国君,朱蓓薇,杨静峰*,米云龙
(大连工业大学食品学院,辽宁大连116034)
从鲍鱼内脏提取β-1,3-葡聚糖酶粗酶并研究其酶学性质。以昆布多糖为底物监控酶的活性。鲍鱼内脏经匀浆后,采用3倍体积0.1mol/L的磷酸氢二钠-柠檬酸缓冲液(pH6.0)浸提12h。浸提液经离心后收集上清液,并采用60%饱和度的硫酸铵对上清液中的蛋白进行盐析沉淀得β-1,3-葡聚糖酶粗酶。研究表明,粗酶中β-1,3-葡聚糖酶的最适反应温度为40℃,酶活力在40℃以下稳定;酶的最适pH为6.0,酶活力在pH4.0~7.0范围内稳定。Mn2+能明显激活酶活力,而Cu2+、Fe3+、Hg+对酶活力有抑制作用,其中Fe3+的抑制作用最强;亮肽酶素和1,10-菲啰啉对酶活力有明显的抑制作用,而E-64对酶活力有一定的激活作用;此酶对海藻酸钠也有一定水解能力。
鲍鱼,β-1,3-葡聚糖酶,酶学性质
β-1,3-葡聚糖酶(EC3.2.1.39)是一类能够特异性水解β-1,3糖苷键的水解酶。可用于饲料及啤酒工业[1-2]、增加多糖溶解性[3]、制备酵母原生质体[4]、植物病害防治等方面[5]。该酶广泛存在于微生物,如真菌[6]、细菌[7]、放线菌[8]等,植物如小麦[9]、青稞[10]、天麻[11]等和动物中。海洋中β-1,3-葡聚糖酶主要分布于海洋无脊椎动物。赵军岗等已从海参肠道中提取分离出此酶[12],BACHMAN E S等对海参(Strongylocentrotus purpuratus)卵中的β-1,3-葡聚糖酶分子量等性质进行了研究[13]。另外Svetlana N等从扇贝(Mizuhopecten yessoensi)分离纯化出β-1,3-葡聚糖酶并研究了该酶基因的克隆与表达[14]。同样是海洋动物的鲍鱼是一种海洋单壳软体贝类,具有很高的经济价值和营养药用价值[15]。已有报道从鲍鱼体内提取分离褐藻胶裂解酶、淀粉酶及纤维素酶等消化酶[16-18],而从鲍鱼的体内提取消化酶中的另一重要组成的β-1,3-葡聚糖酶,国内尚未见报道。本文以鲍鱼内脏为材料提取了鲍鱼内脏β-1,3-葡聚糖酶,并对其粗酶的酶学性质进行了研究和探讨,对于了解鲍鱼生理消化特性具有十分重要的意义,并为该酶的应用提供理论依据。
1 材料与方法
1.1 材料与仪器
鲍鱼内脏 由大连獐子岛渔业集团提供;昆布多糖Laminarin、牛血清蛋白BSA、直链淀粉Amylose、支链淀粉Amylopectin Sigma公司;其他化学试剂 均为国产分析纯试剂。
UV2100型紫外可见分光光度计 上海尤尼柯仪器有限公司;Z323K冷冻离心机 德国Hermle labortechnik。
1.2 实验方法
1.2.1 粗酶的制备 称取20g的鲍鱼内脏加入3倍体积单位的磷酸氢二钠-柠檬酸缓冲液(pH6.0,0.1mol/L),4℃下进行匀浆,低温静置12h后,冷冻离心(12000r/min,4℃)20min,上清液即为粗酶液,4℃保存备用。
1.2.2 酶活力测定 β-1,3-葡聚糖酶酶活力测定参照Wang等人[19]报道的方法,并略作改进称取8mg底物,加入10mL磷酸氢二钠-柠檬酸缓冲液(pH6.0,0.1mol/L)配成质量浓度为0.8mg/mL的底物储备液。取上述底物0.4mL,加入0.1mL酶液,于一定温度下反应30min,再加入0.5mL 3,5-二硝基水杨酸试剂,于沸水浴显色反应5min,冷却后加入4mL蒸馏水稀释,540nm测定吸光光度值,以100℃水浴加热5min的酶液作为空白。酶活力单位(U)定义:在上述反应条件下,以每分钟水解底物释放出1μg还原糖所需的酶量定义为1个酶活力单位。
1.2.3 蛋白质含量的测定 蛋白质含量测定采用Lowry[20]法,以牛血清白蛋白(BSA)为标准蛋白。
1.2.4 适宜硫酸铵饱和度的确定 取8份100mL的粗酶液,边搅拌边加入硫酸铵,使其饱和度分别达到20%、30%、40%、50%、60%、70%、80%、90%,4℃静置12h,冷冻离心(12000r/min,4℃)10min,弃上清液,所得沉淀溶于10mL的磷酸氢二钠-柠檬酸缓冲液(pH6.0,0.1mol/L)中,同时测定上清液和沉淀中蛋白质含量及酶活力。
1.2.5 酶学性质的研究 最适反应pH的确定,分别用不同pH3.0~11.0的缓冲液配制成0.8mg/mL的底物然后加入酶液反应,测定酶活力。酸碱稳定性的确定,将酶液加入pH3.0~10.0的缓冲液,于4℃保持30min后,测定酶活力。最适反应温度的确定,酶液与底物溶液混合后,分别于10、20、30、40、50、60、70、80℃反应30min,反应前底物在各反应温度下预热5min,测定酶活力。金属离子对酶活力的影响,在酶与底物反应体系中,分别加入Fe3+、Hg+、Ni+、Cu2+、Ca2+、Mn2+、Mg2+、Fe2+、Zn2+、Ba2+、K+,使其终浓度为1mmol/L,以不加金属离子的酶活作为100%,测定酶活力。抑制剂对酶活力的影响,在酶与底物反应体系中,分别加入亮肽酶素、PMSF、EDTA、E-64、DTT、碘乙酸、1,10-啡啰啉和抗痛素使其终浓度为0.1mmol/L,以不加抑制剂的酶活作为100%,测定酶活力。底物特异性的研究,分别配制0.8mg/mL的羧甲基纤维素钠、褐藻酸钠、直链淀粉、支链淀粉和昆布多糖,加入一定量的酶液反应,测定酶活力。
2 结果与讨论
2.1 鲍鱼内脏β-1,3-葡聚糖酶的提取
鲍鱼内脏β-1,3-葡聚糖酶的提取率约为84.5%,即20g鲍鱼内脏能提取出16.89g的β-1,3-葡聚糖粗酶,酶总活力为246.97U。
2.2 硫酸铵饱和度对提取效果的影响
硫酸铵饱和度对鲍鱼内脏β-1,3-葡聚糖粗酶活力的影响见图1。随着硫酸铵饱和度的增加,上清液中酶活力随着硫酸铵饱和度的增加逐渐降低,当饱和度达到80%时,上清液中酶活力为0。沉淀中β-1,3-葡聚糖酶活力均逐渐增加,当饱和度达到60%时酶收率最大,但当硫酸铵饱和度超过60%时,沉淀中酶活力反而下降,这主要是由于高饱和度的硫酸铵使酶蛋白部分失活造成[21]。因此,确定盐析提取β-1,3-葡聚糖酶的饱和度最优条件为60%。

图1 β-1,3-葡聚糖酶硫酸铵盐析图Fig.1 Salting out figure of β-1,3-glucanase
2.3 最适pH的确定
由图2可知,鲍鱼内脏β-1,3-葡聚糖粗酶在pH4.0~ 7.0范围内相对酶活力较高,当pH为6.0时相对酶活力最高,当pH大于6.0时,随着缓冲液pH的升高,相对酶活力逐渐降低,当pH大于10.0时,相对酶活力降到50%以下。该结果与Ana-Belén等研究来源于S.cerevisiae的β-1,3-葡聚糖酶,最适pH为6.0相一致[22],但高于扇贝Mizuhopecten yessoensis中的β-1,3-葡聚糖酶的最适pH4.5[14],说明该酶的最适pH与物种差异性有关。
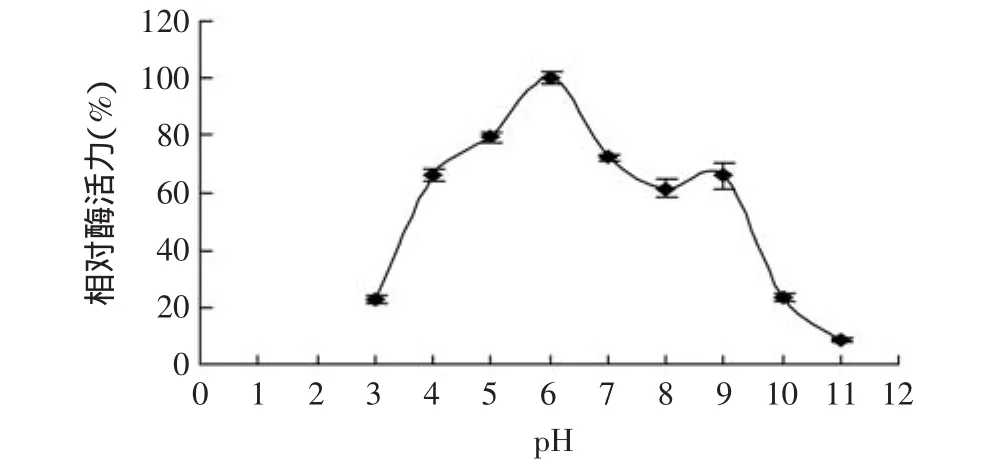
图2 β-1,3-葡聚糖酶的最适pHFig.2 Profile of pH-dependent of β-1,3-glucanase
2.4 酸碱稳定性的确定
由图3可知,鲍鱼内脏β-1,3-葡聚糖粗酶在pH4.0~7.0范围内比较稳定,当酶处于pH3.0和pH9.0的环境中时,相对酶活力分别降低到40.73%和32.85%,说明鲍鱼内脏β-1,3-葡聚糖粗酶的稳定性与酶的最适pH的范围相符。有研究表明鲍鱼体内多种消化酶都在pH4.0~8.0范围内稳定[16,23-24]。

图3 pH对β-1,3-葡聚糖酶稳定性的影响Fig.3 Stability of pH-dependent of β-1,3-glucanase
2.5 最适温度的确定
由图4可知,鲍鱼内脏β-1,3-葡聚糖粗酶在30~ 50℃范围内酶活力较高,相对酶活力均在80%以上,其最适反应温度为40℃,大于50℃时酶活力开始下降,至70℃时相对酶活力降低到50%以下。鲍鱼内脏β-1,3-葡聚糖粗酶在较宽的温度范围内都有一定酶活力,这一性质将有利于酶的应用,特别是在细胞自溶和啤酒发酵中[25-26]。
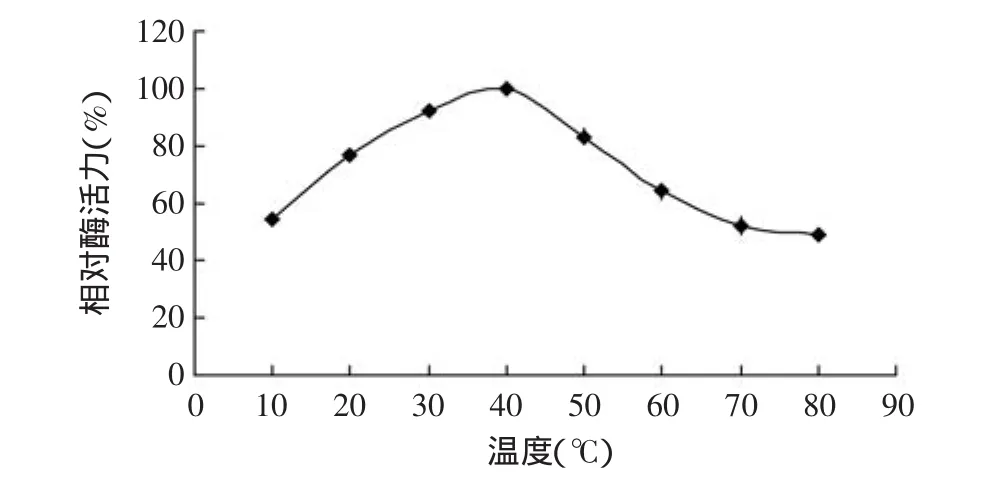
图4 β-1,3-葡聚糖酶的最适温度Fig.4 Profile of temperature-dependent of β-1,3-glucanase
2.6 金属离子对酶活力的影响

表1 金属离子对β-1,3-葡聚糖酶活力的影响Table 1 Effect of differet metl ions on β-1,3-glucanase
由表1可知,10mmol/L和1mmol/L两个离子浓度下Cu2+、Mg2+、Zn2+、Hg+、Fe3+和Ni+对鲍鱼内脏β-1,3-葡聚糖粗酶有抑制作用,其中Fe3+的抑制作用最强,Cu2+其次。Fe2+、Ba2+和K+对鲍鱼内脏β-1,3-葡聚糖粗酶酶活力影响不大。10mmol/L和1mmol/L的Mn2+均对鲍鱼内脏β-1,3-葡聚糖粗酶有激活作用,相对酶活力分别为276.5%和176.1%。金属离子对β-1,3-葡聚糖酶酶活力的影响,因酶的来源不同而存在差异。来源于木霉菌株LE02的β-1,3-葡聚糖酶被Mn2+强烈抑制[27],而Mn2+却能激活来源于海参的β-1,3-葡聚糖酶[12]。吴琪等人研究发现Fe3+对β-葡聚糖酶活力的影响不大,而唐治玉等人研究发现Fe3+对里氏木霉所产生的β-葡聚糖酶有强烈的抑制作用[27]。
2.7 抑制剂对酶活力的影响
实验结果表明,在所选择的抑制剂,即PMSF、EDTA、1,10-啡啰啉、E-64和亮肽酶素,其中只有E-64对鲍鱼内脏β-1,3-葡聚糖粗酶有激活作用,相对酶活力达164.02%,EDTA、亮肽酶素和1,10-啡啰啉对酶的抑制作用不明显,相对酶活力分别为95.37%、86.29%和88.86%。巯基抑制剂E-64对该酶无抑制作用反而能增加酶活力,可能是由于E-64抑制了酶液中的蛋白酶类(这些含巯基蛋白酶类会占据底物的结合位点,阻碍β-1,3-葡聚糖酶与底物结合),进而间接地激活了β-1,3-葡聚糖酶[28]。
2.8 底物特异性的研究
由表2可知,鲍鱼内脏β-1,3-葡聚糖粗酶对昆布多糖的水解能力最强,比活力可达1.85U/mg。该酶同时对褐藻酸钠支链淀粉有一定水解能力,但是对羧甲基纤维素钠和直链淀粉几乎不能降解。这说明该酶对β-1,3糖苷键有很强的专一性,同时对α-1,4糖苷键也有一定水解作用。鲍鱼主要以海带为食,而其中的能量物质即为β-1,3糖苷键连接的多糖,所以说鲍鱼内脏β-1,3-葡聚糖酶是鲍鱼能量代谢中的重要酶类之一[29]。

表2 β-1,3-葡聚糖酶的底物特异性Tab 2 Substrate specificity of β-1,3-glucanase
3 结论
用pH6.0,0.1mol/L磷酸氢二钠-柠檬酸缓冲液提取的鲍鱼内脏β-1,3-葡聚糖粗酶,最佳提取条件:60%硫酸铵盐析,其最适反应温度为40℃,酶的最适pH为6.0,酶活力在pH4.0~7.0范围内稳定。Mn2+能明显激活酶活力,而Cu2+、Fe3+、Hg+对酶活力有抑制作用,其中Fe3+的抑制作用最强。亮肽酶素和1,10-菲啰啉对酶活力有明显的抑制作用,而E-64对酶活力有一定的激活作用,此酶对β-1,3糖苷键有很强的专一性。
[1]P Campbell,J Braam,Plant J.Crystal structures and properties of denovo circularly permuted 1,3-1,4-Gulcanase[J].J Sci Food Agr,1998,15:553-561.
[2]陈茂彬,钟晓凌.β-葡聚糖对大麦加工的影响和β-葡聚糖酶的应用[J].食品研究与开发,1999,20(3):25-27.
[3]刘雨田,郭中文.β-葡聚糖和β-葡聚糖酶[J].畜禽业,2000(7):42-43.
[4]Monteiro V N,Ulhoa C J.Biochemical characterization of a β-l,3-gIueanase Trochoderma.Koningi Induced by cell wall of Rhizoctonia solani[J].Current Microbiology,2006,52(2):92-96.
[5]Ganapathi Sridevi,Chidambaram Parameswari,Natarajan Sabapathi.Combined expression of chitinase and β-1,3-glucanase genes in indica rice(Oryza sativa L.)enhances resistance against Rhizoctonia solani[J].Plant Science,2008,175:283-290.
[6]Delacruz J,Pintor-toroj A,Benitez T,et al.A novel endo-β-1,3-glucanase,BGN13.1,involved in the mycoparasitism of Trichoderna harzianum[J].J Bacteriol,1995,17(7):6937-6945.
[7]Hong TY,Meng M.Biochemical characterization and antifungal activity of an endo-l,3-β-glucase of Paenibacillussp.Isolated from garden soil[J].Applied Microbi ology and Biotec hnology,2003,61(5-6):472-478.
[8]Svnvijayendra,Yutaka Kashiwagi.Characterization of a new acid stable exo-β-1,3-Glucanase of Rhizoctonia solani and its action on microbial polysaccharides[J].Int J Biol Macromol,2009,44:92-97.
[9]孙斌,李多川,慈晓燕,等.小麦叶片β-1,3-葡聚糖酶的诱导、纯化与抗菌活性[J].植物生理与分子生物学学报,2004,30(4):399-404.
[10]丁平,杜林方,张年辉.青稞中β-1,3-葡聚糖酶的纯化及部分性质研究[J].天然产物研究与开发,2003,15(4):284-288.
[11]杨增明,胡忠.天麻球茎几丁质酶和β-1,3-葡聚糖酶的初步研究[J].云南植物研究,1990,12(4):421-426.
[12]赵军岗,董秀萍,朱蓓薇,等.海参肠道β-1,3-葡聚糖酶的提取条件及其酶学性质[J].大连轻工业学院学报,2007,26(4):289-293.
[13]Bachman E S,Mccla Y D R.Molecular cloning of the first metazoan beta-1,3 glucanase from eggs of the sea urchin Strongylocentrotus purpuratus[J].Proc Natl Acad Sci USA,1996,93:6808-6813.
[14]Svetlana N Kovalchuk,ElenV Sundukova,et al.Purification,cDNA cloning and homology modeling of endo-1,3-β-D-glucanase from scallop Mizuhopecten yessoensis[J].Comp Biochem PhysB,2006,143(4):473-485.
[15]李韬,周大勇,杨静峰,等.皱纹盘鲍性腺多糖抗氧化活性研究[J].水产科学,2009,28(4):179-182.
[16]Harumasa Suzuki,Ken-ichi Suzuki,AkiraInoue,et al.A novel oligoalginate lyase from abalone,Haliotis discus hannai,that releases disaccharide from alginate polymer in an exolytic manner [J].Carbohydr Res,2006,341:1809-1819.
[17]杨蕙萍,童圣英,王子.皱纹盘鲍淀粉酶和褐藻酸酶的研究[J].水产学报,1998,22(4):345-351.
[18]吴永沛,何碧烟.九孔鲍褐藻酸酶、琼脂酶及纤维素酶的提取纯化[J].海洋科学,2002,26(3):4-7.
[19]Wang GJ,Peil IN X,Geoffieyb,et al.Purification,characterization and genest ructure of 1,3-β-glucanase isoenzyme G from barley(Hordeum vulgare)[J].Eur J Biochem,1992,209:103-109.
[20]Lowry O H,Rosebrou GH N J,Farr A L,et al.Protein measurement with the Folin phehol reagent[J].Biol Chem,1951,193:265-275.
[21]Ching-yu TSAO,Yun-zu PAN,Shann-tzong JIANG,et al. Purification and Characterization ofAmylases from Small Abalone(Sulculus diversicolor aquatilis)[J].J Agric Food Chem,2003,51:1064-1070.
[22]Ana-Bele’n,Martı’n-Cuadrado,ThierryFontaine,et al. Characterization of the endo-β-1,3-gluca-nase activity of Scerevisiae Eng2 and other members of the GH81family[J]. Fungal Genet Biol,2008,45:542-553.
[23]Chingyu Tsao,Yunzu Pan,Shannntzong Jiang.Purification and Characterization of Amylases from Small Abalone(Sulculus diversicolor aquatilis)[J].J Agric Food Chem,2003,51:1064-1070.
[24]Ken-ichi Suzuki,Takao Ojima,Kiyoyoshi Nishita.Purification and cDNA cloning of a cellulase from abalone Haliotis discus hannai[J].Eur J Biochem,2003,270:771-778.
[25]Fontaine T,Hartland R P,Beauvais A,et al.Purification and characterization of an endo-1,3-β-glucanase from Aspergillus fumigates[J].Eur J Biochem,1997,243:315-321.
[26]郑元平,袁康培,冯明光.啤酒用β-葡聚糖酶高产菌株的选育及发酵条件优化[J].农业生物技术学报,2004,12(3):316-321.
[27]唐治玉,段会柯,熊善柏.木霉LE02 β-1,3-葡聚糖酶酶学特性的研究[J].食品与发酵工业,2007,33(5):32-36.
[28]Aranishi F,Ogata H,ar K,et al.Purification and characterization of cathepsin L from Hepatopancreas of Carp Cyrinus carpio[J].Comp Biochem Phys A,1997,118(3):531-537.
[29]Pang Z,Otaka K,Maoka T,et al.Structure of β-glucan oligomer from laminarin and its effect on human monocytes to inhibittheproliferationofU937cells[J].BiosciBiotechnolBiochem,2005,69:553-558.
Extraction and properties of β-1,3-glucanase from viscera of the abalone Haliotis discus hannai
GONG Guo-jun,ZHU Bei-wei,YANG Jing-feng*,MI Yun-long
(School of Food Science and Technology,Dalian Polytechnic University,Dalian 116034,China)
Extraction and partial properties of crude β-1,3-glucanase from viscera of the abalone Haliotis discus hannai were investigated.In the course of research,laminarin was used as a specific substrate to monitor the enzyme activity.Fresh abalone viscera were homogenized and mixed with three times volume of phosphate and citric acid buffer(pH6.0,0.1mol/L).Following extraction for 12h,the mixture was centrifuged. Proteins in the supernatant were precipitated with ammonium sulfate at the concentration of 60%saturation to get crude β-1,3-glucanase.The optimum activity temperature and pH of the crude enzyme were 40℃ and pH6.0.The enzyme activity appeared to be stable over pH4.0~7.0 and up to 40℃.The enzyme activity was activated significantly by Mn2+,Cu2+,Fe3+and Hg+could inhibit the enzyme activity,in which Fe3+was the strongest inhibitor.Leupeptin and 1,10-phenanthroline could inhibit the enzyme activity,but E-64 could enhance the enzyme activity.
abalone;β-1,3-glucanase;enzymatic properties
TS254.1
A
1002-0306(2012)03-0110-04
2010-12-28 *通讯联系人
宫国君(1984-),女,硕士研究生,研究方向:海洋生物化学与微生物学。
国家863高技术研究发展计划(2007AA091804);“十一五”国家科技支撑计划(2008BAD94B07)。

