miRNA-210在股骨头坏死患者血浆中的表达变化
殷俊辉,张长青,牛 鑫,郭尚春,胡 斌,何海燕,汪 泱
(1、上海市第六人民医院四肢显微外科研究所,上海 200233;2、上海市第六人民医院骨科,上海 200233)
近年来,关于血管形成的分子机制的相关研究逐渐成为研究的热点,目前公认的机制主要是Notch/血管内皮生长因子 (VEGF)/神经诱导因子调控机制[1],已证实miRNA可以影响细胞命运决定(Cell fate Decision),其表达量受到血流量的调控[2],且在基因调控血管生成的过程中,miRNA发挥着至关重要的作用。研究发现miRNAs通过靶基因E2Fs来调控低氧/缺血性的疾病中血管生[3]。
当前已发现的人的细胞中miRNA超过1400[4],miRNA是一类长度约18~25nt的内源性非编码小RNA,由一段具有发夹样结构、长度约70~80nt的单链RNA前体(pre-miRNA)剪切后生成。在动物体内,它通过与靶基因mRNA分子3’UTR区结合,抑制靶基因的翻译,负调控靶基因的蛋白水平[5]。同一个miRNA可以调控多个mRNA分子,不同的miRNA也可以调控同一mRNA分子[6]。根据预测,人类细胞中约1/3的蛋白编码基因受miRNA的调控。miRNA有进化上的高度保守性、时序性、组织特异性等特点。研究发现它在胚胎发育、细胞进化、血管形成、肿瘤发生等许多重要病理生理过程中发挥着重要的调控作用[7-9]。目前尚未有相关的文献资料提示缺血性股骨头坏死疾病中miRNAs是否具有特异性的改变,本研究的目的旨在初步探讨股骨头坏死患者血浆中miRNA的变化,为研究股骨头坏死的分子调控机制提供实验依据。
1 材料与方法
1.1 材料
1.1.1 研究对象 为我院经X线及MRI确诊为股骨头坏死III期的病人及健康人作为对照。分别为:确诊为激素性股骨头坏死的患者11例及健康正常对照组4例。收集患者及对照组的血浆,所有标本-80°C保存。所有参与患者自愿签署了知情同意书。
1.1.2 主要仪器 实时定量PCR仪7500(美国ABI)
1.1.3 主要试剂 miRcute miRNA提取分离试剂盒、miRcute miRNA cDNA第一链合成试剂盒、miR-cute miRNA荧光定量检测试剂盒。
1.2 方法
1.2.1 RNA的提取 按miRcute miRNA提取分离试剂盒说明书操作。
1.2.2 总RNA纯度和浓度的检测 使用超微量紫外分光光度计测定RNA浓度和纯度,记录OD260值。RNA纯度检测:RNA溶液的OD260/OD280的比值(比值范围1.8~2.1为纯度合格)。样品RNA浓度计算公式为:OD260×40×稀释倍数(ng/μl)。
1.2.3 cDNA的合成 按miRcute miRNA cDNA第一链合成试剂盒说明书操作。
1.2.4 实时定量PCR按miRcute miRNA荧光定量检测试剂盒说明书操作。以U66为内参,引物序列及PCR产物片段大小为mi-RNA210 forwardprimer扩增产物为TgCCTCTgTgCgTgTgACAgC;U66上游:GCAAACTCGATCACTAGCTCTGC下游:AGAAAGAACCACCTCAGTAGTGTCTG扩增产物为117bp。
1.2.5 数据分析 数据采用2-△△CT法进行分析。变化倍数大于2为高表达,小于0.5为低表达。
1.3 统计学分析 以上实验重复三遍,实验数据用均数±标准差表示,采用SPSS 12.0统计软件对实验结果进行单因素方差分析,P<0.05为有统计学意义。
2 结果
与对照组正常人相比:miRNA-210的表达水平在股骨头坏死III期的患者血清中明显升高,其上调变化倍数为2.385±0.128(P<0.05);在无股骨头坏死的正常人血浆中则低表达,变化倍数为0.274±0.004(P<0.05)。 如图 1 所示。
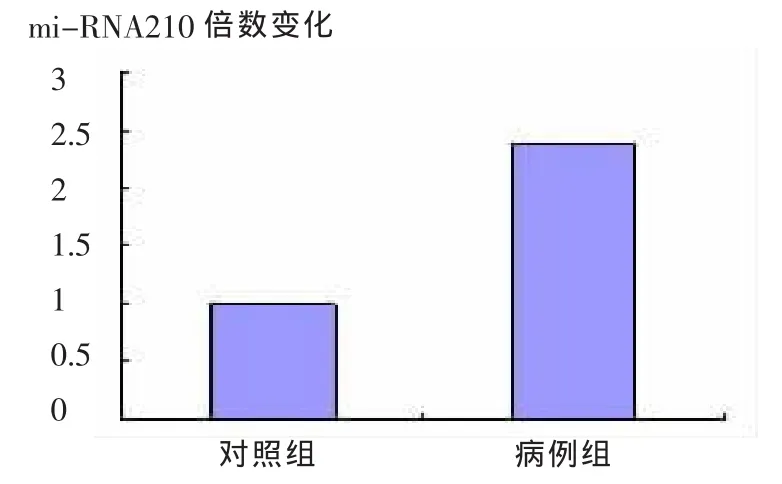
图1 股骨头坏死患者与正常人血浆中miRNA-210的表达比较对照组:正常人血浆中miRNA-210表达变化;病例组:股骨头坏死患者血浆中miRNA-210表达变化
3 讨论
血性股骨头坏死(AvNFH,Avascular necrosis of femoral head)至今仍是医学界尚未攻克的难题之一,较其他部位的骨坏死为多见,与多种疾病及创伤有关。在整个世界范围内,非创伤性股骨头坏死者的数量已呈逐年上升的趋势,激素性股骨头坏死占非创伤性股骨头坏死的首位,且其发病率仍呈增长趋势。自20世纪70年代以来,骨坏死患者的数量增加了10倍。男女比例大概是1.6:1,特发性及激素性骨坏死的发病年龄在30~50岁[10]。创伤性血流中断、减压病、库欣病、酒精中毒、血红蛋白病、高血压病和放射性元素及激素治疗均可以导致股骨头坏死[11-15]。其中服用激素治疗的患者中10%-30%会发生股骨头坏死。然而,到目前为止,骨坏死的发病机制仍不清楚。导致股骨头坏死的最主要的病理生理机制是供应股骨头血管的梗阻和缺血。而有关其发病机制的研究甚多,目前有脂质代谢紊乱学说、血管内凝血学说、骨质疏松学说、免疫复合物沉积引起动脉血管炎学说、静脉内淤滞引起骨内高压学说、激素对骨细胞的细胞毒作用学说等。这些学说虽侧重点各不相同,但最后皆归结为共同的一点,即均可导致股骨头微循环障碍,引起股骨头血液供应减少,最后发生股骨头坏死性改变。
已证实miRNA-210在缺氧导致的血管新生及细胞凋亡、肿瘤的发生、DNA损伤的修复、过程中表达量明显上升。而HIF-α与其表达量的上调直接相关[16]。miRNA-210上调促进血管内皮生长因子VEGF)及血管内皮细胞生成毛细血管网[17]。另外miRNA-126、miRNA92a等均已证实与生理或病理性的血管生成具有相关性[18]。本实验发现股骨头坏死患者血浆miRNA-210的表达水平较正常对照组明显升高,与目前报道较多的心血管系统及肿瘤等疾病中miRNA-210的表达量改变情况基本一致,证明其在股骨头坏死疾病过程中对股骨头内血管的新生及凋亡可能存在一定的负调控作用,提示高表达的miRNA-210可能与股骨头坏死的发生发展过程中的作用机制有关,值得进一步研究。
[1]Nicoli S,Standley C,Walker P,et al.microRNA-mediated integration of haemodynamics and Vegf signaling during angiogenesis.[J]Nature,2010,464(7292):1196-1200.
[2]Liu D,Krueger J,Lenoble F.The role of blood flow and microRNAsin blood vessel development[J].Int JDev Biol,2011,55:419-429.
[3]Biyashev D,Qin G.E2F and microRNA regulation of angiogenesis.[J]Am JCardiovasc Dis,2011,1(2):110-118.
[4]Friedman RC,Farh KK,Burge CB,etal.DP.Most mammalian mRNAs are conserved argets of microRNAs[J].Genome Res,2009,19:92-105.
[5]Liu J,Valencia-Sanchez MA,Hannon GJ,et al.MicroRNA dependent localization of targeted mRNAs to mammaliam P-bodies[J].Nat Cell Biol,2005,7:719-723.
[6]廖 伟,汪 泱,娄远蕾,等.人诱导性多能干细胞向神经干细胞分化过程中相关microRNA的表达变化 [J].实验与检验医学,2011,29(1):3-5.
[7]Ghildiyal Z.Small silencing RNAs:an expanding universe[J].Nat Rev,2009,10:94-108.
[8]Visone C.MiRNAs and cancer[J].Am J Patho,2009,174:1131–1138.
[9]甘自立,胡 意.miRNAs与肿瘤血管形成[J].实验与检验医学,2011,29(5):505-508.
[10]Pak j.Autologous Adipose Tissue-Derived Stem Cells Induce Persistent Bone-Like Tissue in Osteonecrotic Femoral Heads[J].Pain Physician,2012,15:75-85.
[11]Chandler FA.Coronary disease of the hip[J].Clin Orthop Relat Res,2001,386:7-10.
[12]Saito S,Ohzono K,Ono K.Early arteri-opathy and postulated pathogenesis of osteonecrosis of the femoral head.The intracapital arterioles[J].Clin Orthop Relat Res,2001,277:98-110.
[13]Jones JP Jr.Fat embolism and osteo-necrosis[J],Orthop Clin North Am1985,16:595-633.
[14]Hungerford DS,Lennox DW.The im-portance of increased intraosseous pressure in the development of osteo-necrosis of the femoral head:Implica-tions for treatment[J].Orthop Clin North Am,1985,16:635-654.
[15]Saito S,Inoue A,Ono K.Intramedul-lary haemorrhage as a possible cause of avascular necrosis of the femoral head.The histology of 16 femoral heads at the silent stage[J].Jone Joint Surg Br,1987,69:346-351.
[16]Rocha S.Gene regulation under low oxygen:holding your breath for transcription[J].Trends Biochem Sci,2007,32:389–397.
[17]Fasanaro P,D'Alessandra Y,Di Stefano V,et al.MicroRNA-210 modulates endothelial bcell response to hypoxia and inhibits the receptor tyrosine kinase ligand Ephrin-A3[J].J Biolb Chem,2008,283:15878–15883.
[18]Mendell JT.miRiad roles for the miR-17-92 cluster in development and disease[J].Cell,2008,133:217–222.

