HDAC家族基因在缺血性脑损伤后大鼠脑组织中的表达变化
牛 鑫,汪 泱,殷俊辉,胡 斌,郭尚春,何海燕,邓志锋
(上海交通大学附属第六人民医院,1、四肢显微外科研究所;2、神经外科,上海 200233)
近年来许多研究发现,脑缺血后在缺血损伤区有血管新生,一定程度上能促进缺血区神经功能修复,但其相关调控机制仍需要进一步研究[1,2]。越来越多的证据表明,表观遗传学相关的信号通路在修复过程中可能起到重要作用。在表观遗传学调控的重要过程——组蛋白的修饰过程中,组蛋白乙酰化酶HDAC(histone deacetylase)家族是重要的参与者[3]。目前已经发现18个HDAC家族成员,通过过乙酰化或抑制乙酰化来上调或者下调基因的表达,参与多种生命过程。其中HDAC1能够促进血管生成[4,5],HDAC4能够抑制血管生成[6]。虽然HDAC1-11在大鼠脑中都有表达[7],但是,它们是否在脑缺血的过程中也发挥调控作用,是否参与脑缺血后血管新生调节机制,目前还没有报道。我们通过构建大鼠急性脑缺血模型,检测脑缺血后24h缺血皮质区HDAC家族成员HDAC1、HDAC2、 HDAC3、 HDAC4、 HDAC6、 HDAC10、HDAC11的表达水平,以明确其在脑缺血后的变化,初步探讨其在脑缺血后血管新生中的可能调控作用。
1 材料与方法
1.1 材料
1.1.1 实验动物 清洁级成年 (7~9周)雄性Sprague-Dawley(SD)大鼠,重量250~300g,由南昌大学医学院动物实验中心提供。所有动物实验都按照动物实验伦理委员会的规定进行。
1.1.2 主要仪器 实时定量PCR仪7500(美国ABI)
1.3 主要试剂 QIAGEN Allprep RNA/DNA/Protein mini Kit试剂盒、Promega A3500 cDNA第一链合成试剂盒、TOYOBO Sybr Green 2×PCR Master荧光定量检测试剂盒。
1.2 方法
1.2.1 动物模型建立 参考改良的Longa法制作大脑中动脉阻塞缺血损伤模型:麻醉大鼠后,暴露右侧颈总动脉,颈内动脉和颈外动脉,于颈外动脉近心端管壁上做一“V”形切口,从切口插入一特制4.0线栓至颈内动脉后,继续缓慢滑入至大脑中动脉起始部,阻塞大脑中动脉,插入长度约距颈总动脉分叉处1.8cm;2h后取出线栓,缝合伤口放回笼内。假手术组仅暴露动脉,不做线栓阻塞缺血处理。MCAO大鼠麻醉清醒后参照Zea Longa法行神经功能评分,1~3分者纳入实验研究对象。将大鼠随机分缺血后1d组与假手术组。缺血处理后24h,用500ml无菌生理盐水心脏灌注后游离出完整脑组织,-20℃下放置30min后,用RNase free刀片切取缺血皮质区约100mg,存于RNase free EP管中,于-80℃冰箱保存备用。同时留取假手术组皮质区为实验对照。
1.2.2 RNA的提取 按QIAGEN Allprep RNA/DNA/Protein mini Kit提取分离试剂盒说明书操作
1.2.3 总RNA纯度和浓度的检测 使用超微量紫外分光光度计测定RNA浓度和纯度,记录OD260值。RNA纯度检测:RNA溶液的OD260/OD280的比值(比值范围1.8~2.1为纯度合格)。样品RNA浓度计算公式为:OD260×40×稀释倍数(ng/μl)。
1.2.4 cDNA的合成按Promega A3500 cDNA第一链合成试剂盒说明书操作。
1.2.5 实时定量PCR按TOYOBO Sybr Green 2×PCR Master荧光定量检测试剂盒说明书操作。以GAPDH 为内参。 反应条件:95℃,1min;95℃ 15s,60℃ 15s,72℃ 40s。40个循环。引物序列及 PCR 产物片段大小见表1。
1.2.6 数据分析 数据采用2-△△CT法进行分析。t-检验P<0.05为有统计学意义。
2 结果

表1 荧光定量PCR引物列表
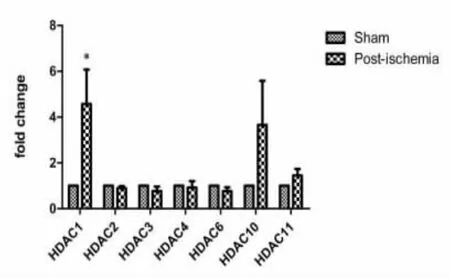
图1 脑缺血后缺血皮质区HDAC的表达变化
HDAC家族各成员在脑缺血后表达水平均有所改变:如图1所示,血皮质区的HDAC1,HDAC10表达均高于假手术组。其中HDAC1的表达量显著高于假手术组。实验结果表明,脑缺血后体内缺血缺氧环境可刺激HDAC1的表达。
3 讨论
当前,积极促进缺血区的血运重建已经成为治疗脑缺血性疾病的共识。然而脑缺血后血管新生机制十分复杂,积极深入探寻其新的调控途径仍是众多学者的研究重点。实验结果表明,与假手术组比较,脑缺血后1d即可检测到HDAC家族成员表达开始改变;证实了脑缺血后,体内缺血缺氧环境可迅速影响其的表达。根据Aurora等人的报道,HDAC1具有显著的促进血管生成的功能。在我们的实验结果中,缺血组大鼠大脑皮层的HDAC1表达水平显著上调,提示缺血手术后皮层代偿性增生血管生长促进因子,促进血管修复,从而修复缺血带来的损伤。这同时表明,HDAC1对于缺血损伤的应激非常迅速。HDAC是广泛表达于多种组织的表达调控因子。其它已经被证实的可以在发育过程中或者癌症发生过程中抑制血管生成的HDAC家族成员,比如,HDAC4,HDAC5,HDAC6[6,8-10],在本次实验中未显示出与对照组的显著性差异,或者,没有被检测到。这提示HDAC家族成员在不同的组织、生命过程中功能不同。或者不同家族成员的应激速度不同。脑缺血后血管新生过程早期很可能只包含HDAC1家族成员参与发挥作用。本实验初步明确了脑缺血后缺血皮质区HDAC家族基因的表达变化,为今后深入探讨HDAC家族基因对脑缺血后血管新生的调控作用提供了实验依据。
[1]高法梁,娄远蕾,阮琼芳,等.缺血性脑损伤大鼠MicroRNA 210的动态变化[J].实验与检验医学,2010,28(3):230-234.
[2]吕世刚,祝新根,张爱军,等.骨髓间充质干细胞移植对脑缺血区微血管增生及Notch1表达的影响[J].实验与检验医学,2009,27(1):1-4.
[3]de Ruijter AJ,van Gennip AH,Caron HN,et al.Histone deacetylases (HDACs):characterization of the classical HDAC family[J].Biochem J,2003,370(Pt 3):737-749.
[4]Jeon HW,Lee YM.Inhibition of histone deacetylase attenuates hypoxia-induced migration and invasion of cancer cells via the restoration of RECK expression[J].Mol Cancer Ther,2010,9(5):1361-1370.
[5]Aurora AB,Biyashev D,Mirochnik YX et al.NF-kappaB balances vascular regression and angiogenesis via chromatin remodeling and NFAT displacement[J].Blood,2010,116(3):475-484.
[6]Geng H,Harvey CT,Pittsenbarger J,et al.HDAC4 protein regulates HIF1alpha protein lysine acetylation and cancer cell response to hypoxia[J].JBiol Chem,2011,286(44):38095-38102.
[7]Broide RS,Redwine JM,Aftahi N,et al.Distribution of histone deacetylases 1-11 in the rat brain[J].JMol Neurosci,2007,31(1):47-58.
[8]Urbich C,Rossig L,Kaluza D,et al.HDAC5 is a repressor of angiogenesis and determines the angiogenic gene expression pattern of endothelial cells[J].Blood,2009,113(22):5669-5679.
[9]Li D,Xie S,Ren Y,et al.Microtubule-associated deacetylase HDAC6 promotes angiogenesis by regulating cell migration in an EB1-dependent manner[J].Protein Cell,2011,2(2):150-160.
[10]Chen S,Sang N.Histone deacetylase inhibitors:the epigenetic therapeutics that repress hypoxia-inducible factors[J].J Biomed Biotechnol,2011,2011:197946.

