三环已基锡2-氨基-6-氯苯甲酸酯配合物的合成、结构及量子化学研究
张复兴 王剑秋 邝代治 冯泳兰 陈志敏 许志锋
(衡阳师范学院化学与材料科学系,功能金属有机材料湖南省普通高等学校重点实验室,衡阳 421008)
三环已基锡2-氨基-6-氯苯甲酸酯配合物的合成、结构及量子化学研究
张复兴*王剑秋 邝代治 冯泳兰 陈志敏 许志锋
(衡阳师范学院化学与材料科学系,功能金属有机材料湖南省普通高等学校重点实验室,衡阳 421008)
三环己基氢氧化锡与2-氨基-6-氯苯甲酸按物质的量比1∶1在苯溶剂中反应合成了三环己基锡2-氨基-6-氯苯甲酸酯。经X-射线衍射方法测定了其晶体结构,配合物属单斜晶系,空间群为P21/c,晶体学参数a=0.952 00(4)nm,b=0.918 55(3)nm,c= 2.909 12(12)nm,β=93.187(2)°,V=2.539 97(17)nm3,Z=4,Dc=1.409 g·cm-3,μ(Mo Kα)=11.31 cm-1,F(000)=1 112,R1=0.038 2,wR2= 0.098 6。中心锡与环己基碳原子和氧原子构成畸型四面体。对其结构进行量子化学从头计算,探讨了配合物的稳定性、分子轨道能量以及一些前沿分子轨道的组成特征。通过循环伏安法研究了其电化学性质。
三环己基锡2-氨基-6-氯苯甲酸酯;合成;晶体结构;从头计算;循环伏安
有机锡羧酸酯由于具有结构的多变性、丰富的反应性、较强的生物活性和催化活性,多年来一直引起人们的兴趣[1-5]。然而,由于有机锡化合物的高毒性,又使它们的应用受到了一定的限制。相关研究表明,有机锡化合物的生物活性与中心锡原子的构型有关,而中心锡原子的构型决定于直接与锡原子相连的烃基的结构和配体的类型[6-11]。功能化的羧酸配体能极大的改变锡原子的配位方式,显著的影响有机锡羧酸酯的生物活性,从而调节其毒性与生物活性之间的平衡。当以芳酸为配体,在芳环上引入功能化基团时,它既可利用立体效应,也可利用其电子效应来极大地改变有机锡羧酸酯的物理与化学性能。近年来我们合成了一系列有机锡芳香羧酸酯化合物,并研究了它们的结构和性能[12-17]。为了更进一步揭示有机锡化合物结构与性能的关系,本文合成了三环己基锡2-氨基-6-氯苯甲酸酯,通过元素分析、红外光谱和核磁共振氢谱进行了表征,用X-射线单晶衍射测定了晶体结构,对其结构进行量子化学从头计算,探讨了配合物的稳定性、分子轨道能量以及一些前沿分子轨道的组成特征。并利用循环伏安法对其进行了电化学性质分析。
1 实验部分
1.1 试剂与仪器
日本岛津 FTIR-8700红外光谱仪(4 000~400 cm-1,KBr),PE-2400(Ⅲ)元素分析仪,Bruker SMART APEXⅡ单晶衍射仪,X4数字显微熔点测定仪。所用试剂均为分析纯。
1.2 实验过程
在50mL圆底烧瓶中,加入0.770 g(2mmol)三环己基氢氧化锡、0.341 g(2mmol)2-氨基-6-氯苯甲酸、40 mL苯,在电磁搅拌下加热回流分水反应5 h。趁热过滤除去不溶性固体,滤液旋转蒸发除去部分溶剂,放置析出棕色固体,用适当的溶剂重结晶得棕色透明晶体0.748 g,产率69.49%。熔点:104~106℃。红外光谱主要吸收峰:3 377.1(m),3 055.5 (m),2920.0(s),11614.3(s),1577.7(m),1468.5(m),1444.6(m),1357.8(s),589.0(w),453.2(w)cm-1。1H NMR (CDCl3,400 MHz),δH:1.31~2.00(m,3×11H,Cp-H),4.97(s,2H,Ar-NH2),6.55(d,1H,3-Ar-H),6.73(d,1H, 5-Ar-H),7.01(t,1H,4-Ar-H)。元素分析(C25H38ClNO2Sn),计算值(%):C,55.74;H,7.06;N,2.60。实测值(%):C,56.08;H,7.12;N,2.54。
1.3 晶体结构测定
选取尺寸为0.2 mm×0.2 mm×0.2 mm单晶体,在Bruker SMART APEXⅡ单晶衍射仪上进行衍射实验,在296(2)K下,用石墨单色化的Mo Kα(λ= 0.071 073 nm)射线,以ω-2θ方式扫描收集数据。在2.14°≤θ≤27.61°范围内共收集18 172个衍射点,其中独立衍射点4 473个(Rint=0.032 2),可观察衍射点4 126个(I>2σ(I))。全部数据经Lp校正和吸收校正,以直接法进行晶体结构解析。部分非氢原子坐标随后用差值Fourier合成法确定,理论加氢计算法给出氢原子位置坐标。用SHELX97程序以全矩阵最小二乘法对非氢原子坐标及其各向异性热参数进行修正,残差因子R1=0.038 2,wR2=0.098 6。
CCDC:888049。
2 结果与讨论
2.1 晶体结构描述
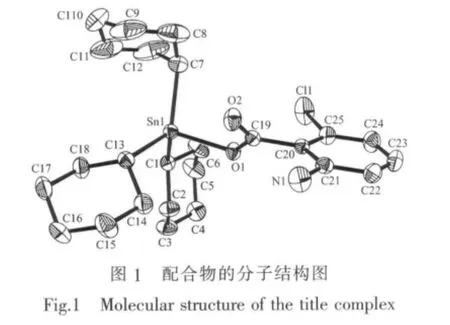
配合物属单斜晶系,空间群为P21/c,晶体学参数a=0.952 00(4)nm,b=0.918 55(3)nm,c=2.909 12(12) nm,β=93.187(2)°,V=2.539 97(17)nm3,Z=4,Dc=1.409 g·cm-3,μ(Mo Kα)=11.31cm-1,F(000)=1112,R1=0.038 2, wR2=0.0986;Δρmax=743 e·nm-3,Δρmin=-493 e·nm-3。配合物的主要键长和键角列于表1,分子结构见图1,晶胞中分子堆积见图2。
从图1和结构参数可知,中心锡原子与3个环己碳原子及1个羧基氧原子相连形成四面体构型。由于与2-氨基-6-氯苯甲酰基的空间效应引起了3个环己基处于不同的空间环境,使得环上C-C键在0.142 9~0.158 3 nm之间形成不对称六元环,且四面体的键角均偏离了正四面体角。3个 Sn-C键键长分别为Sn(1)-C(1)0.215 4(3)nm、Sn(1)-C(7) 0.215 4(43)nm和Sn(1)-C(3)为0.215 6(3)nm,较为接近,与中心锡原子间的键角分别为C(1)-Sn(1)-C(7) 110.24(14)°、C(1)-Sn(1)-C(13)为 112.69(11)°、C(7)-Sn(1)-C(13)123.54(14)°,都比正四面体键角大;Sn-O键键长为0.207 49(19)nm,与Sn(1)-C键的键角分别为C(1)-Sn(1)-O(1)为94.78(9)°、C(7)-Sn(1)-O(1)为102.56(13)°、C(13)-Sn(1)-O(1)108.48(9)°,都比正四面体角小;这种键角的变化是由于环己基的空间位阻所致。这种空间排列就决定了中心锡与环己基碳原子和氧原子构成畸型四面体。

表1 配合物的主要键长和键角Table 1 Selected bond distances(nm)and selected bond angles(°)of the title com plex

2.2 配合物的能量和前沿分子轨道组成
根据晶体结构的原子坐标,运用Gaussian 98W程序和HF/lanl2dz基组水平,计算得到分子的总能量为-1 190.151 550 3 a.u,最高占据轨道能量为-0.300 64 a.u,最低空轨道能量为0.102 67 a.u。可见总能量和最高占有轨道能量均较低,最高占据轨道与最低未占轨道的能量间隙ΔE=0.4.331 a.u,表明分子结构稳定。从氧化还原转移的角度分析,HOMO能级较低,难以给出电子而被氧化。
为探索化合物的电子结构与成键特征,对化合物分子轨道进行分析,用参与组合的各类原子轨道系数的平方和来表示该部分在分子轨道中的贡献,并经归一化。把化合物原子分为七部分:(a)锡原子Sn;(b)羧基氧原子O;(c)羧基碳原子C(Ⅲ);(d)苯环碳原子C(Ⅲ);(e)环己环碳原子C(Ⅲ); (f)氯原子Cl;(g)氮原子N;(h)氢原子H。前沿占有轨道和未占有轨道各取5个,计算结果如表2和图3所
表2和图3显示分子的成键特征:①前沿占有分子轨道中,苯环碳对分子轨道的贡最大,为67.3%,说明苯环具有高度的共轭离域性和稳定性;其次是氨基氮原子为28.24%,说明氨基氮原子与苯环具有良好的共轭性。② 前沿占有分子轨道中,氯原子对分子轨道的贡献仅为2.73%,比氮原子小得多,说明氯原子能与苯环的共轭程度比氮原子小,与原子轨道重叠能量相近的原则相一致。因氮原子是2p轨道与苯的大π键共轭,而氯原子是3p与苯的大π键共轭,两者的能量相差较大。③前沿占有分子轨道中,羧基氧和羧基碳对分子轨道的贡献都较小,分别为1.07%和0.29%,说明羧基与苯环的共轭程度小,这主要是在羧基的2个邻位有空间体积较大的氨基和氯原子,由于空间位阻使羧基难以与苯环共平面。④比较HOMO与LUMO的各类原子轨道成份,可以看出,当电子从HOMO激发到LUMO轨道时,主要是氮原子和氯原子能上的电子通过苯环向羧基和锡原子转移,苯环既是电子转移的桥梁也是电子转移的受体。

表2 分子轨道组成Table 2 Calculated some frontier molecular orbitals composition(%)of com plex

2.3 电子结构研究
由Mulliken布居分析得到结构单元的原子电荷如表3所示,显示出电荷布居的一些规律和特征:①中心锡原子失去较多电子而荷1.766 397的正电,所有氢原子均荷正电。②2个氧原子中O(1)、O(2)荷0.751 070和0.506 465负电,这是因为O(1)与Sn(1)形成了Sn-O键,从锡原子上获得了电子,而O(2)没有与Sn(1)成键,因此,羧基与锡原子是单齿配位,与X-射线衍射的结论相一致。③碳原子中除羧基碳、与羧基相连的苯环碳及与氨基相连的苯环碳荷正电外,其它碳原子均荷负电,并且符合电荷分布一般规律。

表3 配合物的部分原子电荷Table 3 Atom ic charge populations of com pound
2.3 配合物的循环伏安(CV)
为考察所合成配合物在溶液中的电化学性能,采用常规三电极体系:玻碳电极为工作电极,铂电极为辅助电极,SCE为参比电极,以乙醇为溶剂,配合物的浓度为 1.0μmol·L-1,于室温下进行电化学性质测定。在-0.500~1.000 V范围内,以100mV· s-1速度进行循环伏安扫描,所得结果如图4。从图可看出,配合物无还原峰,仅有1个氧化峰,其峰电位为0.536 V,由此说明配合物在电极上的电子转移是不可逆的。

[1]Chandrasekhar V,Thirumoorthi R,Metre R K,et al.J. Organomet.Chem.,2011,696:600-606
[2]Effendy,Marchetti F,Marinelli A,et al.J.Inorg.Chem. Acta.,2011,366:388-393
[3]Hanif M,Hussain M,Ali S,et al.J.Polyhedron,2010,29: 613-619
[4]ZHANG Xiao-Yan(张晓燕),YANG Guang(杨光),ZHANG Jun(张俊),et al.Chem.J.Chinses Universities(Gaodeng Xuexiao Huaxue Xuebao),2010,31(6):1162-1166
[5]Siddiqi ZA,Shahid M,Kumar S,etal.J.Organomet.Chem., 2009,694:3768-3774
[6]Ruan B F,Tian Y U,Zhou H P,et al.J.Chim.Acta,2011, 365:302-308
[7]ZHANGFu-Xing(张复兴),KUANGDai-Zhi(邝代治),WANG Jian-Qiu(王剑秋),etal.Chinese J.Inorg.Chem.(WujiHuaxue Xuebao),2006,22(7):1321-1326
[8]YINHan-Dong(尹汉东),WANGChuan-Hua(王传华),WANG Yong(王勇),et al.Chinese J.Inorg.Chem.(Wuji Huaxue Xuebao),2002,18(2):201-204
[9]YAN Wen-Hua(闫文华),KANGWan-Li(康万利),LI Jin-Huan(李金环).Chinese J.Appl.Chem.(Yingyong Huaxue), 2007,24(6):660-664
[10]Shujha S,Shah A,Rehman Z U,et al.J.Eur.J.Med. Chem.,2010,45:2902-2911
[11]ZHANGFu-Xing(张复兴),KUANGDai-Zhi(邝代治),WANG Jian-Qiu(王剑秋),etal.Chinese J.Org.Chem.(YoujiHuaxue), 2008,28(8):1457-1461
[12]ZHANG Fu-Xing(张复兴),WANG Jian-Qiu(王剑秋),KUANG Dai-Zhi(邝代治),etal.Chinese J.Inorg.Chem.(WujiHuaxue Xuebao),2011,27(8):1591-1595
[13]ZHANGFu-Xing(张复兴),WANG Jian-Qiu(王剑秋),KUANG Dai-Zhi(邝代治),etal.Chinese J.Inorg.Chem.(WujiHuaxue Xuebao),2011,27(6):1111-1115
[14]YU Jiang-Xi(庾江喜),KUANG Dai-Zhi(邝代治),YIN Du-Lin(尹笃林),et al.Chinese J.Inorg.Chem.(Wuji Huaxue Xuebao),2010,26(8):1507-1510
[15]ZHANG Fu-Xing(张复兴),WANG Jian-Qiu(王剑秋),KUANG Dai-Zhi(邝代治),etal.Chinese J.Inorg.Chem.(WujiHuaxue Xuebao),2009,25(2):213-217
[16]ZHANG Fu-Xing(张复兴),WANG Jian-Qiu(王剑秋),KUANG Dai-Zhi(邝代治),et al.Chinese.J.Appl.Chem.(Yiyiong Huaxue),2009,26(6):662-666
[17]Zhang F X,Wang JQ,Kuang D Z,et al.Chinese J.Struct. Chem.,2010,29(10):1529-1535
Synthesis,Crystal Structure and Quantum Chem istry of the Tricyclohexyltin 2-Am ino-6-chloro Benzoate
ZHANG Fu-Xing*WANG Jian-Qiu KUANG Dai-Zhi FENG Yong-Lan CHEN Zhi-Ming XU Zhi-Feng
(Departmentof Chemistry and Material Science,Hengyang Normal University;Key Laboratory of Functional Organometallic Materials of Hengyang Normal University,College of Hunan Province,Hengyang,Hunan 421008,China)
The tricyclohexyltin 2-amino-6-chlorobenzoate was synthesized by the reaction of the tricyclohexyltin hydroxide with the 2-amino-6-chlorobenzoic acid.Its structure has been determined by X-ray single crystal diffraction.The crystal belongs tomonoclinic with space group P21/c,a=0.952 00(4)nm,b=0.918 55(3)nm,c= 2.909 12(12)nm,β=93.187(2)°,V=2.539 97(17)nm3,Z=4,Dc=1.409 g·cm-3,μ(Mo Kα)=11.31 cm-1,F(000)=1 112, R1=0.038 2,wR2=0.098 6.The tin atom has a distorted tetrahedral geometry.The study on title complex has been performed,with quantum chemistry calculation by means of G98W package and taking Lanl2dz basis set.The stabilities of the complex,the orbital energies and composition characteristics of some frontiermolecular orbitals have been investigated.The electrochemistry propertieswere studied by cyclic voltammetry.CCDC:888049.
tricyclohexyltin 2-amino-6-chlorobenzoate;synthesis;crystal structure;ab initiomethod;Cyclic voltammetry
O612.43+2
A
1001-4861(2012)09-1890-05
2012-01-29。收修改稿日期:2012-06-06。
湖南省教育厅重点项目(No.10A014、10K010)、湖南省自然科学基金项目(No.11JJ3021)、湖南省重点学科基金资助项目。
*通讯联系人。E-mail:zfx8056@yahoo.com.cn;会员登记号:S060018907M。

