锌铈混合金属氧化物薄膜电化学沉积的研究
许胜霞 丁 翻 刘勇沼 张建民
(郑州大学化学与分子工程学院,郑州 450001)
锌铈混合金属氧化物薄膜电化学沉积的研究
许胜霞 丁 翻 刘勇沼 张建民*
(郑州大学化学与分子工程学院,郑州 450001)
采用自制四电极体系,原位测量锌铈混合氧化物薄膜电沉积过程电极/溶液界面pH的动态变化。电极/溶液界面的pH-时间曲线表明,pH快速上升后达到平衡,且电沉积过电位越大,达到平衡pH值的时间越短,平衡pH值也越高。X射线粉末衍射(XRD)实验证明薄膜沉积物是由ZnO和CeO2组成。电感耦合等离子体(ICP)技术分析了不同电沉积电位、不同电沉积时间下电沉积产物中Ce(Ⅲ)/Zn(Ⅲ)的物质的量比,结果表明Ce(Ⅲ)/Zn(Ⅲ)的物质的量比随着pH值的升高而增加。依据Zn2+离子和Ce3+离子液相和固相中存在形态的热力学数据,计算了2种金属离子的条件溶解度随pH的变化曲线。结合实验测试数据和理论计算结果,讨论了电极表面金属氧化物的电化学沉积机理,并阐明了阴极表面混合金属氧化物的组成取决于液-固两相中金属离子存在形态的热力学性质。
阴极电沉积;界面pH;氧化锌;氧化铈
众所周知,ZnO是一种有较高的直接宽带隙(3.37 eV),较大激子结合能(60meV)[1],并且有许多典型性能的半导体材料,如光学性质、物理化学性、压电性、透明导电性,被广泛的应用到各个领域,如短波长光电器件、化学传感器、压电、透明导体。材料的性质不仅取决于晶体的结构和表面形貌,材料的组成比例也有重要的影响。由于稀土元素具有特殊的4f层电子结构,导致稀土元素形成的化合物有许多能量能级、大量的亚稳态,因此当ZnO中掺杂或共沉积稀土金属元素及其化合物时,可以有效改变ZnO的物理化学性质。所以,近年来稀土掺杂氧化锌的研究吸引了众多研究者。文献报道通过多种技术,如磁控溅射法[2-3]、热分解法[4]、喷射热解法[5-6]、脉冲激光沉积[7]、有机金属气相沉积(MOCVD)[8]、浸涂法[9]、溶胶-凝胶法[10-12],沉淀法[13],电沉积方法[14-19]等,已经成功合成了许多非金属元素或金属元素掺杂氧化锌薄膜。其中电沉积方法有其他方法无法比拟的优点,如低温、简便、快速,经济并可以通过改变电化学实验参数(沉积时间、沉积电位,溶液组成等)控制电沉积产物厚度、组成。但是,讨论界面微化学化境pH值对制备含量确定的混合金属氧化物的影响尚不多见。Mohamad小组[12]研究了溶胶-凝胶法合成氧化锌时静态pH值对氧化锌形貌及光学性质的影响。我们课题组在Zn-Er氧化膜的电沉积机理研究[17]时用IrO2微电极测量了电极/溶液界面的pH变化。张艳辉[20]等用电沉积方法研究了不同pH对Cu2O的光电薄膜的结构及光电性质的影响。
本文主要讨论了用所设计的四电极体系,现场测量锌铈混合氧化物薄膜电沉积过程电极/溶液界面pH的变化情况,用ICP技术分析电沉积所得到的薄膜中2种金属离子的物质的量比。通过热力学数据研究金属氧化物电化学沉积过程及电沉积机理。本实验关于界面微化学环境的研究工作对制备含量确定的混合金属氧化物薄膜具有指导意义。
1 实验部分
1.1 材料及仪器
硝酸锌(Zn(NO3)2·6H2O),分析纯,购买于国药集团化学试剂有限公司;硝酸铈(Ce(NO3)3·6H2O),分析纯,购买于国药集团化学试剂有限公司;硝酸(HNO3),分析纯,购买于洛阳昊华化学试剂有限公司;硝酸铈铵(NH4)2Ce(NO3)6,分析纯,购买于国药集团化学试剂有限公司;不锈钢网(每平方米400目,直径为1 cm),购买于中瑞金属网业有限公司;辅助电极是Pt片 (213型)购买于上海罗素科技有限公司;参比电极是饱和甘汞电极(217型),购买于上海精密科学仪器有限公司;平面pH复合电极(E-901),购买于上海越磁电子科技有限公司;酸度计(pH-211),购买于意大利HANNA公司;电化学工作站(CHI660C),购买于上海辰华仪器公司;X Pert Pro X射线衍射仪(Cu Kα,λ=0.154 056 nm),荷兰 Panalytical公司;电感耦合等离子体(ICP)AES-6000,Thermo scientific实验装置图如图1、2所示,四电极体系,即工作电极是不锈钢网,辅助电极是Pt片,参比电极是饱和甘汞电极,测量电极是平面pH复合电极。测量电极与工作电极组合后(图1),与酸度计连接(图2),原位测量电极/溶液界面的pH变化情况。所有实验都是在室温下进行,实验部分没有特殊说明,实验所用电沉积电位都是相对于饱和甘汞参比电极。


1.2 制备和表征
取100mL的由0.7437g Zn(NO3)2·6H2O,0.1086 g Ce(NO3)3·6H2O配成的0.01 mol·L-1锌、铈混合溶液,用0.1 mol·L-1硝酸调节到pH 3.5进行阴极恒电位电沉积实验。电沉积实验前,不锈钢网进行阴极极化,再在0.1mol·L-1的HNO3中浸泡10min后烘干。电沉积得到的薄膜氧化物反复用去离子水冲洗,室温下干燥12 h,用2mL浓硝酸溶解电沉积产物配成100mL的溶液待测,分别配制0.1、1、5、10、25、50mg·L-1的锌、铈的混合标准溶液进行ICP分析。分别用X射线衍射仪分析薄膜的晶体结构,电感耦合等离子体(ICP)技术分析薄膜的组成。
2 结果与讨论
2.1 XRD分析
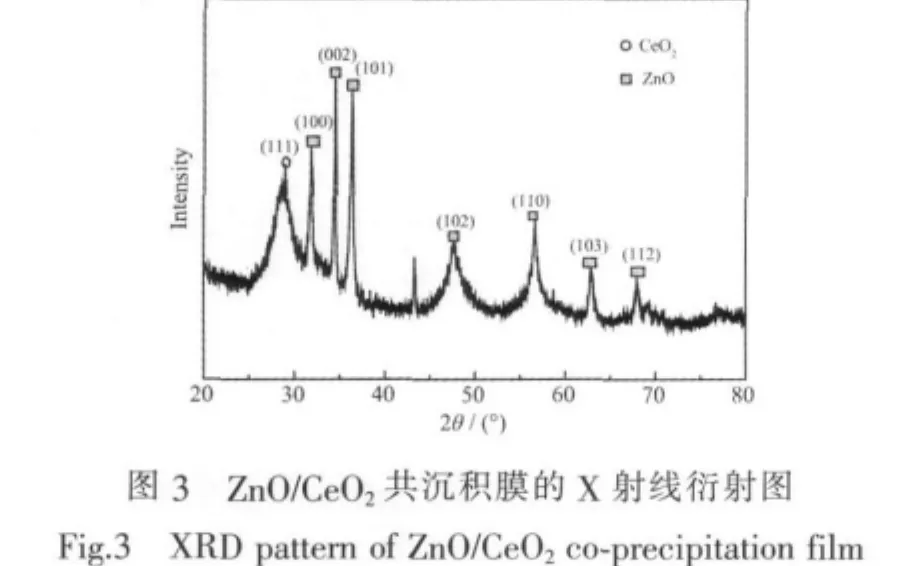
图3是恒电位(E=-1.35 V)电沉积得到的ZnO/ CeO2共沉积膜的X射线粉末衍射图。从图中可以看出沉积产物是由ZnO和CeO2两相组成的混合物氧化物。ZnO与标准卡(PDFNo.01-089-7102)一致,其中(002)面为主要衍射峰。图3中28.9°(2θ)峰对应的是CeO2(PDF No.01-004-0593)(111)面。图4是电沉积得到的纯ZnO薄膜的X射线粉末衍射图,纯ZnO薄膜与标准卡(PDF No.01-074-0534)一致,其中(101)面是主要衍射线峰。通过以上分析可知,由于铈离子的加入,氧化锌择优取向的晶面由(101)面变为(002)面。

2.2 电极/溶液界面pH的原位测量
电沉积时间为1800 s,不同电沉积电位时电极/溶液界面的pH-时间曲线,如图5所示。从图中可以看出所有的曲线都是快速上升后达到稳定。因为开始施加电位时只有OH-离子的生成,所以电极/溶液界面的pH值急剧上升;当OH-离子达到金属氢氧化物沉积浓度时开始消耗OH-离子,当OH-离子的生成和消耗速率相等时,电极/溶液界面的pH值达到动态平衡,所以电沉积过程是OH-离子生成和消耗的竞争过程。随着电沉积过电位越大,还原NO3-离子生成的OH-离子越多,从图中可以看出在电沉积电位分别为-1.00、-1.15、-1.20、-1.25、-1.30、-1.35、-1.40 V时,对应的平衡pH值分别为5.70、6.60、6.83、7.25、8.00、8.47、9.90,因此电沉积过电位越大电极/溶液界面的pH越高。

2.3 沉积物含量的分析
2.3.1 电极/溶液界面pH对电沉积产物组分的影响
在混合溶液中分别采用-1.00、-1.20、-1.25、-1.30、-1.35和-1.40 V的恒电位进行电化学沉积,电沉积时间为1800 s,将得到的锌铈混合氧化物进行ICP分析,结果如表1所示。从表中可知Ce(Ⅲ)/Zn(Ⅲ)的物质的量比,随着pH值的升高而增大。电沉积电位为-1.00 V时对应的pH为5.70,OH-的浓度低,没有达到两种金属氧化物沉积所需浓度,因此没有生成沉积物。电沉积电位分别为-1.20 V、-1.25 V、-1.30 V时对应的pH值为6.83、7.25、8.00,OH-的浓度达到了两种金属氧化物的沉积浓度,生成沉积物并且沉积产物中Ce(Ⅲ)/Zn(Ⅲ)的物质的量比分别为0.28、0.33、0.50,可知在pH 6.83~8.00的范围内,氧化锌的沉积趋势大于氧化铈的沉积趋势。电沉积电位为-1.35 V、-1.40 V对应的pH为8.47、9.90,电沉积产物中 Ce(Ⅲ)/Zn(Ⅲ)的物质的量比分别为 0.79、1.00,可以看出随着pH的增加氧化铈的沉积趋势逐渐增大,最后与氧化锌的沉积趋势一样大。证明了通过改变电极/溶液界面pH值可以有效的调节薄膜组成。
2.3.2 电沉积时间对沉积物含量的影响
表2是电沉积电位-1.35 V时,不同电沉积时间下电沉积产物的ICP分析。从表2可以看出Ce(Ⅲ)/Zn(Ⅲ)物质的量比随着沉积时间的增加而增大。因为随着电沉积时间变化,界面pH逐渐上升,界面微化学环境的变化引起了复合金属氧化物薄膜组成改变,所以再次证明了通过控制电极/溶液界面pH值可以有效地调节薄膜组成。

表1 不同pH值下ICP测量的Zn(Ⅲ)和Ce(Ⅲ)在固相中的物质的量比Table 1 Results of ICP analysis for deposited of Zn(Ⅲ)and Ce(Ⅲ)molar ratio at different pHs
2.4 电沉积的理论分析
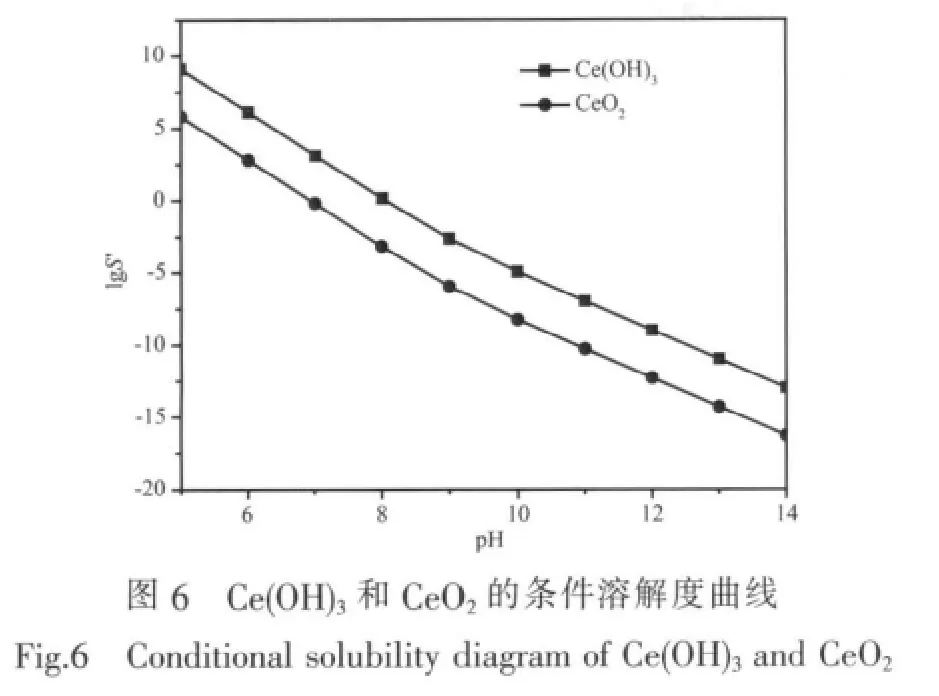
分析界面pH值与电沉积产物组分之间的相互关系,可以看出界面pH对电沉积产物的组成有重要的影响。通过Zn(Ⅲ)、Ce(Ⅲ)各种形态的热力数据(表3)计算溶液中ZnO、Ce(OH)3、CeO2的条件溶解度,更好的了解了电沉积过程中锌、铈氧化物共沉积膜的组成随界面pH变化的情况。条件溶解度S′是液相中离子各种形态浓度的总和,对于铈(Ⅲ)-羟基 配合物体系,溶液中存在的铈离子形态有Ce3+、 Ce (OH)2+、Ce2(OH)24+、Ce(OH)3等4种,则:表示溶液中可溶性Ce3+的总浓度表示溶液中Ce3+的自由浓度,β是铈配合物的累积稳定常数,Kw为室温下水的离子积常数,Ks是金属氧化物或氢氧化物的溶度积常数。


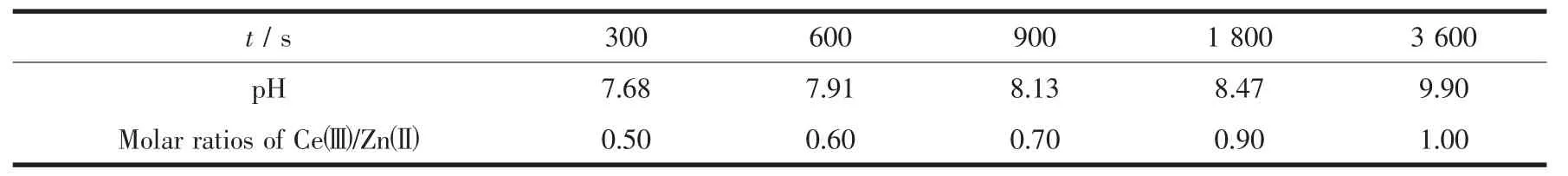
表2 ICP测量在不同时间时电沉积产物中Ce(Ⅲ)/Zn(Ⅲ)物质的量比E=-1.35 VTable 2 ICPmeasurements of deposited of Zn(Ⅲ)and Ce(Ⅲ)molar ratio at different times E=-1.35 V
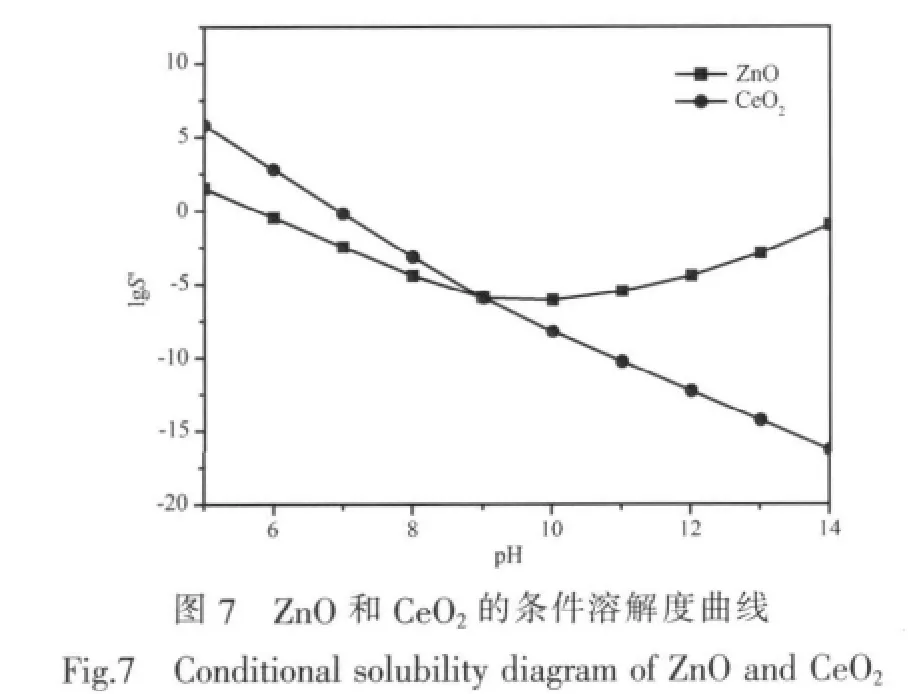
把表3给出的铈配合物的热力学数据代入公式(1)、(2)、(3)中可以计算得到溶液中氢氧化铈和氧化铈的条件溶解度随pH变化关系,同理,可计算出氧化锌的条件溶解度随pH的变化关系,如图6、7所示。
施加电位后,溶液中NO3-在工作电极表面得到电子被还原生成OH-离子,即:

由于OH-离子的生成,促使电极/溶液界面pH值局部急剧升高(对应于图2 pH-时间曲线的初期,pH值上升阶段),但是pH值上升到一定程度,即OH-离子达到金属氢氧化物或金属氧化物沉积所需浓度时,金属离子就与OH-离子结合形成氢氧化物或氧化物附着在工作电极表面即:

表3 热力学反应及累计稳定常数Table 3 Thermodynam ic reaction processes and stability constant of the comp lex
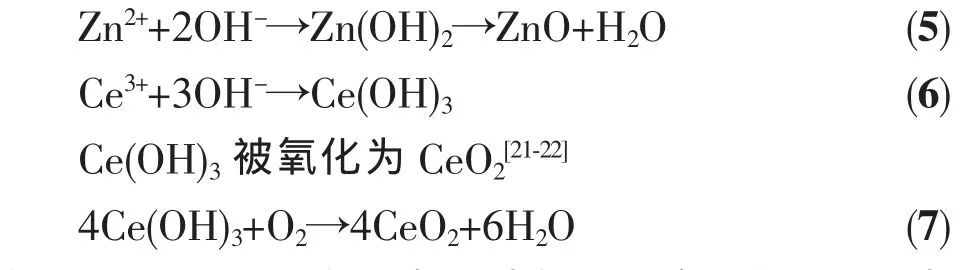
方程(5)、(6)、(7)是金属离子消耗OH-离子的过程,当方程(4)和方程(5)、(6)、(7)化学反应速率相等时,电极/溶液界面的OH-离子就达到动态平衡 (与图2 pH-时间曲线的后期,pH稳定阶段相对应)。
从图6中可以看出,在pH 6.00~14.00范围内CeO2的条件溶解度都比Ce(OH)3的低,所以在基底上最终得到固体CeO2的沉积,计算结果与XRD分析结果一致,电沉积产物由ZnO和CeO2组成。图7显示,在pH在6.00~8.00范围内ZnO的条件溶解度比CeO2低,也就是ZnO沉积的趋势比CeO2的大,印证了实验结果(在pH分别为6.83、7.25、8.00时对应的Ce(Ⅲ)/Zn(Ⅲ)物质的量比0.28、0.33、0.50)。在pH>8.00后明显看出CeO2沉积的趋势逐渐增大,特别是pH 9.00时CeO2的沉积趋势与ZnO的沉积趋势一样大,与实验结果一致 (当pH=8.13、8.47、9.90时,对应的Ce/Zn物质的量比0.70、0.90、1.00)。
3 结 论
采用自制四电极体系原位监测了Zn(Ⅲ)-Ce(Ⅲ)氧化物薄膜电化学沉积过程电极/溶液界面pH的动态变化情况。通过电解质溶液界面的pH-时间曲线,可知通过调节电沉积电位可以有效的控制电极/溶液界面pH值。通过XRD分析证明阴极电沉积法在不锈钢网上成功制备了ZnO/CeO2的共沉积膜,其中(002)面是主要衍射峰。结合在不同pH、不同电沉积时间下电沉积产物的ICP分析,可知随着电极/溶液界面pH值增加Ce(Ⅲ)/Zn(Ⅲ)的物质的量比值也逐渐增大,即随着pH的增大,Ce(Ⅲ)的沉积趋势越来越大,较好的验证了热力学理论分析。结合实验测试数据和理论计算结果,可知通过控制电极/溶液界面的pH值可以有效地调节电沉积产物组成;讨论了电极表面金属氧化物的电化学沉积机理,并阐明了液-固两相中金属离子存在形态的热力学性质决定了混合金属氧化物的组成。
[1]LIU Hai-Xia(刘海霞),HUANG Bai-Biao(黄柏标),WANG Ze-Yan(王泽岩),et al.Chinese J.Inorg.Chem.(Wuji Huaxue Xuebao),2011,27(4):752-758
[2]Lan W,Liu Y P,Zhang M,etal.J.Mater.Lett.,2007,61(11-12):2262-2265
[3]LIU Li(刘力),GUO Xiu-Zhi(郭秀芝),ZHAO Ting-Ting(赵婷婷).J.Jilin Univ.(Jilin Daxue Xuebao),2010,48(4):667-671
[4]Zeng X Y,Yuan JL,Zhang L D.J.Phys.Chem.C.,2008, 112:3503-3508
[5]Soania Z,Derkowsk B,Dalasinski P,et al.J.Opt.Commun., 2006,267:433-439
[6]ElJouad M,Alaoui LM,Soani Z,et al.J.Opt.Mater.,2009, 31:1357-1361
[7]Duclère JR,Doggett B,Henry M O,et al.J.Appl.Phys., 2007,101:013509(7pages)
[8]Torres-Huerta A M,Domínguez-Crespo M A,Brachetti-Sibaja SB,et al.J.Solid State Chem.,2010,183:2205-2217 [9]Ge C Q,Xie C S,Cai SZ.J.Mater.Sci.Eng,B,2007,137: 53-58
[10]de Lima J F,Martins R F,Neri C R.J.Appl.Surf.Sci., 2009,255:9006-9009
[11]Yang J H,Gao M,Yang L L,et al.J.Appl.Surf.Sci., 2008,255:2646-2650
[12]Alias S S,Ismail A B,Mohamad A A.J.Alloys Compd., 2010,499:231-237
[13]LIFen(李芬),YAN Bo(闫波),SHAO Chun-Hong(邵纯红). Chinese J.Inorg.Chem.(Wuji Huaxue Xuebao),2006,10 (22):1985-1898
[14]Li G R,Dawa C R,Lu X H,et al.J.Langmuir,2009,25: 2378-2384
[15]LiG R,Lu X H,Wen X,et al.J.Cryst.Growth Des.,2008, 8:1276-1281
[16]Li G R,Lu X H,Wang Z L,et al.J.Electrochim.Acta, 2010,55:3687-3693
[17]Zhang JM,Feng X M.J.Mater.Lett.,2008,62:3224-3227
[18]Goux A,PauportéT,Lincot D.J.Electrochim.Acta,2007, 53:50-58
[19]WANG Yan-Kun(王艳坤),ZHANG Jian-Min(张建民),LI Heng(李恒).J.Mater.Rev.(Cailiao Daobao),2010,24(9):91-103
[20]ZHANGYan-Hui(张艳辉),HAO Jin-Ling(郝金玲),LIUXiao -Feng(刘晓峰),et al.J.Guangzhou Chem.Indu.(Guangzhou Huagong),2011,39(7):41-43
[21]Hamdi S,Guerfi S,Siab R.J.Phys.Procedia.,2009,2:737-743
[22]Hamlaoui Y,Pedraza F,Remazeilles C.J.Mater.Chem. Phys.,2009,113:650-657
Electrochem ical Deposition of M ixed Zinc-Cerium Oxide Films
XU Sheng-Xia DING Fan LIU Yong-Zhao ZHANG Jian-Min*
(College of Chemistry and Molecular Engineering,Zhengzhou University,Zhengzhou 450001,China)
With a self-made four-electrode system,the pH changes at the electrode/solution interface were in-situ measured during the electrochemical deposition ofmixed zinc-cerium oxide films.It could be given from the pH-time curves at the electrode/solution interface that the interfacial pH fast increased at the electro-deposition initial stage,then achieved a balance value.The results indicated that the larger the electrodeposition overpotentialwas,the less it took to achieve a pH balance value aswell as the higher the pH balance valuewas.The electrodeposition films were composed of ZnO and CeO2characterized by X-ray diffraction (XRD)patterns,and the Ce(Ⅲ)/Zn(Ⅲ) molar ratio of deposits were determined using inductively coupled plasma-atomic emission spectroscopy (ICP-AES).The experimental results showed that the Ce(Ⅲ)/Zn(Ⅲ) molar ratio would increase with increasing both the interfacial pH and the electro-deposition time.The conditional solubilities of zinc and cerium ions as a function of pH values were calculated and plotted according to the thermodynamic constants for two metal ion species.Both the experimental data and the theoretical calculation results were used to discuss the reactionmechanism for electro-deposition ofmixed cerium-zinc oxides on the cathodic surface and elucidate that the composition ofmixedmetal oxideswould depend on the thermodynamic constants for twometal ion species.
cathodic electro-deposition;interfacial pH;zinc oxide;cerium oxide
O646
A
1001-4861(2012)09-1867-06
2011-12-22。收修改稿日期:2012-03-05。
国家自然科学基金(No.20873126)资助项目。
*通讯联系人。E-mail:zhjm@zzu.edu.cn,Tel:0371-67781539

