半乳糖化棕榈酰壳聚糖的分子量及取代度对载10-羟基喜树碱聚合物胶束包封率的影响
石春勤 莫晓丹 姜羽凤 胡巧红*
(广东药学院药剂系,广东 广州 510006)
聚合物胶束是由两亲性聚合物在选择性溶剂中形成的具有亲水性外壳及疏水内核的胶束体系。低临界胶束浓度及高度的热力学和动力学稳定性、长循环、增溶药物、缓释功能及靶向性[1]等特点决定了其作为新型药物传递系统的巨大优越性。
壳聚糖具有良好的生物可降解性、生物相容性、无免疫活性等特点,近年来被广泛用于靶向药物传递系统[2]。在壳聚糖分子上引入疏水长碳链及半乳糖基使之具有两亲性及主动靶向性[3-6],可作为主动靶向聚合物胶束的载体材料。通过酰化反应引入疏水碳链时,不同的棕榈酰氯/壳聚糖投料比将导致疏水碳链的取代度不同,进而影响胶束的形成及载药包封率。
本文以自制的不同壳聚糖分子量、不同棕榈酰基取代度的N-半乳糖化-O-棕榈酰壳聚糖为聚合物胶束载体材料制备载10-羟基喜树碱(10-HCPT)胶束,考察分子量及取代度对包封率的影响,以筛选出具有良好载药包封率的半乳糖化棕榈酰壳聚糖聚合物胶束材料。
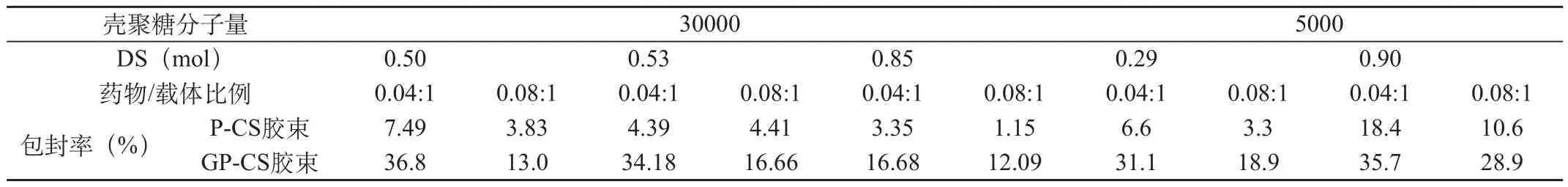
表1 不同分子量及取代度P-CS及GP-CS的载10-HCPT胶束包封率
1 仪器与试药
紫外分光光度计(日本岛津,UV1750);恒温磁力搅拌器(上海雷磁新径仪器厂,JB-2A),冷冻干燥机(北京四环科学仪器厂有限公司,LGJ-18A)
棕榈酰壳聚糖(P-CS)及半乳糖化棕榈酰壳聚糖(GP-CS)(自制,壳聚糖分子量为5千或3万);10-羟基喜树碱(成都兰贝植化科技有限公司);10-羟基喜树碱对照品(中国药品生物制品检定所,批号100526-200301);蒸馏水为重蒸水;其它试剂均为分析纯试剂。
2 方法与结果
2.1 10-HCPT载药胶束的制备
称取25mg P-CS粉末溶于20mL DMSO,得载体溶液,精密称取不同质量的10-HCPT溶于1mLDMSO中得药物溶液,将药物溶液缓慢滴入载体溶液中,装入透析袋(壳聚糖分子量为3万的P-CS:截留分子量为1.0×104;壳聚糖分子量为5千的P-CS:截留分子量为1000,),透析24h,制备载药P-CS胶束。
取一定体积的GP-CS反应液,加DMSO至10mL(相当于含GPCS25mg)作为载体溶液,精密称取不同质量的10-HCPT溶于1mL DMSO中得药物溶液,将药物溶液缓慢滴入载体溶液中,同上法在蒸馏水中透析24h,制备载药GP-CS胶束。
2.2 包封率的测定
2.3 紫外吸收波长的确定
10-HCPT溶于甲醇制得药物溶液,空白胶束用甲醇破乳,将药物溶液和空白胶束溶液分别在200~400nm进行扫描,以确定测定波长。结果表明,在266nm处,10-HCPT有最大吸收峰,而空白胶束在此波长处无吸收,因此,选择紫外检测波长为266 nm。
2.4 标准曲线的制备
精密称取4mg 10-HCPT对照品,用甲醇溶解并定容至100mL,摇匀,分别移取不同体积的该溶液于10mL容量瓶中,用甲醇定容后摇匀,得到不同浓度的溶液,在266nm处测定吸收度A值,以吸收度A对浓度C进行线性回归,得标准曲线方程为A=0.1284C-0.007(r2=0.999),表明10-HCPT在0.4~16μg/mL浓度范围内线性关系良好。
2.5 包封率的测定
取载药聚合物胶束悬液1mL,置于10mL棕色容量瓶中,甲醇定容破坏胶束并完全溶解药物,在266nm处测定吸收度A值,按下式计算包封率。见表1。

由表1可知,两种分子量的载体材料中,GP-CS载药胶束的包封率均高于P-CS载药胶束的包封率,可能是由于GP-CS中引入了亲水性的半乳糖基,增加了材料在DMSO中的溶解度。由各种P-CS和GP-CS胶束的包封率可知,药物/载体比例为0.04∶1时的包封率均高于0.08∶1,说明投药量越大包封率反而降低。可能是因为投药量越大,药物在透析过程中析出越多,使包封率越低。对于5千分子量壳聚糖的P-CS及GP-CS,棕榈酰基取代度高的材料所得的胶束包封率较高,尤其是棕榈酰基取代度高的GP-CS的胶束,包封率可达35.7%。可能是由于低取代的载体材料中接入的疏水基团太少,影响胶束的形成。对于3万分子量壳聚糖的P-CS及GP-CS,棕榈酰基取代度越大,包封率反而越低。可能是因为取代度高的材料中接入的疏水链太多,材料在DMSO中溶解性能不佳导致。其中取代度较低(0.5mol)的GP-CS胶束的包封率较高,可达36.8%。比较两种分子量壳聚糖所得P-CS、GP-CS载药胶束的包封率可知,疏水链取代度相近时(DS=0.85mol与DS=0.9mol),低分子量(5千)胶束的包封率明显高于高分子量(3万);而在低分子量(5千)、疏水链取代度很低的情况下(DS=0.29mol),包封率已接近高分子量疏水链取代度较高(DS=0.5mol)时的水平。
3 讨 论
研究可知,各种壳聚糖衍生物制备的胶束具有不同的包封率,范围在3.3%~36.8%。包封率的差异受壳聚糖分子量、疏水链取代度及药物/载体比例的影响较大,因此,适于作为胶束材料的GP-CS所需要的各种参数(壳聚糖分子量、疏水链取代度及药物/载体比例等)亦不相同。30Q-0.5-GP-CS及5Q-0.9-GP-CS两种材料由于疏水链的取代度合适,不仅极性与DMSO较为相似,溶解性能较好,而且具有适宜的疏水链段数目,有利于自组装形成胶束,得到较高包封率的聚合物胶束。不同分子量壳聚糖的GP-CS载药胶束要求的药物/载体比例不同,药物/载体比例太小则包封率低,太大会导致透析过程中药物析出,包封率较低,因此适宜的药物/载体比例可提高包封率。
[1]Zhang XJ,Wang DK,Han X.Progress of polymeric micelles as drug delivery carriers [J].Chin J Pharmaceutics,2009,7(3):177-183.
[2]Huang W,Wang P,Wang W,et al.Preparation of glycyrrhetinic acid-modified PEG-PLGA nanoparticles and the affinity ealuation on hepatoma cells[J].Chem J Chin Univ,2011,32(2):416-420.
[3]Kim TH,Park IK,Nah JW,et al.Galactosylated chitosan/DNA nanoparticles prepared using water-soluble chitosan as a gene carrier [J].Biomaterials,2004,25 (17): 3783–3792.
[4]Feng ZQ,Chu XH,Huang NP,et al.The effect of nanofibrous galactosylated chitosan scaffolds on the formation of rat primary hepatocyte aggregates and the maintenance of liver function [J].Biomaterials,2009,30(14): 2753–2763.
[5]Wu DQ,Lu B,Chang C,et al.Galactosylated fluorescent labeled micelles as a liver targeting drug carrier[J].Biomaterials,2009,30(7):1363–1371.
[6]Yang W,Mou T,Zhang X,et al.Synthesis and biological evaluation of 99mTc-DMP-NGA as a novel hepatic asialoglycoprotein receptor imaging agent[J].Appl Radiat Isot,2010,68(1): 105-109.

