泛素-蛋白酶体抑制剂MG132对糖尿病大鼠视网膜上Smad7表达的影响
苟文军 刘思源 覃 冬
泛素-蛋白酶体途径(ubiquitin-proteasome pathway,UPP)是细胞内蛋白质选择性降解的重要途径。在真核生物中,绝大多数蛋白质是通过UPP进行降解的[1]。Smad7是 TGF-β/Smad信号转导通路中的重要转导分子,主要受UPP的降解调节。因此,本实验通过观察泛素-蛋白酶体抑制剂MG132对链-脲佐菌素(streptozotocin,STZ)诱导的糖尿病(diabetes mellitus,DM)大鼠模型视网膜上Smad7表达的影响,探讨Smad7的表达与糖尿病视网膜病变(diabetic retinopathy,DR)之间的关系,从而为DR发病机制的研究与DR的防治提供新的研究方向。
1 材料与方法
1.1 材料
1.1.1 实验动物与分组 取健康的雄性Wistar大鼠60只,体质量180~200 g,SPF级,购自重庆腾鑫生物技术有限公司。将Wistar大鼠适应性喂养7 d,应用随机数字表法将动物随机分为3组:正常对照组、DM+MG132组和DM组,每组大鼠各20只。
1.1.2 主要试剂与仪器 STZ(美国 Sigma公司)、MG132(美国Sigma公司)、兔抗大鼠Smad7单克隆抗体(北京中杉公司)、DAB显色试剂盒(北京中杉公司)、Accu-CHEK型血糖仪及其配套血糖试纸(瑞士罗氏公司);眼科显微剪、显微镊,前房穿刺刀(美国Alcon公司)。
1.2 实验方法
1.2.1 动物模型建立与标本制作 临用前将STZ溶解于0.1 mmol·L-1柠檬酸三钠-柠檬酸缓冲液中(pH 4.5),制成10 g·L-1STZ 液。建模前将 60 只Wistar大鼠禁食12 h(禁食不禁饮),DM组与DM+MG132组一次性腹腔注射50 mg·kg-1STZ液,正常对照组一次性给予等体积的柠檬酸三钠-柠檬酸缓冲液腹腔注射。72 h后尾静脉测血糖,空腹血糖≥16.7 mmol·L-1者视为造模成功。自DM模型建立后第3天起,DM+MG132组每天给予MG132 DMSO液(0.1 mg·kg-1)腹腔注射,DM 组和正常对照组每天给予0.1 mg·kg-1DMSO液腹腔注射。每隔两周测一次血糖及体质量,分别于造模后8周和12周时测血糖和体质量后并处死各组大鼠。完整取出大鼠的左右眼球,并制成眼杯[2]。再将眼杯置于同一瓶中,取出眼杯后依次梯度酒精脱水,二甲苯透明,石蜡包埋供免疫组织化学使用。
1.2.2 免疫组织化学染色 石蜡切片常规脱蜡至水,0.1 mmol·L-1PBS 冲洗 5 min,用 0.1 mmol·L-1枸橼酸缓冲液(pH=0.6)微波抗原修复(98℃,20 min),自然冷却至室温,0.1 mmol·L-1PBS(pH=7.4)缓冲液冲洗5 min,滴加正常山羊血清(0.1 mmol·L-1PBS缓冲液稀释)封闭游离的结合位点,减少非特异性染色,分别滴加1∶20稀释的Smad7单克隆一抗,正常对照组用PBS代替一抗,4℃过夜。0.1 mmol·L-1PBS 冲洗 5 min,滴加生物素标记的二抗 IgG,37 ℃孵育15 min,0.1 mmol·L-1PBS冲洗5 min,滴加辣根酶标记链霉卵白素工作液,37℃孵育15 min,0.1 mmol·L-1PBS 冲洗,DAB 显色,自来水冲洗,苏木素复染后封片。胞核或胞浆被染成棕黄色或棕褐色为阳性细胞,在高倍镜下(400倍)每张切片随机拍摄3~5个视野,用Image-Pro Plus 6.0彩色图像分析系统对图像中阳性反应部位进行分析。用棕黄色或棕褐色阳性颗粒的平均光密度(optical density,OD)值表示Smad7的表达。
1.3 统计学处理 采用SPSS 13.0软件分析系统对所得数据进行统计分析。各指标采用均数±标准差(±s)表示。组间均数比较采用单因素方差分析,组间的多重比较采用q检验(Student-Newman-Keuls)法,以P<0.05为差异有统计学意义。
2 结果
光学显微镜观察发现,正常对照组大鼠视网膜上Smad7高表达(图1);在造模后8周和12周时,DM组大鼠视网膜上Smad7的表达较正常对照组明显减少,差异有统计学意义(均为P<0.01)(图2);DM+MG132组大鼠视网膜上Smad7的表达亦低于正常对照组,差异有统计学意义(均为P<0.01);而DM+MG132组造模后8周和12周时大鼠视网膜上Smad7的表达较DM组明显增多(图3),差异有统计学意义(均为 P <0.01,见表1)。

Figure 1 Smad7 expression in rat retina of normal control group under light microscope(SP staining,×400).There were lots of Smad7 expressions in rat retina 光镜下观察正常对照组大鼠视网膜上Smad7的表达(SP染色,×400)。正常对照组大鼠视网膜上见大量Smad7的表达
3 讨论
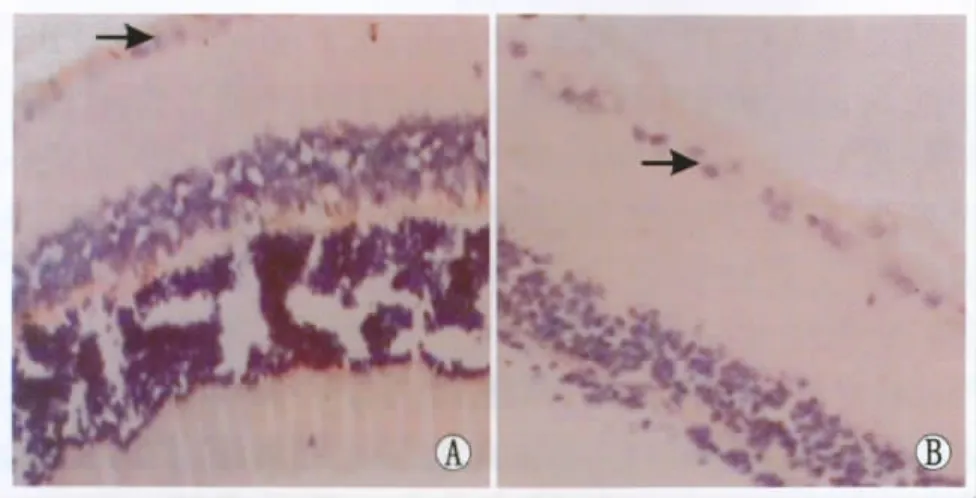
Figure 2 Smad7 expressions in rat retina of DM group at 8 weeks and 12 weeks under light microscope(SP staining,×400).A:At 8 weeks,Smad7 expression in rat retina in DM group was lower that in normal control group(black arrow);B:At 12 weeks,Smad7 expression was lower significantly in rat retina in DM group(black arrow)光镜下观察造模后8周和12周时DM组大鼠视网膜上Smad7的表达(SP染色,×400)。A:在造模后8周时,大鼠视网膜上Smad7的阳性表达较正常对照组降低(黑箭头);B:在造模后12周时,大鼠视网膜上Smad7的表达降低更明显(黑箭头)
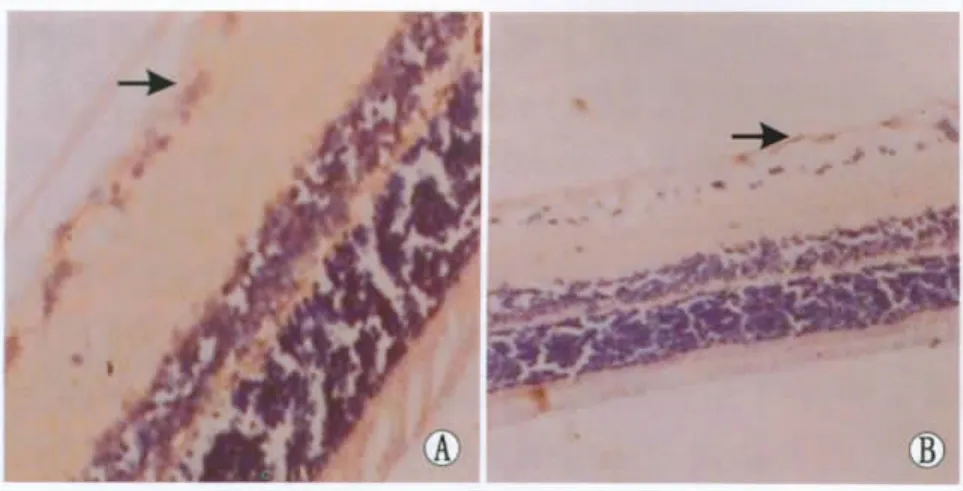
Figure 3 Smad7 expressions in rat retina of DM+MG132 group at 8 weeks and 12 weeks under light microscope(SP staining,×400).A:At 8 weeks,Smad7 expression was increased in rat retina in DM+MG132 group compared with DM group(black arrow);B:At 12 weeks,Smad7 expression was obviously increased in rat retina in DM+MG132 group compared with DM group(black arrow) 光镜下观察造模后8周和12周时DM+MG132组大鼠视网膜上Smad7的表达(SP染色,×400)。A:在造模后8周时,大鼠视网膜上Smad7的表达较DM组增多(黑箭头);B:在造模后12周时,大鼠视网膜上Smad7的表达较DM组明显增多(黑箭头)
表1 3组大鼠视网膜上Smad7的OD值比较Table 1 Comparison of OD value of Smad7 in rat retina among three groups(±s)

表1 3组大鼠视网膜上Smad7的OD值比较Table 1 Comparison of OD value of Smad7 in rat retina among three groups(±s)
Note:*P <0.01 compared with normal control group;△P <0.01 compared with DM group at time point of 8 weeks and 12 weeks
Group n OD value of Smad7 8 weeks 12 weeks Control 20 0.879 3 ±0.001 5 0.960 5 ±0.002 1 DM 20 0.340 8 ±0.000 7* 0.119 3 ±0.002 8*DM+MG132 20 0.486 4 ±0.001 5*△ 0.590 4 ±0.012 2*△F 1617 2347 P <0.01 <0.01
DR是糖尿病最常见的微血管并发症之一,其主要的特征是视网膜微血管的闭塞和渗出,最终可导致视网膜新生血管的形成和失明。由于DR的发病机制错综复杂,目前关于DR代谢通路的研究仍不清楚。DR被认为是一个微弱的炎症反应过程正日益受到重视[3]。近年来,有研究表明,细胞增殖调控的失常在DR发生发展过程中也发挥着重要作用[4]。而细胞因子则贯穿于细胞生长增殖的全过程,介导一系列的炎症反应和免疫反应,参与DR的发生发展。同时UPP能够高效、高选择性地对细胞内蛋白进行降解,广泛参与包括细胞生长、分化与凋亡、细胞分泌与吞噬、信号转导、转录调控、抗原递呈及免疫应答等多种活动过程,也参与了DR的发生与发展。Adachi-Uehara等[5]通过观察发现,在 DM大鼠和DR患者中氧化磷酸化相关基因表达增加,同时UPP中泛素表达增加,说明在DR发生时存在蛋白转录后的调节异常。
TGF-β作为诸多细胞因子中的一种,具有调控基因表达、细胞增殖与分化、凋亡及使细胞外基质(extracellular matrix,ECM)沉积的作用[6],参与 DR的发生发展过程。Smad蛋白是TGF-β下游信号的重要转导分子,在TGF-β/Smad信号转导通路中发挥着重要作用。TGF-β与其受体结合后,可激活受体型Smad(R-Smad)即Smad2和Smad3,进而与共同通路型Smad(Co-Smad)形成三聚体转位到核内,上调一些与ECM合成相关基因的表达,从而引起ECM的沉积。糖尿病时的高血糖、糖基化终末产物和血管紧张素Ⅱ是TGF-β/Smad信号转导系统的主要刺激因子[7]。而抑制型Smad(I-Smad)即 Smad7可抑制TGF-β激活的R-Smad磷酸化,从而对TGF-β信号转导通路起负反馈抑制作用,降低TGF-β信号的强度和持续时间。因此,Smad7是调节TGF-β信号转导的关键分子蛋白。Papetti等[8]研究发现,Smad2在糖尿病患者视网膜新生血管形成中发挥重要作用。Saika等[9]在基因敲除Smad3的小鼠眼中未检测到纤维连接蛋白和胶原蛋白Ⅵ的表达,说明Smad3可能参与了增生性玻璃体视网膜病变(proliferative vitreoretinopathy,PVR)的形成。Saika 等[10]在PVR小鼠模型体内发现,在Smad7过表达的小鼠视网膜色素上皮细胞中,其α-SMA和Ⅰ型胶原均较对照组降低。表明Smad2/3是主要的致纤维化因子,而Smad7是主要的抗纤维化因子,可能在PVR的形成过程中具有保护作用。在本实验中,我们通过观察不同时间点各组大鼠视网膜上Smad7的表达,结果发现在正常对照组大鼠视网膜上见大量Smad7的表达,而在造模后8周和12周时,DM组与DM+MG132组大鼠视网膜上Smad7的表达较正常对照组明显减少,且随着病程的进展,Smad7的减少逐渐增多。说明Smad7对DM大鼠视网膜具有保护作用。
泛素-蛋白酶体抑制剂MG132能够选择性地阻断UPP。Meiners等[11]使用蛋白酶体抑制剂MG132注射治疗自发性高血压模型大鼠研究发现:MG132可通过抑制NF-κB活化,减少胶原的表达、减轻心肌纤维化。吴燕等[12]研究发现蛋白酶体抑制剂MG132可抑制DR大鼠视网膜神经节细胞的凋亡。为进一步探讨泛素-蛋白酶体抑制剂MG132对DR的保护作用,本实验应用MG132对DM大鼠模型进行干预发现,在造模后4周和8周时,DM+MG132组大鼠视网膜上Smad7的表达较DM组明显升高。综上研究表明,MG132能够通过抑制Smad7的表达从而对DM大鼠视网膜产生保护作用。
1 Voorhees PM,Dees EC,O’Neil B,Orlowski RZ.The proteasome as a target for cancer therapy[J].Clin Cancer Res,2003,9(17):6316-6325.
2 吕红彬,袁援生,李 燕,李 俊.鼠青光眼模型视网膜神经节细胞中热休克蛋白27表达的研究[J].中华眼科杂志,2005,41(6):533-539.
3 Kern TS.Contributions of inflammatory processes to the development of the early stages of diabetic retinopathy[J].Exp Diabetes Res,2007,2007:95103.
4 Hammes HP.Pericytes and the pathogenesis of diabetic retinopathy[J].Horm Metab Res,2005,37(Suppl 1):39-43.
5 Adachi-Uehara N,Kato M,Nimura Y,Seki N,Ishihara A,Matsumoto E,et al.Up-regulation of genes for oxidative phosphorylation and protein turnover in diabetic mouse retina[J].Exp Eye Res,2006,83(4):849-857.
6 Massagué J,Chen YG.Controlling TGF-beta signaling[J].Genes Dev,2000,14(6):627-644.
7 Reeves WB,Andreoli TE.Transforming growth factor beta contributes to progressive diabetic nephropathy[J].Proc Natl Acad Sci U S A,2000,97(14):7667-7669.
8 Papetti M,Shujath J,Riley KN,Herman IM.FGF-2 antagonizes the TGF-beta1-mediated induction of pericyte alpha-smooth muscle actin expression:a role for myf-5 and Smad-mediated signaling pathways[J].Invest Ophthalmol Vis Sci,2003,44(11):4994-5005.
9 Saika S,Kono-Saika S,Tanaka T,Yamanaka O,Ohnishi Y,Sato M ,et al.Smad3 is required for dedifferentiation of retinal pigment epithelium following retinal detachment in mice[J].Lab Invest,2004,84(10):1245-1258.
10 Saika S,Yamanaka O,Nishikawa-Ishida I,Kitano A,Flanders KC,Okada Y,et al.Effect of Smad7 gene overexpression on transforming growth factor beta-induced retinal pigment fibrosis in a proliferative vitreoretinopathy mouse model[J].Arch Ophthalmol,2007,125(5):647-654.
11 Meiners S,Hocher B,Weller A,Laule M,Stangl V,Guenther C,et al.Down regulation of matrix metalloproteinases and collagens and suppression of cardiac fibrosis by inhibition of the proteasome[J].Hypertension,2004,44(5):471-477.
12 吴 燕,吕红彬,蒋 玲,廖洪霞.蛋白酶体抑制剂对糖尿病大鼠视网膜病变激活核转录因子-κB信号通路及视网膜神经节细胞凋亡的作用[J].中华眼底病杂志,2010,26(2):165-168.

