鸡传染性贫血病毒VP1基因的原核表达
冯 昕,荣 俊 (长江大学生命科学学院,湖北 荆州 434025)
匡红艳 (长江大学临床医学院,湖北 荆州 434000)
鸡传染性贫血病毒VP1基因的原核表达
冯 昕,荣 俊 (长江大学生命科学学院,湖北 荆州 434025)
匡红艳 (长江大学临床医学院,湖北 荆州 434000)
根据GenBank上公布的鸡传染性贫血病毒VP1的基因序列设计一系列引物,通过基因扩增得到了鸡传染性贫血病毒(CAV)VP1基因的全长片段和一系列不同N末端截断的VP1基因片段,分别将这些片段插入表达质粒载体pET28a的多克隆位点上,构建成4种重组表达工程菌(E.coliBL21/pET-28-CAVVP1、E.coliBL21/pET-28-CAVVP1Nd29、E.coliBL21/pET-28-CAV VP1Nd56、E.coliBL21/pET-28-CAV VP1Nd137),研究了4种不同长度VP1片段在重组大肠杆菌中的表达, 并通过SDS-PAGE电泳筛选最佳表达方式。结果表明:E.coliBL21/pET-28-CAVVP1Nd29能表达分子质量为44ku的可溶性蛋白,E.coliBL21/pET-28-CAV VP1Nd56能表达分子质量为40ku的不可溶性蛋白,而在E.coliBL21/pET-28-CAV VP1 和E.coliBL21/pET-28-CAV VP1Nd137的诱导表达产物中未见明显的表达蛋白出现。其中可溶性的CAV VP1Nd29蛋白将有可能用于研制CAV诊断抗原和亚单位疫苗研究。
鸡传染性贫血;抗原蛋白;原核表达
鸡传染性贫血病毒(Chicken anemia virus,CAV)是鸡传染性贫血病(Chicken infectious anemia,CIA)的主要病原,主要侵害雏鸡,造成以鸡群死亡率升高、再生障碍性贫血、骨髓黄化、胸腺等淋巴器官萎缩为特征的免疫抑制性传染病[1-2]。CAV 在鸡群中广泛存在,可水平传播和垂直传播。成鸡感染 CAV 后呈亚临床带毒状态,易被忽视,是养鸡业上潜藏的巨大威胁。自1979年在日本首次分离到CAV[3]以来,包括我国在内的许多国家[4-5]都相继证明了该病毒的存在。目前,CAV在世界范围内已呈蔓延趋势,成为危害家禽业的主要病原体之一,已引起世界各国禽业的广泛关注。
CAV属圆环病毒科环状病毒属,是已知的最小病毒之一,全基因组大小为2319bp,包括3个部分或完全重叠的开放阅读框(ORF),大小分别为1347、648 和363 个核苷酸残基,其中648nt的ORF完全重叠,与1347nt 的ORF部分重叠[6]。3个ORF分别编码52ku的衣壳蛋白VP1;24ku的分子伴侣VP2;14ku的细胞凋亡素VP3。VP1为CAV唯一的衣壳蛋白和主要免疫原蛋白,VP2为非结构蛋白,VP3为病毒的致病性蛋白,以凋亡的方式引起感染细胞的死亡[7]。Noteborn等[8]在昆虫细胞中分别表达VP1、VP2或共表达VP1和VP2蛋白,发现单独表达VP1或VP2均不能刺激鸡产生CAV特异性抗体,而VP1和VP2共同表达产物则可诱导产生中和抗体。这表明被表达的重组VP1、VP2蛋白可以被用作一种亚单位疫苗。
为研究适用于亚单位疫苗用的CAV 原核表达抗原蛋白,本研究对CAV VP1的N端基因序列进行不同程度的剪切,并与pET-28a载体连接,构建成VP1基因的不同表达载体,实现不同长度CAV VP1片段的的表达,并比较不同VP1基因片段表达产物的差异,筛选出合适的蛋白表达方式,为VP1病毒的检测用抗原蛋白和亚单位疫苗的研究奠定基础。
1 材料与方法
1.1 CAV毒株与菌株
CAV毒株由中国兽医药品监察所提供,大肠杆菌DH5α、BL21购自全式金生物技术有限公司,pMD-18T载体购自大连宝生物公司,EcoRⅠ、XhoⅠ购自大连宝生物公司。
1.2 引物设计
根据Hiremath等在GenBank公布的VP1序列设计引物。引物序列详见表1。其中5’-端有下划线的部分是附加的酶切位点,上游引物为EcoRⅠ,下游引物为XhoⅠ。所有引物由三博远志生物技术公司合成。

表1 CAV VP1基因N端剪切系列引物序列
1.3 VP1基因的PCR扩增
以CAV种毒培养液为模板,使用上述引物扩增VP1全序列以及VP1Nd29、 VP1Nd56、VP1Nd137片段。反应体系为毎管10倍PCR buffer 2μl,dNTP 0.2μl,上下游引物各1μl,模板2μl,Taq酶0.2μl,用ddH2O补体积至20μl。热循环参数为:94℃ 5min;94℃ 30s,64℃ 30s,72℃ 1min30s,35个循环;72℃ 10min,4℃ 2min终止。取PCR产物10μl琼脂糖凝胶电泳观察结果。
1.4 扩增产物的克隆载体构建
将PCR产物经琼脂糖凝胶电泳后,于紫外灯下切下目的条带,用DNA片段凝胶回收试剂盒纯化目的片段。纯化后的目的片段同pMD18-T载体连接,连接体系:5倍连接酶buffer 2μl,PCR回收产物6.5μl,pMD-18T载体0.5μl,连接酶1μl,16℃连接过夜。用连接产物转化DH5α大肠杆菌,涂布于加有氨苄青霉素的LB平板上,37℃培养过夜。挑取单个菌落接入含氨苄青霉素的液体LB培养基中震荡培养,取菌液以上述体系进行PCR扩增鉴定,选取结果为阳性转化菌的提取质粒,分别命名为:pMD-CAV VP1、pMD-CAV VP1Nd29、pMD-CAV VP1Nd56和pMD-CAV VP1Nd137。
1.5 表达载体的构建
将回收质粒的pMD-CAV VP1、pMD-CAV VP1Nd29、pMD-CAV VP1Nd56和pMD-CAV VP1Nd137,连同表达质粒载体pET-28a分别用EcoRⅠ+XhoⅠ双酶切。目的片段用琼脂糖凝胶电泳回收,使用T4连接酶连接目的片段与线性化的质粒载体pET-28a,用连接产物转化DH5α大肠杆菌,涂布于含卡那霉素的LB平板上培养。挑取单个菌落按1.3所述方法进行PCR扩增鉴定,阳性的即为重组表达质粒。分别命名为:pET-28-CAV VP1、pET-28-CAV VP1Nd29、pET-28-CAV VP1Nd56和pET-28-CAV VP1Nd137。
1.6 目的基因的表达
将上述重组质粒分别转化大肠杆菌BL21感受态细胞。其转化菌分别命名为:E.coliBL21/pET-28-CAV VP1,E.coliBL21/pET-28-CAV VP1Nd29、E.coliBL21/pET-28-CAV VP1Nd56和E.coliBL21/pET-28-CAV VP1Nd137。分别挑取单菌落接入含卡那霉素的LB培养基中,37℃培养过夜。按1∶100接菌到含卡那霉素的30ml的LB培养基中,37℃培养至光密度值达到0.6时,加入浓度为0.2mol/L的乳糖3ml,分别在25℃诱导表达过夜[9],和37℃中诱导5h后收集菌体,用0.02mol/L pH7.4的Na2HPO4-NaH2PO4缓冲液悬浮菌体并用超声波破碎,分别收集破碎后的上清液和沉淀。
1.7 表达蛋白的分析
将收集到的上清和沉淀分别进行SDS-PAGE电泳,检测重组表达蛋白的情况并比较全序列与几种不同剪切方式表达蛋白可溶性的差异。
2 结果与分析
2.1 CAV VP1基因片段的扩增
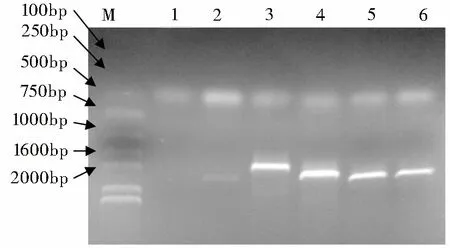
M:DNA Marker;1:空白对照;2:CAV VP1全基因;3:CAV VP1Nd137;4:CAV VP1Nd56;5:CAV VP1Nd29;6:CAV VP1全基因
PCR产物经琼脂糖凝胶电泳分析,发现在1350、1263、 1182、939bp处有DNA扩增带(图1),大小与预期相同。

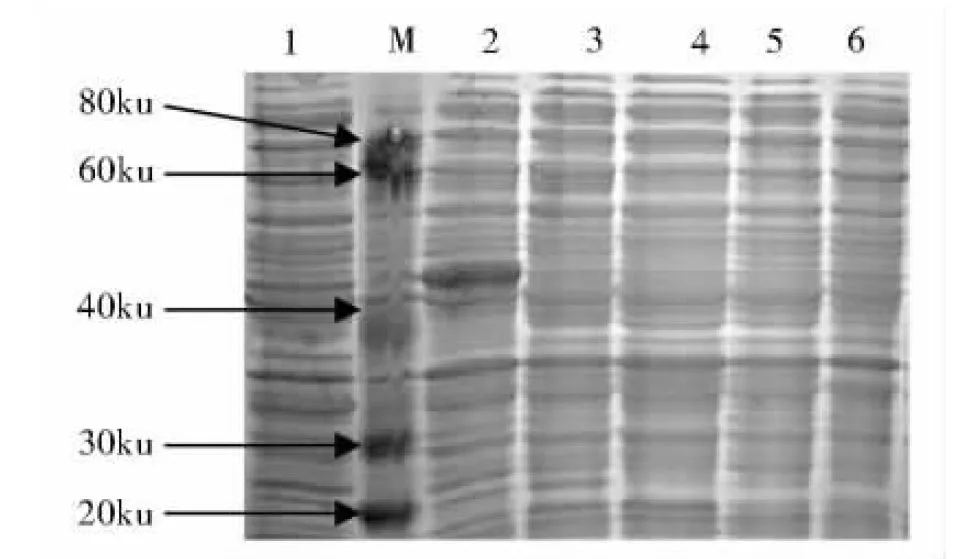
M:蛋白质分子质量标准;1:空白表达菌全菌对照;2:E.coli BL21/pET-28-CAV VP1全菌;3:E.coli BL21/pET-28-CAV VP1Nd29全菌;4:E.coli BL21/pET-28-CAV VP1Nd56全菌;5~6:E.coli BL21/pET-28-CAV VP1Nd137全菌;7:E.coli BL21/pET-28-CAV VP1Nd29上清
2.2 VP1重组表达质粒的鉴定
对重组表达质粒pET-28-CAV VP1、pET-28-CAV VP1Nd29、pET-28-CAV VP1Nd56和pET-28-CAV VP1Nd137进行PCR扩增鉴定,结果与图1一致,表明目的片段已经成功克隆到了表达载体上。
2.3 重组表达载体的诱导表达
将含有各组表达载体的阳性菌经乳糖诱导表达,经SDS-PAGE电泳分析发现E.coliBL21/pET-28-CAV VP1Nd29、E.coliBL21/pET-28-CAV VP1Nd56经诱导后有明显表达带出现,前者分子质量在44ku附近,后者分子质量在40ku附近。而E.coliBL21/pET-28-CAV VP1和E.coliBL21/pET-28-CAV VP1Nd137无明显表达(图2)。
2.4 表达蛋白的溶解特性
将表达菌超声波裂解后,分别取上清液和沉淀进行电泳,发现E.coliBL21/pET-28-CAV VP1Nd29表达片段在上清液中非常明显,E.coliBL21/pET-28-CAV VP1Nd56重组蛋白绝大部分以沉淀形式存在,上清中含量很少(图3、图4)。
3 讨论
本研究尝试将VP1片段以正确的方式插入pET-28a载体中,构建的表达菌E.coliBL21/pET-28-CAV VP1未能获得明显的表达。而将VP1片段进行不同方式的裁剪后构建的E.coliBL21/pET-28-CAV VP1Nd29和E.coliBL21/pET-28-CAV VP1Nd56经诱导后有明显表达带出现,E.coliBL21/pET-28-CAV VP1Nd137无明显表达。在2个能有明显表达的工程菌中E.coliBL21/pET-28-CAV VP1Nd29的表达产物至少有半数是可溶的蛋白质,而E.coliBL21/pET-28-CAV VP1Nd56的表达产物几乎全不可溶。
目前国内尚无标准的CAV ELISA诊断试剂盒,给CAV引起的疾病的调查和诊断带来诸多不便。与全毒抗原相比,原核表达的重组蛋白作为抗原可以克服CAV在体外培养效率低,难以获得大量诊断用抗原的缺点,而且重组抗原成分相对单一,免疫反应的特异性会更强。另一方面,目前对于CAV的防治尚无理想的疫苗,国内外研制出的活疫苗和灭活疫苗虽已用于免疫接种,但均存在病毒体外培养困难和价格高昂的缺陷[10]。目前尚未分离到非致病性的毒株,因此所用的活疫苗株都为弱致病性的毒株,免疫后持续感染,蛋源传播和毒力增强的风险都很大。本研究探讨了利用原核表达系统表达CAV抗原蛋白的方法,以E.coliBL21/pET-28-CAV VP1Nd29表达菌最优,实现了体外大量表达,且有相当部分可溶。这为进一步研究CAV的致病机制和研制CAV重组诊断抗原、亚单位疫苗奠定了基础。
M: 蛋白质分子质量标准;1:空白表达菌上清对照;2:E. coli BL21/pET-28-CAV VP1Nd29 表达上清; 3:E. coli BL21/pET-28-CAV VP1Nd56 表达上清; 4 ~ 5: E. coli BL21/pET-28-CAVVP1Nd137 表达上清; 6: E.coli BL21/pET-28-CAV VP1 表达上清
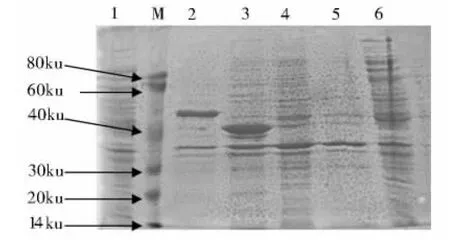
M: 蛋白质分子质量标准; 1: 空白表达菌沉淀对照; 2:E. coliBL21/pET-28-CAV VP1Nd29 表达沉淀部分; 3:E. coli BL21/pET-28-CAV VP1Nd56 表达沉淀部分; 4 ~5:E. coli BL21/pET-28-CAVVP1Nd137 表达沉淀部分; 6: E. coli BL21/pET-28-CAV VP1 表达沉淀部分
[1]Bounous D I,Goodwin M A,Brooks R L,et al.Immunosuppression and intracellular calcium signaling in splenocytes from chicks infected with chicken anemia virus,CL21 isolate[J].Avian Dis,1995,39:135-140.
[2]Dehead T P,Van Den Bosch G,Ducatell E R,et al. Epidemiology and significance of chicken infectious anemia virus infections in broilers and broiler parents under nonvaccinated European circumstances[J].Avian Dis,2001,45 :706-708.
[3]Yuasa N T,Taniguchi,Yoshida I.Isolation and some characteristics of agent inducing anemia in chicks[J].Avian Dis,1979,23:366-385.
[4]金文杰,崔治中,刘岳龙,等.传染性法式囊病料中 MDV、CAV、REV 的共感染检测[J].中国兽医学报,2001,21(1):6-8.
[5]段玉友,肖雪君,潘志明,等.用 digoxi-genin 标记 DNA 探针检测鸡贫血病病毒感染[J].中国畜禽传染病,1997,(1):16-17.
[6]鄢明华,刘长军,王英珍,李秀丽.鸡传染性贫血病毒分子生物学研究进展[J].天津农业科学,2002,8(3):48-50.
[7]王 娟,张维军,刘桂林.鸡传染性贫血病毒分子生物学研究进展[J].兽医研究,2006,(2),12:8-11.
[8]Noteborn M H,Verchueren C A,Koch G,et al.Simultaneous expression of recombinant baculovirus-encoded chicken anemia virus(CIAV) proteins VP1 and VP2 is required for formation of the CIAV-specific neutralizing epitope [J]. J Gen Virol,1998,79:3073-3077.
[9]Marshak D R,Kadonaga J T,ButgessR R,等(朱厚础译).蛋白质纯化与鉴定实验指南[M].北京:科学出版社,1999:148-156.
[10]Daniel T.Circoviruses immunosuppressive threats to avian species are view [J].Avian Pathol,2002,29:374-394.
10.3969/j.issn.1673-1409(S).2012.03.010
Q786
A
1673-1409(2012)03-S034-04
2012-03-10
冯 昕(1987-),男,湖北荆州人,硕士生,现从事基因工程疫苗研究。
荣 俊,E-mailrongjun59626@gmail.com。

