利伐沙班合成路线图解
符利梅 蒋翔锐 沈敬山 赵 波
1.南京师范大学化学与材料科学学院,江苏南京 210097;2.中科院上海药物研究所药物合成研究室,上海 201203
利伐沙班合成路线图解
符利梅1蒋翔锐2沈敬山2赵 波1
1.南京师范大学化学与材料科学学院,江苏南京 210097;2.中科院上海药物研究所药物合成研究室,上海 201203
本文综述了已经报道的利伐沙班及其关键中间体4-氨基苯基-3-吗啉酮的合成路线,分别从原料、反应条件、收率等方面对每条路线进行了总结。根据原料易得程度、路线长短、条件是否温和、收率的高低,得出以N-苯基乙醇胺为起始原料,C路线的合成路线比较适合大量制备,这为大规模工业化生产提供了依据,希望对实际生产有所帮助。
利伐沙班;合成路线;图解
利伐沙班(Rivaroxaban,商品名Xarelto)是一种口服抗凝血药物,由拜耳公司研发。2008年分别在加拿大和欧盟上市,用于预防成年患者髋关节及膝关节置换手术后的静脉血栓栓塞及肺栓塞的形成[1-3]。2011年7月经过美国FDA批准上市,同时在静脉血栓患者的二级预防、治疗心房颤动和急性冠状动脉综合症等领域进行临床试验。利伐沙班通过高选择性直接抑制Xa因子达到抗凝血作用,与传统抗凝血药物相比,具有服用方便、起效迅速、安全性高等特点[4-5]。根据不同起始原料及工艺,本文对目前已经报道的利伐沙班(1)及其关键中间体4-氨基苯基-3-吗啉酮(19)的合成路线进行了总结,有利于利伐沙班的工业合成。
1 中间体19的合成
1.1 以2 -(2-氯乙氧基)乙酰氯为起始原料
2 -(2-氯乙氧基)乙酰氯,在碳酸钾作用下和对硝基苯胺(24)发生酰化反应得23(83.6%),23在碱性条件下发生分子内关环反应得20(97%)[6-7],然后经过催化氢化反应得到19(85%)[11],催化剂为活性镍。三步反应得到中间体19,总收率较高(69%),但是起始原料2-(2-氯乙氧基)乙酰氯不易得,需要另行制备。
1.2 以对氟硝基苯为起始原料
对氟硝基苯(26)与吗啉溶于DMSO中,100℃下反应4 h生成25(98%),然后将25溶于二氯甲烷中,在苄基三乙基氯化铵、高锰酸钾作下,回流 10 h后,生成了 20(30%)[8-9],雷尼镍将其还原成19[11]。这种方法第一步收率很高,但是在使用高锰酸钾氧化的时候,副反应多,收率低(30%),有产物不易纯化的问题,不适于大量制备。
1.3 以N-苯基乙醇胺为起始原料
N-苯基乙醇胺(22)与氯乙酰氯在氢氧化钠作用下进行关环反应得到21(68%),21结构中的苯环用浓硫酸和硝酸进行硝化得20(69%)[10-11],然后被还原成19[11]。该方法的关环反应与硝化反应的收率中等,具有原料易得的优点,可以进一步优化,以期提高收率。
1.4 以对碘苯胺为起始原料
对碘苯胺(28)与3-吗啉酮(27)溶于二氧六环中,在碘化亚铜和N,N-二甲基乙二胺的作用下,加热至110℃反应12 h后生成了19(50%)[12-13]。这种方法只需要一步取代反应即可得到中间体19,但是对碘苯胺价格较贵,不适合于大量生产。
2 1的合成
2.1 A路线
5 -氯噻吩-2-羧酸(6)与氯化亚砜作用生成酰氯5,然后在碱性条件下和(2S)-3氨基-1,2-丙二醇反应生成4(92%),4与氢溴酸反应生成伯羟基溴代的产物(71%)。3与19在三甲吡啶的作用下发生烃基化反应得到了2(62%),2在1-甲基-2-吡咯烷酮中和CDI反应得到1[14-15],收率为92%。共四步反应,总收率37%,反应条件较为温和。
2.2 B路线
19 与(R)-环氧氯丙烷(18)在碳酸氢钠的作用下进行烃基化反应生成9(46%),9在N,N-二异丙基乙胺中被氯甲酸甲酯酰化得到8(87%)。19也可以先和氯甲酸甲酯在N,N-二异丙基乙胺中反应生成10(95%),10再与(R)-环氧氯丙烷在钠氢的作用下生成8(42%),8与7在正丁基锂或LiH-MDS强碱存在的条件下反应得到1(64%)[16]。两种方法均为三步反应,总收率均为26%。其中在最后一步8与7的反应中,要用到强碱正丁基锂或LiHMDS及低温反应条件。
2.3 C路线
19 可以与 13 在乙醇和水(9∶1)中回流生成 12(92%)[9]。12也可以经过另一种方法得到:由19先与(R)-环氧氯丙烷(18)在异丙醇中回流得到17(70%),17再与邻苯二甲酰亚胺钾盐反应[17],产率为93%。12在N,N-二异丙基乙胺作用下与氯甲酸甲酯反应得到的产物(97%),再与5在N,N-二异丙基乙胺和4-二甲氨基吡啶中反应得到11(99%),11在碳酸钾作用下与甲胺(40%)反应生成1(86%)[17]。C路线中的两种方法,合成步骤分别为四步和五步,收率为76%和54%。该路线反应条件温和,收率高,操作比较简单,适用于较大规模制备。
2.4 D路线
19 与(R)-环氧氯丙烷(18)反应得到 17,17 与 CDI反应得到的16,前两步的收率为29%。16再与邻苯二甲酰亚胺钾盐反应得到15(55%),15与肼反应得到14,14在三乙胺的作用下与5反应生成了1[9],后两步的收率为56%。路线D共五步反应,总收率为9%。
2.5 E路线
19 与13 反应得到12(93%),12在DMAP催化下与CDI反应得到15(91%),15与40%的甲胺水溶液在乙醇中回流反应得到14。14在三乙胺作用下,与5反应得到1[7,10,18-19],最后两步的总收率为74%。E路线共四步反应,总收率为63%。
利伐沙班的合成方法见图1。
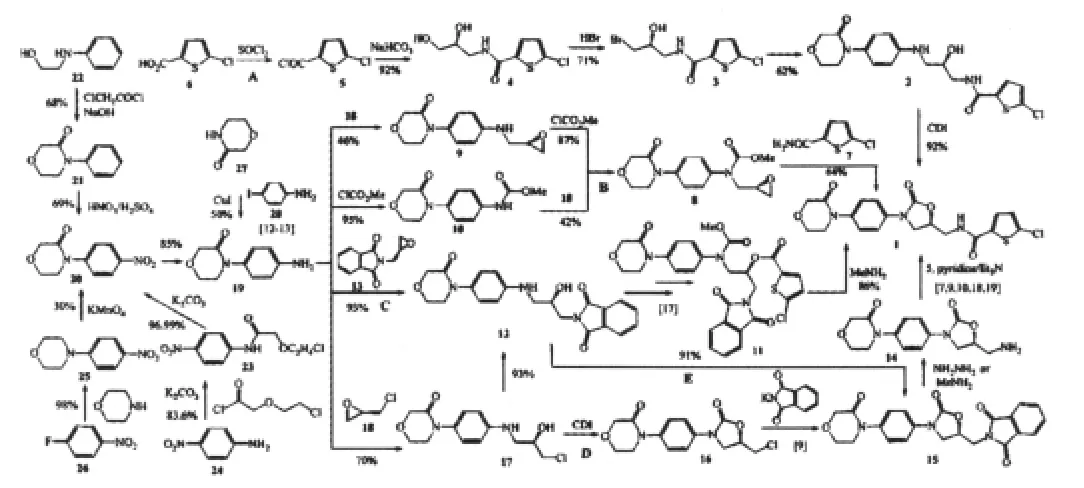
图1 利伐沙班的合成路线
3 小结
利伐沙班因具有服用方便、起效迅速、安全性高等特点,应用前景广泛。寻找高效、环保的合成方法具有重要意义。本文在起始原料、合成工艺、产率等方面对合成方法进行了归纳总结,希望有助于对利伐沙班的合成研究。
[1]Piccini JP,Patel MR,Mahaffey KW,et al.Riraroxban,an oral direct factor Xa inhibitor[J].Expert Opin Lnvestig Drugs,2008,17(6):925-937.
[2]Laux V,Perzborn E,Kubiza D,et al.Preclirical and clinical characteristics of vivarraxban:A novel,oral,direct factor Xa inhibitor [J].Semin Thromb Hemost,2007,33(5):515-523.
[3]Roehrig S,Straub A,Pohlmann J,et al.Discovery of the novel antithr-Ombotic-agent-chloro-N-({(5S)-2-oxo-3-[4-(3-oxomorpholin-4-yl)phenyl]-1,3-oxaz-olidin-5-yl}methl)hioph-ene-2-carboxamide(BAY 59-7939):an oral,direct factor Xa inhibitor [J].J Med Chem,2005,48(19):5900-5908.
[4]Kakkar AK,Brenner B,Dahl OE,et al.Extended duration rivaroxaban versus short-term enoxaparin for the prevention of venous thromboembolism controlled trial[J].Lancer,2008,372(9632):31-39.
[5]Lassen MR,Ageno W,Borris LC,et al.Rivaroxaban versus enoxaparin for thro-mboprpphlaxis after total knee arthroplasty[J].N Engl J Med,2008,358(26):2776-2786.
[6]Werner W,Bertram C,Christoph VA,et al.Chlorothio-phenecarboxamides as P1 surrogates of inhibitors of blood coagulation factor Xa[J].Bioorg Med Chem Lett,2004,14 (23):5817-5822.
[7]袁静,黄长江,张俊伟,等.利伐沙班的合成[J].中国新药杂志,2010,19(23):2185-2187.
[8]Urmannm,Nazare M,Wehner V,et al.New beta-aminoacid-derivatives,useful as blood clotting enzymes factor Xa inhibitors in the treatment of abnormal thrombus formation,acute myocardial infarction, cardiovascular disorders, and unstable angina:WO,2005095440[P].2005-10-13.
[9]Masse CE.New substituted oxazolidinone derivatives useful in pharmaceutical compositions for treating a disease e.g.pulmonary embolism,stroke,thromboembolism,deep venous thrombosis,thrombosis,myocardial infarction,acute coronary syndrome:US,20090137535[P].2009-5-28.
[10]Thomas C,Berwe M,Straub A,et al.Production of 4-(4-aminophenyl)-3-mo-rpholinone,useful as a pharmaceutical intermediate,comprises hydrogenating 4-(4-nitrophenyl)-3-morpholinone in an aliphatic alcohol:US,7598378[P].2009-10-6.
[11]Zupancic S,Pecavar A.Preparing rivaroxaban useful for prophylaxis and treatment of e.g.heart attack,comprises dissolving rivaroxaban in a solvent or a mixture of solvents,crystallizing rivaroxaban, optionally washing and drying the crystals:WO,2011012321[P].2011-2-3.
[12]Song Y,Zhu B,Wang S,et al.New tetrahydroisoquinoline compounds useful for treating e.g.myocardial infarction,unstable angina,thrombotic stroke,transient ischemic attacks and osteoarthritis:US,20060160840[P].2006-7-20.
[13]Song Y,Zhu B,Wang S,et al.New urea derivatives are Factor Xa inhibitors useful in the treatment of e.g.acute coronary syndrome,myocardial infarction,unstable angina,and occlusive coronary thrombus occurring post-thrombolytic therapy:US,20060160821[P].2006-7-20.
[14]Thomas CR,Thomas C.Production of 5-chloro-N-((5S)-2-oxo-3-(4-(3-oxo-4-morpho-linyl)-ph-enyl)-1,3-oxazolidin-5-ylmethyl)-2-thiophenecarboxamide, useful as a factor Xa inhibitor,from 5-chlorothiophene-2-carboxylic acid:US,20100081807[P].2010-4-1.
[15]Berwe M,Thomas C,Rehse J,et al.Method for preparing thiophene-2-carbox-amide derivative (Rivaroxaban),useful for treatment and prevention of thromboembolic disease,comprises reacting thiophene-2-carbonyl chloride with amine in presence of inorganic base:US,7351823[P].2008-4-1.
[16]Bodhuri P,Weeratunga G.Preparing at least one of S-rivaroxaban and R-rivaroxaban, useful to treat e.g.deep vein thrombosis, comprises reacting 5-chloro-thiophene-2-carb-oxylic acid amide with 4-phenyl-morpholin-3-one compound,in the presence of base:US,2010273798[P].2010-10-28.
[17]Bodhuri P,Weeratunga G.New oxazolidinone compound useful as the intermediates for the preparation of (S)-or (R)-Rivaroxaban for the prevention and treatment of e.g.deep vein thrombosis,pulmonary embolism,myocardial infraction,angina pectoris,cerebral stroke: US,2011034465[P].2011-10-2.
[18]Susanne R,Alexander S,Jens P,et al.Discovery of the Novel Antithrombotic Agent 5-Chloro-N-({(5S)-2-oxo-3-[4-(3-oxomorpholin-4-yl)phenyl]-1,3-oxazolidin-5-yl}methyl)thiophene-2-carboxamide (BAY 59-7939):An Oral,Direct Factor Xa Inhibitor[J].J Med Chem,2005,48(19):5900-5908.
[19]Zupancic S,Pecavar A.Preparing rivaroxaban useful for prophylaxis and treatment of e.g.heart attack,comprises dissolving rivaroxaban in a solvent or a mixture of solvents,crystallizing rivaroxaban,optionally washing and drying the crystals:WO,2011012321[P].2011-2-3.
Graphical synthesic routes of Rivaroxban
FU Limei1JIANG Xiangrui2SHEN Jingshan2ZHAO Bo1
1.School of Chemistry and Materials Science,Nanjing Normal University,Jiangsu Province,Nanjing 210097,China;2.Department of Medicinal Chemistry,Shanghai Institute of Materia Medica,Chinese Academy of Sciences,Shanghai 201203,China
Graphical synthesic routes of rivaroxban reported and the key intermediate of 4-(4-aminophenyl)morpholin-3-one are reviewed in this article.Respectively,starting materials,operations,yield,etc.are summarized.We can conclude that N-phenyl ethanol amine as the starting material,route C is more suitable for large production according to the material,route length and yield level.It provides a basis for large-scale industrial production and hopes to have advantages in the production of the actual situation.
Rivaroxban;Synthesic routes;Graphic
R973.2
A
1673-7210(2012)04(c)-0112-02
江苏省科技厅科技支撑计划(项目编号:BE2011196);上海市重点科技攻关项目(项目编号:10391901800)资助。
符利梅(1985-),女,汉族,山西大同人,硕士研究生,主要从事药物合成工作。
赵波(1969-),男,汉族,山东临朐人,教授,主要从事药物化学研究。
2011-11-28 本文编辑:卫 轲)

