氨溴特罗口服溶液微生物限度检查方法学验证
陈扣宝 王 玮
(巢湖市食品药品监督检验所,安徽 巢湖 238000)
氨溴特罗口服溶液具有止咳祛痰的新药,其主要成分为盐酸氨溴索和盐酸克仑特罗。根据《中国药典》2010年版的规定,药品在进行微生物限度检查前必须对其检查方法进行验证,以确认供试品所采用的检查方法无抑菌作用后再进行检查,才能真实反映供试品受污染的程度。因此,我们对氨溴特罗口服溶液进行了微生物限度检查的方法验证。
1 仪器与材料
1.1 仪器设备
净化工作台、托盘天平、HTY-761匀浆仪、HTY-ⅢA集菌仪(杭州高德泰林有限公司)、开放式薄膜过滤器(杭州高德泰林有限公司)、BIO-Ⅱ-A2生物安全柜(上海振梓空气净化设备有限公司);隔水式电热恒温培养箱(上海跃进医疗器械一厂)、YQL-LS-50SⅡ立式压力蒸汽灭菌器、MJX-160B-Z霉菌培养箱(上海博讯实业有限公司医疗设备厂)
1.2 培养基
营养肉汤培养基、改良马丁液体培养基、改良马丁琼脂培养基、营养琼脂培养基、玫瑰红钠琼脂培养基、胆盐乳糖培养基(BL)、4-甲基伞形酮葡糖苷酸(MUG)培养基等均由中国药品生物制品检定所提供。稀释剂:pH 7.0蛋白胨-氯化钠缓冲液(稀释供试品用,中国药品生物制品检定所提供),靛基质试液由本实验室提供。
1.3 供试品
氨溴特罗口服溶液(规格:100mL/瓶,生产厂家:市售,批号:101126、101127、101128)
1.4 试验菌
大肠埃希菌(Escherichia coli)[CMCC(B)44102],金黄色葡萄球菌(Staphylococcus aureus)[CMCC(B)26003],枯草芽孢杆菌(Bacillus subtilis)[CMCC(B)63501],白色念珠菌(Candida albicans)[CMCC(F)98001],黑曲霉(Aspergillus niger)[CMCC(F)98003],均由中国药品生物制品检定所提供。
2 方法和结果
按中国药典2010年版二部附录Ⅺ J有关微生物检查方法验证试验[1,2]。
2.1 菌液的制备
2.2 供试液制备
取10mL供试品,加pH7.0的无菌氯化钠-蛋白胨缓冲液稀释至100mL,用匀浆仪(2000r/min,2min)混匀,作为1:10倍的供试液备用。
2.3 细菌、霉菌及酵母菌计数方法的验证
2.3.1 试验组
取1:10倍供试液1mL和1mL已制备好的菌液,注入同一平皿,迅速倒入15~20mL 45℃的相应琼脂培养基,待凝,每个菌株制备2个平皿。细菌在30~35℃培养箱中培养48h~72h;霉菌在23~28℃培养箱中培养72~120h,逐日观察,点计菌落数,取均值。
2.3.2 菌液组
分别取菌液1mL注入平皿内,每种菌平行制备2个平皿,测定所加的试验菌数。
2.3.3 供试品对照组
按试验组方法,不加菌液,测定供试品菌数(本底菌)。
2.3.4 稀释剂对照组
取与供试液等量的稀释剂和菌悬液各1mL注入一个平皿中,平行做2份,培养基注皿,培养,计数,取均值。
2.3.5 回收率测定
按下列公式:
(以下同)计算回收率,

(以下同)计算回收率,
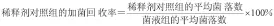
常规法的回收率结果见表1。
从表1结果看,采用常规法检查供试品,5种菌株的回收率均大于70%,因此可以采用常规法对该药品细菌、霉菌和酵母菌进行计数检查。
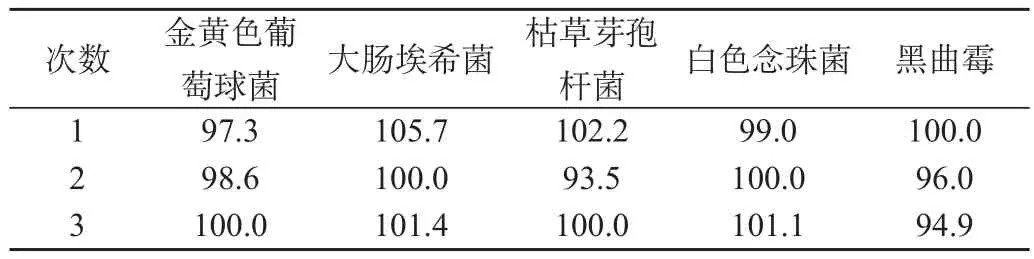
表1 常规法的回收率试验结果(%)
2.4 控制菌(大肠埃希菌)检查方法的验证
2.4.1 供试液的制备
同“2.2”项下1∶10供试液的制备。
2.4.2 试验组
①常规法:取1:10的供试液10mL和大肠埃希菌悬液1mL(约为50~100cfu/mL)接种至100mL胆盐乳糖培养基中,置于35℃培养18~24h,取0.2mL接种至5mLMUG培养基管内,35℃培养,分别于5h与24h的时间,置366nm紫外光下观察荧光,再沿培养管管壁加入数滴靛基质试液,观察结果。 同时用未接种的MUG培养基作本底对照。 ②培养基稀释法 取1:10的供试液10mL和大肠埃希菌悬液1mL(约为50~100cfu/mL)接种至400mL胆盐乳糖培养基中,置于35℃培养18~24h,取0.2mL接种至5mLMUG培养基管内,35℃培养,分别于5h与24h的时间,置366nm紫外光下观察荧光,再沿培养管管壁加入数滴靛基质试液,观察结果。同时用未接种的MUG培养基作本底对照。③薄膜过滤法 取1∶10的供试液10mL加入到已灭菌的反复使用全封闭薄膜过滤器中,过滤,用pH7.0无菌氯化钠-蛋白胨缓冲液400mL冲洗(100mL/次,冲洗4次),在最后一次冲洗液中加入大肠埃希菌悬液1mL(约为50~100cfu/mL),取出滤膜接种至100mL胆盐乳糖培养基中,置于35℃培养18~24h,取0.2mL接种至5mLMUG培养基管内,35℃培养,分别于5h与24h的时间,置366nm紫外光下观察荧光,再沿培养管管壁加入数滴靛基质试液,观察结果。同时用未接种的MUG培养基作本底对照。
2.4.3 阴性对照
取稀释剂10mL取代供试液,其余照试验组操作。
2.4.4 阳性对照
不加供试液,其余照试验组操作。
2.4.5 供试品组
取供试液10mL,不加菌,其余照试验组操作。
2.4.6 结果见表2。
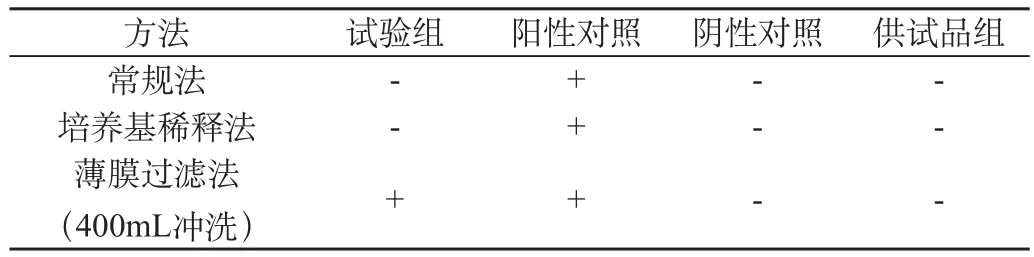
表2 大肠埃希菌控制菌验证方法试验结果
从表2结果看,采用薄膜过滤法,阴性对照、供试品组未检出试验菌,阳性对照检出试验菌,试验组检出试验菌,说明可采用薄膜过滤法(400mL冲洗,100mL/次)对该供试品进行控制菌检查。
3 讨 论
3.1 试验结果表明,氨溴特罗口服溶液可采用平皿法进行细菌数、霉菌和酵母菌数检查,控制菌(大肠埃希菌)可采用薄膜过滤法(400mL冲洗,100mL/次)进行检查。
3.2 在该验证方案中有值得我们思考和研究之处
在细菌计数方法验证时,我们针对大肠埃希菌的回收率的3次独立试验中,回收率均高于90%,表明该药物对大肠埃希菌是没有抑菌作用。但是,在控制菌(大肠埃希菌)检查验证试验中,当我们采取常规法试验时,试验组在规定条件培养后,产酸产气不明显,MUG荧光与阳性对照比较时较弱,靛基质试验中变色不明显;我们又用了培养基稀释法,结果同常规法基本一致;最后通过验证,我们采取薄膜过滤法(400mL冲洗,100mL/次)进行检查,结果符合要求。从控制菌验证试验我们看出该药物对大肠埃希菌是有抑制作用的,从这个角度分析,这与细菌验证时的作用是相互矛盾。我们分析其原因:两种试验中唯一的区别在于培养基的差异,细菌计数采用营养琼脂、控制菌检查采用的是胆盐乳糖液体培养基,因此我们认为培养基可能对药物的菌落加样回收具有不可消除作用。因此,我们在做微生物限度验证试验时应更加仔细,认真考虑所有的影响因素,勤比较、细观察、多总结。
[1]国家药典委员会编.中华人民共和国药典二部[S].2010年版.北京:中国医药科技出版社,2010:附录107.
[2]中国药品生物制品检定所.中国药品检验标准操作规范.2010年版.北京:中国医药科技出版社,2010:40-389.

