硫化氢预处理对大鼠心肌缺血再灌注损伤的保护作用
李 辉,冉 珂,唐正国,李双凤,常业恬
(1.中南大学湘雅二医院麻醉科,湖南 长沙 410011;2.长沙市第三医院麻醉科,湖南 长沙 410015)
硫化氢(H2S)是继一氧化氮(NO)和一氧化碳(CO)之后发现的第三个内源性气体信号分子,其参与机体许多生理和病理过程的调节。有研究表明,H2S 预处理对大鼠心肌缺血再灌注损伤有保护作用[1],但是其保护机制目前尚未完全阐明。S-腺苷蛋氨酸合成酶(SAM-s)是一种促进高半胱氨酸合成的重要酶,而高半胱氨酸在体内经过氧化后可产生大量氧自由基,导致细胞损伤[2]。H2S 预处理对心肌缺血再灌注损伤的保护作用是否与SAM-s 有关目前未见报道。为此,本研究拟通过研究H2S 预处理对大鼠心肌SAM-s 表达的影响,以探讨其对心肌缺血再灌注损伤的保护机制。
1 材料与方法
1.1 动物 健康成年SD 雄性大鼠40 只,体重300~350 g,由湖南斯莱景达实验动物有限公司提供。
1.2 仪器设备 H150 呼吸机、MD100-2 电子分析天平、内切式匀浆机、721 分光光度仪、恒温水浴箱、恒温震荡器等系国产仪器;H-7500透射电子显微镜、CH30 光学显微镜、摄影系统、全自动生化分析仪、5415R 型高速低温台式离心机、压力换能器、电转印装置、计算机图像分析系统系美国等国外公司产品。
1.3 试剂 硫氢化钠(NaHS)、5-羟葵酸(5-HD)、伊文思蓝、氯化硝基四氮唑蓝、戊巴比妥钠均为美国Sigma 公司产品,丙烯酰胺、无水乙醇、异丙醇、氯仿、二甲苯等均为国产试剂,超氧化物歧化酶(SOD)和丙二醛(MDA)试剂盒均为南京建成生物工程研究所。
1.4 方法
1.4.1 缺血再灌注模型的制备 参考文献[3-4]方法制备大鼠缺血再灌注模型,大鼠经腹腔推注3%戊巴比妥钠30 mg/kg 麻醉,多导联心电监测。气管插管,动物呼吸机控制呼吸,潮气量8~10 ml/kg,频率70次/min。在心尖搏动最明显处之上一肋间隙开胸,切开心包,确认左冠圆锥支,在圆锥支之后用7-0 丝线结扎左冠前降支,立即可见左室前壁紫绀充血,心率减慢,血压一过性下降,心电图监测S-T 段明显抬高,确认阻断成功。
1.4.2 动物分组 将40 只健康成年S-D 雄性大鼠随机分成4组:假手术组(S组)、缺血再灌注组(IR组)、硫化氢组(H组)和硫化氢预处理+线粒体KATP 通道阻断剂(5-羟葵酸,5-HD)组(D组),每组10 只。S组仅开胸并分离冠状动脉左前降支,不阻断血流150 min;IR组行冠状动脉左前降支阻断30 min,再灌注120 min;H组静脉注射NaHS 0.05 mg/kg,给药后24 h 同IR组处理,D组缺血前15 min 静脉注射5-HD 5 mg/kg,其它同H组处理。
1.5 心肌梗死面积的测量 实验结束立刻重新阻断左冠前降支并从尾静脉注入1%伊文思蓝2 ml,充分染色后取出心脏。分离左心室(包括室间隔),滤纸吸干后将心脏放在-20 ℃冰箱10 min 后取出,切片,每片厚约1~2 mm。血供正常心肌呈蓝染,缺血区心肌呈紫红或苍白,缺血心肌与正常心肌比值即为缺血危险区。将心肌置于37℃10%TTC 中水浴15 min,氧化还原反应后存活心肌呈蓝色,梗死心肌呈灰色,危险区心肌呈红色。4%甲醛固定24 h 后,每个心脏切片进行数码照相,留取左心室称重。左心室,缺血区(非蓝色区)和心肌梗死区(灰色区)面积用Image-Pro Plus 5.0 软件计算。心肌缺血区范围用心肌缺血区重量占左心室重量百分比表示。心肌梗死范围用心肌梗死区重量占心肌缺血区重量百分比表示。
1.6 心肌SAM-s 的测定 采用免疫印迹分析,在再灌注120 min 结束即刻,取左心室前壁心肌组织提取蛋白,并于-70℃储存备用。取100μg 心肌蛋白于12.5%聚丙烯酰胺凝胶进行电泳,分离的心肌蛋白随后通过电转印装置转印至PVDF 膜,室温下在封闭液中作用3 h,再加入SAM-s 抗体,4℃孵育过夜,用TTBS 缓冲液冲洗15 min×4次后,加入二抗羊抗鼠IgG,室温摇动孵育1h,再用TTBS 缓冲液充分冲洗,最后进行增强化学发光反应。结果用GIS-700D 型凝胶图像系统进行扫描分析,记录平均光密度值表示心肌SAM-s 表达。
1.7 生化指标测定 于再灌注结束即刻抽取动脉血2 ml,以4 500 r/min 分离血清,-20℃保存待测。采用黄嘌呤氧化酶法和硫代巴比妥酸盐法分别测定血清丙二醛(MDA)及超氧化物歧化酶(SOD)。
1.8 统计学处理 将各组测得的值进行统计学处理,采用SPSS 13.0 软件分析。所有数据采用均数±标准差()表示,进行完全随机设计的方差分析,多组均数的比较采用LSD法,以P<0.05 为差异有统计学意义。
2 结果
2.1 心肌梗死面积变化 除S组外,各组心肌缺血面积无明显差异(P >0.05);与IR组比,H组心梗面积降低(P<0.05),D组无明显差异(P >0.05,表1 和图1)。
表1 各组大鼠心肌缺血面积及心梗面积的比较Table 1 The changes of infarct area and area at risk in each group(,n=7)

表1 各组大鼠心肌缺血面积及心梗面积的比较Table 1 The changes of infarct area and area at risk in each group(,n=7)
与IR组比,* P<0.05.

图1 大鼠左室心肌Evan's Blue 与TTC 染色后切片Fig.1 The slice of myocardium of the rat ventriculus sinister under staining of Evan's Blueand TTC
2.2 各组MDA 含量和SOD 活性的变化 与IR组比较,H组的SOD 活性升高,MDA 含量降低(P<0.05),而D组上述指标与IR组比较,差异无统计学意义(P >0.05,表2)。与IR组比较,D组的SOD 活性和MDA 含量变化不大,差异无统计学意义(P >0.05,表2)。
表2 各组大鼠血浆MDA 含量及SOD 活性的变化Table 2 Changes of plasma levels of MDA and SOD of each groups (,n=10)

表2 各组大鼠血浆MDA 含量及SOD 活性的变化Table 2 Changes of plasma levels of MDA and SOD of each groups (,n=10)
与IR组比较,* P<0.05.
2.3 各组大鼠心肌SAM-s 表达 心肌SAM-s光密度值S组为(49.1±7.3),表达水平较低;与S组比较,IR组(179.6±10.4)表达上升(P<0.05);H组为(108.6±14.1),表达低于IR组(P<0.05),D组为(188.5±12.8),表达与IR组相比,差异无统计学意义(P >0.05,图2)。
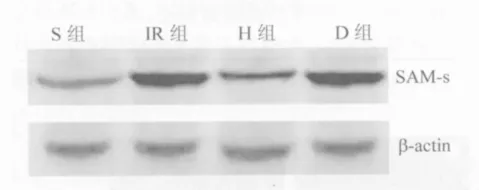
图2 各组大鼠心肌SAM-s 蛋白表达Fig.2 Western blot products of SAM-s expression of each group
3 讨论
硫化氢(H2S)作为一种内源性气体信号分子,在体内有两种存在形式:1/3 以气体形式,2/3 可能以硫氢化钠(NaHS)形式存在。NaHS在体内可解离成钠离子和硫氢根离子,后者与体内氢离子结合生成H2S,H2S 与NaHS 形成一种动态平衡。NaHS 溶液与内源性H2S 的体内的存在方式相似,而且NaHS 的浓度便于精确定量H2S 含量,而H2S 气体饱和的液体则不便于精确定量H2S 的浓度,因此NaHS 溶液是较理想的外源性H2S 供体。Elrod 等[5]在研究H2S预处理对心肌损伤的保护机制中,发现从5~50μg/kg 不同剂量的NaHS 之中,50μg/kg的保护作用最强,因此,本研究采用IR 前24 h给予NaHS 50μg/kg 预处理的方案。
心肌梗塞面积是国际公认的评价心肌缺血损伤的金指标,TTC 染色法是公认的检测早期心肌细胞不可逆损伤的最可靠而灵敏的方法[6-7]。在本研究中,IR组和H组的缺血面积无显著性差异,表明LAD 阻断效果肯定,而且各组LAD 阻断部位基本一致。与IR组比,H组心梗面积明显降低,提示H2S 预处理能减轻心肌损伤程度。
SAM-s 合成酶是促进高半胱氨酸合成的重要酶,SAM-s 在甲基转移酶的作用下生成S-腺苷高半胱氨酸,后者进一步脱去腺苷,生成高半胱氨酸。文献报道,高半胱氨酸是糖尿病微血管病变的独立危险因素[2],在糖尿病性心肌病大鼠心肌组织中的高表达是诱发加重糖尿病性心肌病发病的重要因素,这与细胞内高半胱氨酸经氧化产生大量氧自由基,引起血管内皮损伤和功能障碍有关。本研究结果显示,各个实验组心肌SAM-s 表达增高,提示缺血再灌注作为一种病理生理刺激因素,导致心肌细胞的蛋白质表达发生变化。另一方面,心肌缺血再灌注期间产生大量氧自由基是引起缺血再灌注损伤的的主要因素,其对心肌的损伤主要表现为脂质过氧化作用,导致心肌细胞的损伤[8-9]。Yang 等[10]证实,心肌缺血再灌注期间有大量氧自由基产生,而体内最重要的脂质过氧化作用的代谢产物是MDA,故测定MDA 能较好地反映组织脂质过氧化程度,间接反映出细胞损伤程度[11],SOD 是体内清除自由基的一种特异酶,如果其活性降低,可导致氧自由基堆积,因此其活性变化可反映体内抗氧化功能情况。本研究结果显示,H2S 预处理组SAM-s 表达和MDA 含量降低,SOD 活性升高,提示H2S 预处理对心肌的保护作用可能是通过抑制S-腺苷蛋氨酸合成酶的表达,进一步抑制高半胱氨酸在心肌内的高表达,从而减少氧自由基的产生以及对心肌造成的脂质过氧化反应。此外,本研究发现,H2S 预处理+线粒体KATP 通道阻断剂组的心梗死面积、MDA 含量、SOD 活性以及心肌SAM-s 表达等指标均无明显变化,提示线粒体KATP通道介导了H2S 预处理对缺血再灌注心肌的保护作用。
总之,本研究表明,H2S 预处理对大鼠心肌缺血再灌注损伤具有保护作用,其机制可能是通过抑制心肌SAM-s 表达,减少氧自由基的生成,增强心肌抗氧化能力有关。
[1]HU L F,PAN T T,NEO K L,et al.Cyclooxygenase-2 mediates the delayed cardioprotection induced by hydrogen sulfide preconditioning in isolated rat cardiomyocytes [J].Pflugers Arch,2008,455(6):971-978.
[2]CHEN Gang,LIN Li-xiang,ZHUANG Wei-te,et al(陈刚,林丽香,庄维特,等).Expression of Sadenosylme thionine synthetase gene in myocardial tissue of diabetic cardiomyopathy rats and its significance [J].Journal of Fujian Medical University(福建医科大学学报),2002,36(2):144-146.(in Chinese)
[3]RAN Ke,DUAN Kai-ming,ZOU Ding-quan,et al(冉珂,段开明,邹定全,等).Effects of Isoflurane delayed preconditioning on nuclear factor-кB during myocardial ischemia reperfusion injury in rabbit[J].Chin J Emerg Med(中华急诊医学杂志),2008,17(8):834-837.(in Chinese)
[4]RAN Ke,TANG Zheng-guo,DING Li-ping,et al(冉珂,唐正国,丁丽萍,等).Effect of hydrogen sulfide induced delayed preconditioning on glutathione Stransferase (GST) expression during myocardial ischemia-reperfusion in rats [J].Journal of Zhejiang University:Medical Science(浙江大学学报医学版),2011,40 (5):535-539.(in Chinese)
[5]ELROD J W,CALVERT J W,MORRISON J,et al.Hydrogen sulfide attenuates myocardial ischemiareperfusion injury by preservation of mitochondrial function[J].Proc Natl Acad Sci,2007,104(39):15560-15565.
[6]PRZYLENK K,LI G,WHITTAKER P.No loss in the in vivo efficacy of ischemic preconditioning in middle-aged and old rabbits [J].J Am Coll Cardiol,2001,38(6):1741-1747.
[7]COHEN M V.Efficacy of preconditioning should be gauged by reduction of infarction [J].Br J Pharmacol,2004,141(2):197-198.
[8]TOSSIOS P,BLOCH W,HUEBN ER A,et al.Nacetylcysteine prevents reactive oxygen species mediated myocardial stress in patients undergoing cardiac surgery:results of a randomized,doubleblind,placebo-controlled clinical trial [J].J Thorac Cardiovasc Surg,2003,126(5):1513-1520.
[9]MEHLHORN U,KRAHWIN KEL A,GEISSLER H J,et al.Nitrotyrosine and 8-isoprostane formation indicate free radical mediated injury in hearts of patients subjected to cardioplegia [J].J Thorac Cardiovasc Surg,2003,125(1):178-183.
[10]YANG X M,PROCTOR J B,CUI L,et al.Multiple,brief coronary occlusions during early reperfusion protect rabbit hearts by targeting cell signaling pathways [J].J Am Coll Cardiol,2004,44(5):1103-1110.
[11]LIU J X,LI X Z,MA X B,et al.Cardio-protective effects of corocalm on acute myocardial ischemia/reperfusion injury in rats [J].Chin J Integr Med,2006,12(3):199-202.

