丹参酮ⅡA脂微球注射液制备工艺研究*
★ 曹运朝 梁新丽廖正根 赵国巍 招丽君 倪斌(江西中医学院现代中药制剂教育部重点实验室南昌 330004)
丹参为中国的传统中药,最早见于《神农本草经》,并被列为上品。Tan-ⅡA是从传统的活血化淤类中药丹参中提取的脂溶性有效成分,具有抗氧化、降低自由基水平、保护血管内皮细胞、抗动脉粥样硬化形成、预防心绞痛与心肌梗塞及抗癌[1],尤以治疗冠心病及缺血性脑血管病最为常用[2]。由于Tan-ⅡA为脂溶性成分,无法直接注射给药,乳剂[3]作为一种优良的载体,可包载脂溶性药物,轻易通过血脑屏障(BBB),达到治疗脑部疾病的效果。本研究采用高速剪切法制备初乳,以Ke为考察指标,单因素筛选初乳的制备工艺;采用高压均质机对初乳进行二次乳化,以Ke、平均粒径、载药量为考察指标,正交设计优化Tan-ⅡA脂微球高压均质的制备工艺。
1 仪器和试药
1.1 仪器 Agilent 1200高效液相色谱仪(安捷伦科技有限公司);UV 2100 PC型紫外分光光度计(尤尼科上海仪器有限责任公司);TG328A十万分之一电子天平(德国Startorius公司);Malvern纳米粒度仪(英国马尔文公司);乳化机(FA25 model上海弗鲁克流体机械制造有限公司);HF6A型多头磁力加热搅拌器(常州国华电器有限公司);高压均质机(加拿大ATS公司)。
1.2 材料 注射用大豆油(LCT铁岭北亚药用油有限公司,批号y11030103-2-01);注射用中链脂肪酸甘油脂(MCT Lipoid,批号940031);蛋黄卵磷脂(Lipoid E80,批号;20100021);注射用油酸钠(Lipoid sodium oleate B,批号204352-1);注射用Tween-80(上海申宇医药化工有限公司);注射用甘油(江西益谱生药业有限公司,批号20100601);泊洛沙姆F-68(珠海远城医药化工公司);Tan-ⅡA原料(西安昊轩生物有限公司,含量≥98%,批号DST-110105);正辛醇(上海化学试剂公司);甲醇(色谱纯,德国Merk),水为双蒸水,其他试剂均为分析纯。
2 丹参酮ⅡA脂微球的评价方法
2.1 Tan-ⅡA含量测定方法的建立
2.1.1 色谱条件
色谱柱:Phenomenex-C18,(4.6×150mm,5 μm);流动相为甲醇:水=80:20;流速:1.0mL/分;检测波长:270nm;柱温:25℃ ;进样量:20 μL。在上述色谱条件下,Tan-ⅡA对照品(A),空白脂微球(B),Tan-ⅡA脂微球(C)三色谱无干扰,见图1。

图1 Tan-ⅡA高效液相色谱图

2.1.2 标准曲线的制备
精密称取Tan-ⅡA对照品2.0mg,加甲醇定容至50mL的容量瓶中,得Tan-ⅡA浓度为44.8μg/mL的储备液。精密量取Tan-ⅡA储备液3mL置10mL容量瓶,加甲醇定容至刻度,即得Tan-ⅡA浓度为13.44μg/mL,分别精密吸取13.44μg/mLTan-ⅡA对照品0.5、1、2、3、4、5、6mL加甲醇定容至10mL,配制成Tan-ⅡA对照品浓度分别为0.732 μg/mL、1.344μg/mL、2.688μg/mL、4.032μg/mL、5.376μg/mL、6.72μg/mL、8.064μg/mL的系列溶液。按“2.1.1”项下液相色谱条件,各对照品溶液分别进样20 μL,测定峰面积。以峰面积(A)为纵坐标,溶液浓度(C)为横坐标,绘制标准曲线,其回归方程如下:A=121.46C-1.4275,r=0.9998,线 性 范 围 为 0.732~8.064μg/mL。
2.1.3 精密度实验
分别用3种浓度的Tan-ⅡA供试品溶液(0.732、4.032、8.064μg/mL),在上述色谱条件下进样20μL,1天内重复进样5次,连续进样5天,记录Tan-ⅡA的峰面积。结果日内RSD分别为1.310%、0.374%和1.061%(n=5)日间RSD分别为2.192%、1.493%和1.1828(n=5),表明方法精密度良好。
2.1.4 回收率实验
取浓度分别为(0.732、4.032、8.064μg/mL)Tan-ⅡA供试品溶液各5份,在上述色谱条件下进样,每次进样20 μL,测定Tan-ⅡA的峰面积,根据标准曲线计算Tan-ⅡA的浓度,以测定浓度与配制浓度之比计算回收率。高、中、低3个浓度的回收率为95.78%-105.7%,RSD为2.34%-4.43%。
2.2 离心稳定性
乳剂的物理稳定性变化表现为分层、析油等现象。将乳剂在一定转速下离心一段时间,对乳剂的影响相当于自然静置较长时间产生的影响,因此用离心分光光度法测得的稳定性常数Ke可作为评价乳剂物理稳定性的一个指标[4]。方法:将初乳剂2mL置于离心管中以1000r/分离心3分钟,终乳以3000r/分离心10分钟,用微量进样器精密量取试管底部110uL至100mL容量瓶中,用过0.22μm微孔滤膜的蒸馏水稀释定容,以蒸馏水为空白,用紫外-可见分光光度计在可见区500nm处测定吸收度n(=3),记为A。同法将未离心的乳剂在相同波长下测定吸收度(n=3),记为Ao。按以下方法计算乳剂稳定性参数Ke:

公式中Ke为乳剂的稳定性常数。Ke值越小,说明分散的乳滴在离心力的作用下上浮的越少,表示此乳剂越稳定,故可以用Ke值来评价乳剂的物理稳定性。
2.3 乳剂粒径及粒径分布
制备粒径小而均匀的分散系,是体系物理稳定性良好的基本保证[5]。取Tan-ⅡA脂微球溶液适量,以双蒸水稀释200倍后,用纳米粒度分析仪测定纳米粒的平均粒径及粒径分布。
3 内容和结果
3.1 单因素考察丹参酮ⅡA脂微球初乳的制备工艺
参照丹参酮磺酸钠注射液的临床使用剂量40-80mg/次/日。参照参考文献,规定本品的规格为0.7mg/mL。在实验的基础上,将本品的基本处方暂定为:LCT:MCT=1:1 20g,磷脂 1g,F-68 0.4g,Tween-80 0.2g,甘油2.25g,油酸钠0.03g,注射用水加至100mL。
3.1.1 初乳两相混合顺序的筛选
固定如下因素水平:制备温度70℃,搅拌速度10 000r/分,搅拌时间10分钟。以Ke为考察指标,考察两相混合方式和混合顺序对Ke的影响。
称取处方量的混合油相,70℃加入1g卵磷脂并充分搅拌使其全部溶解,然后加入70mgⅡA使其彻底溶解,即得油相;同时在水相中加入处方量的F-68、Tween-80、甘油、油酸钠 ,使其充分溶解,70℃保温即得水相。称取工艺一:油相恒速缓慢加入到搅拌中的全部水相中,搅拌10分钟。工艺二:恒速缓慢将油相加入到70%的水相中,剩余的30%的水相70℃恒温,待初乳制备完成后再加入剩余的30%的水,考察制备中相比变化的影响。工艺三:将油相一次性加入水相中,然后再高速搅拌,与恒速缓慢加入相比较。工艺四:先将油相先加入搅拌器中,然后缓慢加入水相。工艺五:将70%的水相恒速缓慢加入搅拌中的油相中,待初乳成型后再加入剩余量的水相稀释。按离心法评价工艺优越。初乳制备结果见图2。

图2 油水两相不同的加入顺序和相比变化对Ke的影响
结果:工艺1和工艺4较好,但工艺1和4没显著性差异。考虑在实际操作中水相比较多,油相较少,工艺4操作不便,故选择工艺1。
3.1.2 搅拌速度和时间的选择
按上述优化工艺,改变转速和时间,考察机械力度对离心稳定性常数的影响。在参考文献的基础上[6],先固定搅拌时间为10分钟,考察搅拌速度对乳剂Ke的影响,结果见图3。结果表明搅拌速度为13 000r/分稳定性较好;根据优化的工艺,固定搅拌速度,考察搅拌时间对乳剂Ke影响,结果见图4,结果表明搅拌时间10、12、14分钟对Ke影响不大,考虑到节约时间,故选择10分钟。
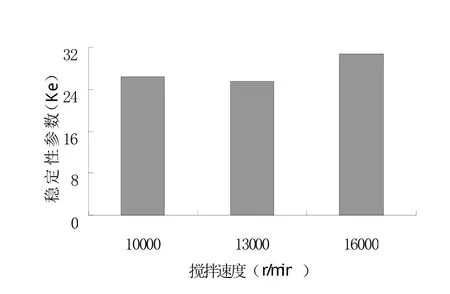
图3 不同搅拌速度对Ke的影响

表4 不同搅拌时间对Ke的影响
3.2 正交设计优化高压均质工艺
以Tan-ⅡA脂微球的Ke、平均粒径、载药量为考察指标,选择均质压力(A)、均质次数(B)及初乳制备温度(C)作为考察因素[7],每个因素又设定三个水平,根据因素水平表,选择正交表L9[4]进行实验。为在统一标准下加权评分[8],三项指标最佳的分别定为30、30和40分,规定离心稳定性常数最小的即3.9为30分,其余各值以公式:30-(离心稳定性常数-3.9)×2计分;规定粒径最小的即273nm为30分,其余各值以公式:30-(粒径-273)计分;规定载药量最大的即692μg为40分,其余各值以公式:40-(692-载药量)/10计分;最后将三个指标的分值之和作为该试验的分值,并进行方差分析,结果见表1、2。

表1 高压均质工艺正交实验设计结果
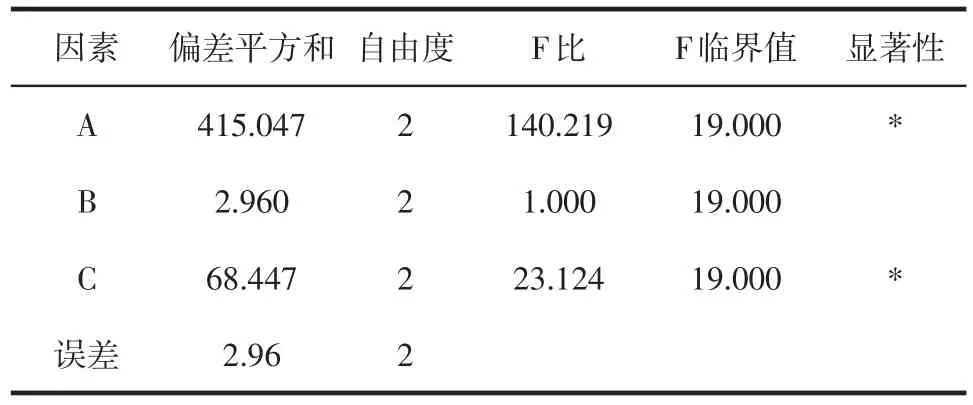
表2 Tan-ⅡA脂微球工艺考察方差分析表
以综合评分为考察指标,由表1、2可知因素A与C对试验影响显著,因素B对试验结果影响不明显。对于Tan-ⅡA脂微球较优的高压均质工艺为A2B1C3即80℃,70Mpa,高压均质8次。
3.3 Tan-ⅡA脂微球制备工艺的验证
称取处方量的混合油相,80℃加入1g卵磷脂并充分搅拌使其全部溶解,然后加入70mgⅡA使其彻底溶解,即得油相;同时在水相中加入处方量的F-68、Tween-80、甘油、油酸钠,使其充分溶解,80℃保温即得水相。油相恒速缓慢加入到搅拌中的全部水相中,13 000r/分剪切10分钟,即得初乳,初乳经高压均质机70Mpa,均质8次。测定脂微球Ke、粒径、载药量,数据见表3。

表3 工艺验证数据
从重复实验数据可得,用单因素及正交优选的Tan-ⅡA脂微球制备工艺较为稳定、重复性好。
4 讨论
丹参酮ⅡA几乎不溶于水,实验测得丹参酮ⅡA在水中的溶解度小于5 μg/mL。文中将丹参酮ⅡA制成微乳后,其含量大于700 μg/mL,较为显著地提高了丹参酮ⅡA的溶解度。
脂微球的基本制备工艺为“初乳制备”,再“高压均质”,使脂肪乳的粒径一般控制在300 nm左右。本文以稳定性常数Ke为指标,研究了初乳的制备温度、高速剪切的转数、剪切时间对初乳稳定性的影响,筛选了初乳的制备工艺。进一步采用正交设计,优化初乳的二步高压均质机匀化工艺,考察了高压均质压力、均质次数等工艺因素对乳剂稳定性、粒径、载药量的影响,确定了丹参酮ⅡA脂微球的高压均质工艺。
采用本实验结果对丹参酮ⅡA脂微球工艺进行验证,结果表明用单因素及正交优选的Tan-ⅡA脂微球制备工艺较为稳定、重复性好。
[1]彭招华,袁侣明,韩民利.丹参的药理作用研究概况[J].中药材,2001,24(9):690.
[2]甘发平.丹参酮IIA的药动学研究及透过血脑屏障的初步考察[D].杭州:浙江大学,2008.
[3]陆彬.药物新剂型与新技术第1版[M].北京:人民卫生出版社,2002,64-66.
[4]韩继洪.抗癌药物FT-207脂肪乳剂物理稳定性质的研究[J].沈阳药学院学报,1991,8(1):14-7.
[5]袁悦,李英,李三鸣.注射用环孢素A亚微乳的制备[J].中国新药杂志,2006,15(12):982.
[6]张翠霞,王东凯,王海凤,等.尼莫地平亚微乳的制备及其性质考察[J].中国新药杂志,2006,15(15):1 264-1 267.
[7]Aboofazeili R,Lawrence MJ.Investgation into the formation and charaction of the phospholipid microemultion[J].Int J Pham,1977,93:161-7.
[8]范云鹏,王德云,胡元亮.正交试验优选黄芪多糖脂质体的制备工艺[J].中草药,2011,42(3):470-473.

