胰腺癌MUC1 mRNA转染树突细胞疫苗诱导特异性抗肿瘤的免疫反应
陈江 郭晓钟 李宏宇 邵晓东 刘旭 赵佳钧 王迪
·论著·
胰腺癌MUC1 mRNA转染树突细胞疫苗诱导特异性抗肿瘤的免疫反应
陈江 郭晓钟 李宏宇 邵晓东 刘旭 赵佳钧 王迪
目的研究人胰腺癌MUC1 mRNA转染树突细胞(DC)诱导的特异性抗肿瘤免疫反应,为DC疫苗治疗胰腺癌提供实验依据。方法从外周血中分离单核细胞(PBMC)并培养成DC,从细胞形态和表面标志进行鉴定。通过RT-PCR扩增胰腺癌MiaPaCa-2细胞的MUC1 mRNA后用电穿孔法将其转染DC。采用实时定量PCR和蛋白质印迹法检测培养不同时间点DC的MUC1的表达。用四甲基偶氮唑蓝法检测DC存活率。采用51Cr标准细胞毒实验观察转染MUC1 mRNA的DC诱导的特异性细胞毒性T淋巴细胞(CTL)反应;应用ELASA法检测CTL的IFN-γ释放量。结果培养获得的细胞呈现典型的DC形态特征和表面标志(CD40+、HLA-DR+、CD83+、CD86+)。MUC1 mRNA转染 DC 48 h后,细胞MUC1 mRNA表达水平最高,为38.43(36.89~48.06),蛋白表达亦最强。转染后DC的存活率稳定在80%左右。转染MUC1 mRNA的 DC可有效诱导HLA-A2+/MUC+特异性CTL免疫反应;胰腺癌Capan-2细胞与转染MUC1的DC刺激MUC1特异性CTL的24 h IFN-γ释放量分别为(28.44±4.96)和(16.31±2.54)U/ml,差异具有统计学意义(P<0.05)。结论人胰腺癌MUC1 mRNA体外转染DC后可诱导CTL产生特异性抗肿瘤免疫反应。
树突细胞; RNA,信使; 转染; 胰腺肿瘤; T淋巴细胞,细胞毒性
树突细胞(dendritic cells, DCs)肿瘤疫苗作为一种主动免疫的抗肿瘤方法,其临床应用已引起了学界的高度重视[1]。MUC1是一种高糖基化蛋白,具有高度的抗原性,并能够被细胞毒T细胞(CTL)所识别,因此被认为是肿瘤生物治疗的理想的靶点[2]。超过90%的胰腺癌存在MUC1的高表达,故本研究将人胰腺癌MiaPaCa-2细胞MUC1 mRNA转染患者DC,观察转染后DC诱导的MUC1特异性CTL对靶细胞的杀伤作用,为临床构建胰腺癌相关抗原MUC1 DC肿瘤疫苗提供实验依据。
材料和方法
一、DC的分离、培养和鉴定
收集20例健康志愿者和8例胰腺癌患者(沈阳军区总医院供血科、消化科提供)外周血,采用Ficoll-plus paque T密度梯度离心法分离单核细胞(PBMC),常规培养。取未贴壁细胞另作培养备用;贴壁细胞继续培养20 h,加入800 IU/ml重组人粒-巨噬细胞集落刺激因子和500 IU/ml重组人IL-4(美国PeproTec公司)培养5 d,加入10 ng/ml TNF-α继续培养2 d,收集成熟DC。分别使用倒置显微镜和电子显微镜观察DC形态学特征。收集的DC分装5管,分别加入鼠抗人荧光标记的CD40、HLA-DR、CD83、CD86单抗和作为对照的IgG(美国Santa-Cruz公司),用流式细胞仪分析鉴定。每个样品分析细胞数>1×106个。
二、胰腺癌细胞MUC1 mRNA扩增及DC转染
人胰腺癌细胞株MiaPaCa-2为沈阳军区总医院消化科实验室保存。常规培养、传代。取对数生长期细胞,用Trizol抽提细胞总RNA。采用Primer premier 5.0软件设计MUC1及作为校正的看家基因次黄嘌呤磷酸核糖基转移酶(HPRT)引物。MUC1引物上游5′-TGA GTG ATG TGC-3′,下游5′-CTG CCC GTA GTT CTT TCG-3′,产物158 bp;HPRT引物上游5′-GGT TCT CGG GGC ACC TCT-3′,下游5′-TCG GCT TGA AAT GAC CTA ATG-3′,产物221 bp。应用Sensiscript RT Kit (Qiagen公司)逆转录cDNA,以cDNA为模板,应用T7 mMessage mMachine试剂盒(Ambion公司)于37℃ 2~4 h体外转录为MUC1 mRNA,沉淀后保存。参考Milazzo等[3]方法,2 mm的电极杯内加入200 μl DC悬液和20 μg MUC1 mRNA进行电转染。电压300 V、间隔125 ms、4个脉冲,持续250 ms。电穿孔后立刻置入4℃冰箱静置10 min,移入加有完全培养基的12孔培养板中培养0、12、24、48、72、96 h。
三、DC的MUC1表达及存活率检测
收集1×106个电转染的DC,用Trizol提取总RNA,应用QuantiTect SYBR Green PCR 试剂盒(Qiagen公司)行PCR。反应条件:95℃ 15 min,94℃ 20 s、60℃ 20 s、72℃ 20 s,40个循环,最后68℃ 60 s中止反应。用双标准曲线法,以转染后0 h的表达量为1进行相对定量[4]。每个样品重复2次,取均值。
将电转染的DC悬于提取缓冲液 (100 mmol/L NaCl,1% NP-40,0.5%去氧胆酸钠,5 mmol/L MgCl2,0.1 mmol/L苯甲基磺酰氟化物,0.1 mmol/L胃酶抑素A,0.1 mmol/L抗痛素,0.1 mmol/L糜蛋白酶抑制素,0.2 mmol/L亮肽素,10 μg/ml抑酞酶,0.5 mg/ml大豆胰蛋白酶抑制剂,1 mM 苯甲脒) 冰上反应15 min,14 000 r/min离心20 min,取上清,应用BCA法定量蛋白,常规行蛋白质印迹法检测MUC1蛋白表达。兔抗人MUC1多抗购自DPC-Biermann公司,ECL购自Amersham公司。同时应用四甲基偶氮唑蓝(Sigma公司)法检测DC存活率。
四、51Cr标准细胞毒实验
按Heiser等[5]方法,从非贴壁的PBMC中获得MUC1特异性CTL作为效应细胞。分别以转染MUC1 mRNA、PBMC总RNA、绿色荧光蛋白(GFP)RNA、MiaPaCa-2总RNA 24 h的DC以及Capan-2和MiaPaCa-2细胞作为靶细胞。将2×106个靶细胞与100 μ Ci NaCrO4(中国同位素公司)培养1 h,计数5×103个51Cr标记的靶细胞与连续稀释的效应细胞以不同的效靶细胞比在96孔板中培养6 h。吸取50 μl上清液,使用伽马射线测量计数器测量51Cr的每分钟脉冲数(CPM)。计算特异性裂解液的裂解百分比,即[(实验CPM-自发CPM)/(最高CPM-自发CPM)]×100%。实验重复3次,取均值。
五、γ-干扰素(IFN-γ)释放实验
将上述靶细胞作为刺激细胞,以自体MUC1特异性CTL细胞作为反应细胞。按照CTL细胞与刺激细胞的设定比例,在96孔板中常规培养24 h,总体积200 μl。取培养上清,采用ELASA试剂盒(Genzyme公司)检测IFN-γ分泌量,实验重复3次。结果以105反应细胞24 h的IFN-γ释放量表示(U/ml)。
六、统计学处理
结 果
一、DC的形态及表型
PBMC经体外分离、培养,数量达初始数量的10倍左右。多数细胞组合成黏附力松散的细胞克隆,呈悬浮或团块生长,胞体向四周伸出大量树枝状或裙褶状不规则突起,呈现DCs特殊的形态特征(图1)。细胞具有典型的成熟DC表面标志:CD40+、HLA-DR+、 CD83+和CD86+(图2)。
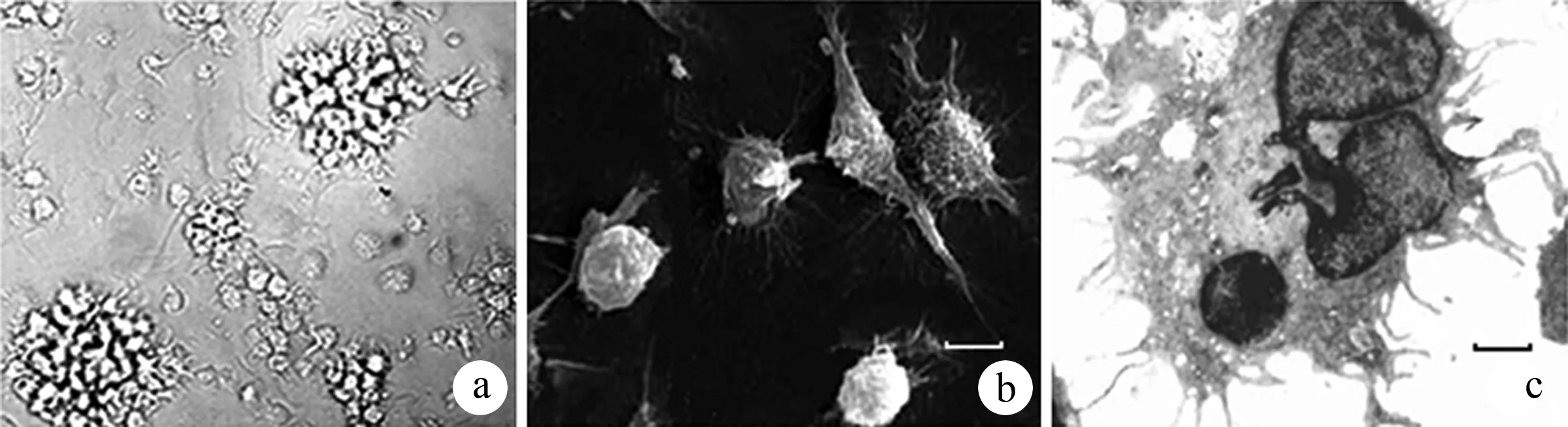
图1DC的光镜(a)、扫描(b)及透射(c)电镜下的形态(×200,刻度线为1 μm)
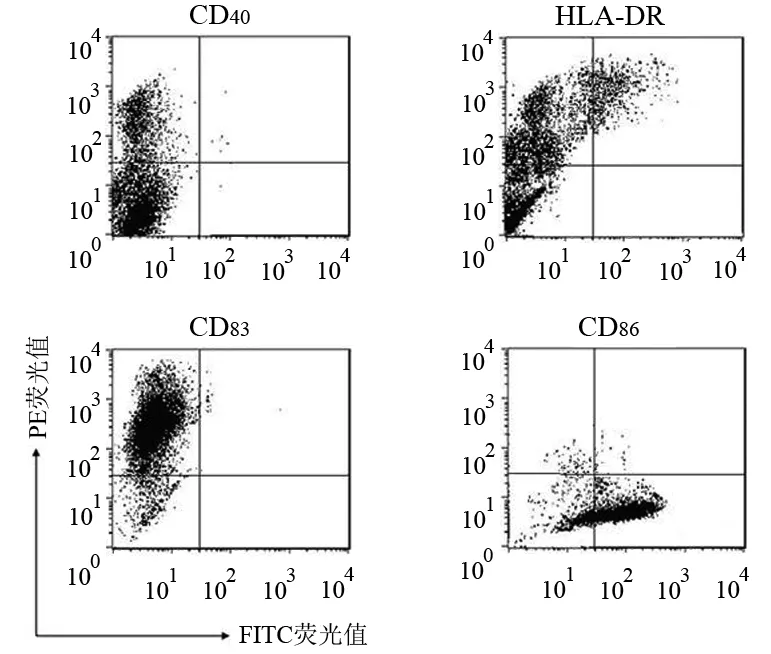
图2 DC的表面标志
二、MUC1 mRNA转染后DC的MUC1表达
MUC1 mRNA电转染DC 0、12、24、48、72、96 h的MUC1mRNA表达量分别为1、14.87(12.49~17.35)、24.11(21.82~27.30)、38.43(36.89~48.06)、17.39(13.02~19.13)、5.92(3.91~7.87),以转染后48 h的表达水平最强(图3)。MUC1蛋白表达亦在48 h最强,而后渐减弱(图4)。
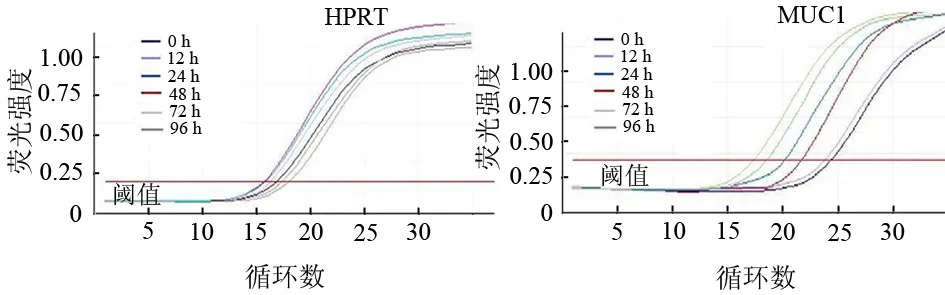
图3 转染后DC的MUC1 mRNA表达

图4 转染后DC的MUC1蛋白表达
三、MUC1 mRNA转染后DC的存活率
MUC1 mRNA转染后DC的存活率在不同时间点相差不大,稳定在80%左右(图5)。
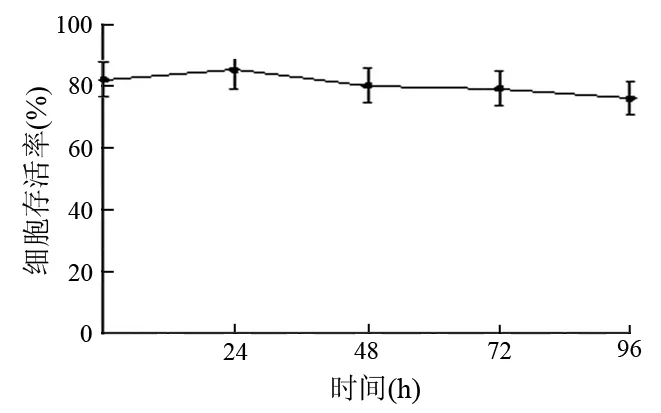
图5 MUC1 mRNA 转染后DC的存活率
四、自体MUC1特异性CTL对DC及胰腺癌MiaPaCa-2、Capan-2细胞的杀伤力
无论是健康志愿者还是胰腺癌患者,转染MUC1 mRNA的DC均能诱导自体MUC1特异性CTL的免疫反应,能有效识别和杀伤转染MUC1 mRNA的DC,而转染GFP mRNA、PBMC总RNA的DC无识别和杀伤作用,并且转染MUC1 mRNA的DC诱导的CTL在识别和杀伤特异性靶细胞的能力和强度上优于转染MiaPaCa-2总RNA的DC(图6)。

图6 MUC1特异性CTL对DC的杀伤力
但来自人类HLA-A2+胰腺癌患者的MUC1特异性CTL能有效识别和杀伤HLA-A2+/MUC1+的Capan-2胰腺癌细胞,而不能识别和杀伤HLA-A2-/MUC1+的MiaPaCa-2胰腺癌细胞,亦不能识别和杀伤HLA-A2+/MUC1-的靶细胞(转染PBMC或GFP RNA的DC,图7)。
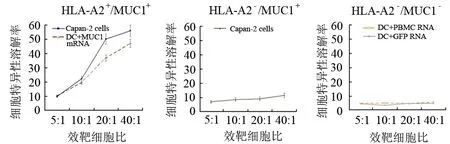
图7MUC1特异性CTL对不同HLA-A2和MUC1表达靶细胞的杀伤力
五、DC刺激抗原特异性CTL的IFN-γ释放
转染PBMC或GFP RNA的DC及HLA-A2-/MUC1+的MiaPaCa-2不能刺激抗原特异性CTL分泌IFN-γ;而HLA-A2+/MUC1+的Capan-2细胞及转染MUC1 mRNA的DC能显著激活、诱导MUC1特异性CTL分泌IFN-γ。Capan-2刺激CTL的24 h IFN-γ释放量达(28.44±4.96) U/ml,远高于转染MUC1的DC的(16.31±2.54)U/ml(P<0.05,图8)。
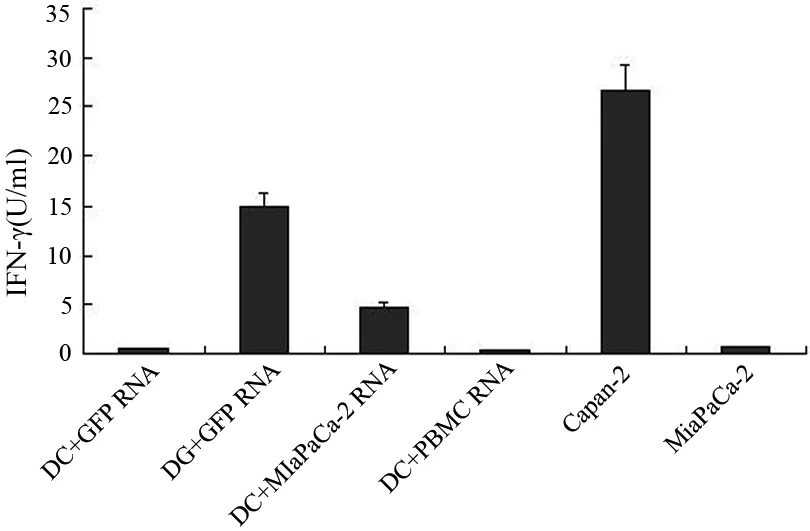
图8 不同效应细胞刺激MUC1特异性CTL的IFN-γ释放
讨 论
DC肿瘤疫苗的实质是以CTL为基础的细胞免疫,疫苗构建的关键因素在于选取适合的肿瘤相关抗原(TAA)。尽管已证实恶性细胞高表达TAA,但其中少有易受T细胞影响的靶点[6]。MUC1是高糖基化I型糖蛋白的一种,其蛋白分子可通过特定的跨膜结构“锚泊”在细胞表面,主要组分是由约20个氨基酸构成的不定数串列重复区构成的独立的胞外域。该蛋白结构简单清晰,易被免疫细胞所呈递和识别[7]。同时,MUC1的表达具有高度的肿瘤特异性,在胰腺癌组织中的阳性表达率可达90%以上[2],因此被认为是肿瘤免疫治疗的一个重要靶点。
本研究显示,来自健康志愿者和胰腺癌患者的DC转染MUC1 mRNA后诱导的CTL免疫反应强度近乎相同。原因可能是引入的抗原负荷量不足。
MUC1特异性CTL只能识别和杀伤HLA-A2+/MUC1+的靶细胞。而对HLA-A2-/MUC1+的MiaPaCa-2细胞以及HLA-A2-/MUC1-的转染有自体(PBMC)或无关组织(GFP)RNA的DC未引出特异性免疫杀伤效应。提示MUC1特异性CTL免疫反应受到MHC I类抗原呈递的限制。
总之,本研究将扩增的MUC1 mRNA转染DC,在体外成功诱导出了针对胰腺癌细胞的MUC1特异性CTL免疫反应,为MUC1 DC疫苗的构建与应用提供了理论和实验基础。
[1] IIett EJ,Prestwich RJ,Melcher AA.The evolving role of dendritic cell in cancer therapy.Expert Opin Biol Ther,2010,10:369-379.
[2] Yonezawa S, Higashi M, Yamada N, et al. Significance of mucin expression in pancreatobiliary neoplasms. J Hepatobiliary Pancreat Sci, 2010,17:108-124.
[3] Milazzo C,Reichardt VL,Müller MR, et al. Induction of myeloma-specific cytotoxic T cells using dendritic cells transfected with tumor-derived RNA. Blood, 2003, 101:977-982.
[4] Klein D. Quantification using real-time PCR technology: applications and limitations. Trends Mol Med, 2002, 8: 257-260.
[5] Heiser A,Coleman D,Dannull J,et al.Autologous dendritic cells transfected with prostat specific antigen RNA stimulate CTL responses against metastatic prostatetumors.J Clin Invest,2002,109:409-417.
[6] Zitvogel L, Regmanlt A, Lcizer A, et al. Eradication of watablished murine tumors using a novel cell free vaccine: dendritic cell derived exosomes. Nat Med, 2005, 4:594-600.
[7] Ven Mensdorff-Pouilly S, Snijdewint FG, Verstraeten AA, et al. Human MUC1 mucin: a multifaceted glycoprotein. Int J Biol Markers, 2000,15: 343-356.
Inductionofspecificanti-tumorimmuneresponsesagainstpancreaticcancerbytransfecteddendriticcellswithpancreaticcancerMUC1mRNA
CHENJiang,GUOXiao-zhong,LIHong-yu,SHAOXiao-dong,LIUXu,ZHAOJia-jun,WANGDi.
DepartmentofGastroenterological,ShenyangGeneralHospitalofPLA,Shenyang110840,China
GUOXiao-zhong,Email:Guoxiaozhong1962@163.com
ObjectiveTo investigate the induction of specific anti-tumor immune response by transfected dendritic cells (DCs) with MUC1 mRNA of human pancreatic cancer, and to provide the experimental evidences for the treatment of human pancreatic cancer with DC vaccine.MethodsDCs were isolated and cultured from peripheral blood mononuclear cells (PBMCs), and then were identified by cell morphology and surface markers. After being transcripted and amplified, MUC1 mRNA was transfected into DCs by electroporation. The expression of MUC1 in DCs at different time points was detected by quantitative real-time PCR and Western blot. The survival rate of DCs before and after transfection was determined by MTT method. The induction of specific cytotoxic T lymphocyte (CTL) response by MUC1 mRNA transfected DCs was measured by51Cr standard cytotoxicity test. The released amount of IFN-γ was evaluated by ELISA method.ResultsThe cultured cells appeared typical characteristics with regard to morphology and phenotype (CD40+, HLA-DR+, CD83+, CD86+). After MUC1 mRNA transfection for 48 h, the expression of MUC1 mRNA of DCs reached the highest point (38.43) and the MUC1 protein expression also reached the highest point at 72 h. The survival rate of DCs was stabilized around 80% after transfection. The DCs transfected with MUC1 mRNA could effectively induce HLA-A2+/MUC1+specific CTL immune responses. Stimulated by pancreatic cancer cell line Capan-2 cells or the DCs transfected with MUC1 mRNA, the IFN-γ released in 24 h by MUC1 specific CTL were (28.44±4.96)U/ml and (16.31±2.54)U/ml, respectively. The difference between the two groups was statistically significant (P<0.05).ConclusionsDCs transfected with human pancreatic cancer MUC1 mRNA could induce CTLs and produce specific anti-tumor immunity.
Dendritic cells; RNA, messenger; Transfection; Pancreatic neoplasms; T-lymphocytes, cytotoxic
10.3760/cma.j.issn.1674-1935.2012.03.004
国家自然科学基金(81071982)
110016 沈阳,沈阳军区总医院消化科
郭晓钟,Email:guoxiaozhong1962@163.com
2012-02-02)
(本文编辑:屠振兴)

