不同TOAST分型脑梗死患者血清基质金属蛋白酶-3水平的研究
吴 健,陈应柱,俞 龙
(江苏省苏北人民医院神经内科,江苏扬州,225001)
脑梗死发生后,梗死灶内的多种蛋白水解酶活性开始升高,其中以基质金属蛋白酶(MMP)等被认为与脑梗死关系密切。MMP是一种在降解细胞外基质过程中起主要作用的锌、钙依赖性蛋白水解酶家族。MMP-3又称基质溶素-1,可激活MMP-1、MMP-8、MMP-9,使之由非活性的酶原转化为有活性的酶而起生物作用,并共同参与细胞外基质(ECM)的降解过程,所以MMP-3在MMPs的生物活性中起始动作用[1-2]。本研究旨在检测脑梗死后患者血清MMP-3水平的动态变化,及其与TOAST分型和预后的关系。
1 临床资料
本研究纳入82例为2006年9月—2009年8月入住本院神经内科、发病在24 h内的急性脑梗死患者,其中男47例,女 35例,平均年龄(65.59±7.86)岁。纳入标准:发病24h内的急性脑梗死,均首次发病;缺血性卒中诊断符合1995年中华医学会第4届脑血管病学术会议修订的标准,并经CT或MRI确诊。依据欧洲进展性脑卒中研究组制订的进展性脑卒中诊断标准2判定脑梗死有无进展。排除标准:脑出血,既往有卒中史;肝肾功能不全或心功能衰竭;严重感染或恶性疾病、4周内有潜在的感染体征和症状;外科手术和外伤史;近期输血、近半月内服用抗血小板药、他汀类降脂药、血管紧张素转换酶抑制剂类降压药、激素或免疫抑制剂。对照组32例,均为本院同期健康体检者。其中男18例,女14例,年龄平均(66.16±5.23)岁。
TOAST病因分型:将脑梗死患者按TOAST分为大动脉粥样硬化型、小动脉闭塞型(即腔隙性脑梗死)、心源性栓塞型、其他病因明确型和不明病因型。
标本采集:采集对照组、脑梗死组入院第2天(发病时间24 h内)以及发病第3、第7天,清晨空腹外周静脉血3 mL,2%EDTA抗凝,-20℃保存。
2 结 果
TOAST分型:本组在明确病因的亚型中,小动脉闭塞型(34例,41.46%)最常见,其次为大动脉粥样硬化型(15例,18.29%)和心源性栓塞型(10例,12.19%),其他明确病因型(1例,1.22%)最少,不明原因型22例(26.84%)。
CI患者NIHSS评分比较:不同类型ACI患者NIHSS水平不同。TOAST 5个亚型中,心源性栓塞型NIHSS评分最高(15.0±5.0),其次为大动脉粥样硬化型(12.0±5.0),而小动脉闭塞型最低(3.0±1.7);与小动脉闭塞型比较,心源性栓塞型、大动脉粥样硬化型NIHSS评分差异有统计学意义(P<0.01)。对脑梗死组患者发病后第1天血清MMP-3水平与相应时间段的美国国立卫生院卒中量表(NIHSS)评分进行直线相关分析,结果显示,2者之间存在相关关系(P<0.01)。脑梗死组患者血清MMP-3水平的动态变化及与TOAST分型的关系见表1。
表1 CI组患者血清MMP-3水平的动态变化(,mg/L)

表1 CI组患者血清MMP-3水平的动态变化(,mg/L)
与对照组比较:**P<0.01。
组别 例数 发病后24 h 发病后72 h 发病后7 d急性脑梗死组 82 248.68±26.36** 336.22±29.16** 262.38±31.21**大动脉粥样硬化型 15例 281.36±33.13** 389.69±38.36** 345.22±31.21**心源性栓塞型 10例 253.21±26.65** 332.53±31.93** 286.97±29.23**小动脉闭塞型 34例 221.19±23.16** 236.32±25.17** 191.17±20.13不明原因型 22例 245.15±26.18** 313.37±31.28** 271.26±29.13**其他明确病因型 1 226 251 213对照组 32 186.46±23.89
CI组患者血清MMP-3与进展性脑梗死的关系见表2。不同TOAST亚型进展性脑梗死中血清MMP-3水平均明显高于非进展性脑梗死患者。
表2 进展性脑梗死与非进展性血清MMP-3水平比较(,mg/L)
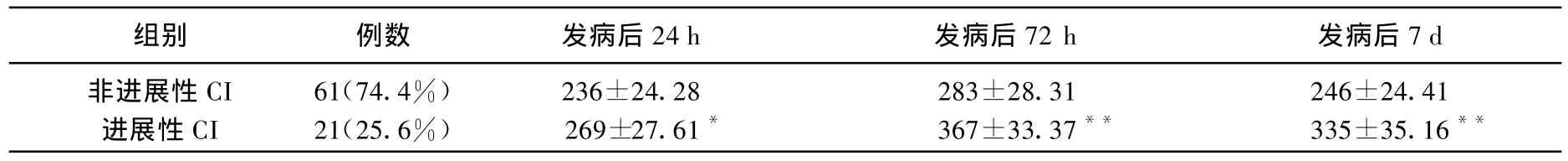
表2 进展性脑梗死与非进展性血清MMP-3水平比较(,mg/L)
与非进展性脑梗死组比较:**P<0.01。
组别 例数 发病后24 h 发病后72 h 发病后7 d非进展性CI 61(74.4%) 236±24.28 283±28.31 246±24.41进展性CI 21(25.6%) 269±27.61* 367±33.37** 335±35.16**
3 讨 论
TOAST分型是按病因进行卒中分型的代表,具有较好的信度和效度[3-4]。本研究结果显示,TOAST分型构成中以小动脉闭塞型最高,达41.46%,其次为不明原因型、大动脉粥样硬化型和心源性栓塞型,而有明确病因型最低。本研究结果与国内报道[5]大致相同,与国外报道[6]有一定的差异。在国外,TOAST分型中小动脉闭塞型比例要低于本研究结果,而心源性栓塞型比例要高于国内。其原因可能与以下因素有关:种族、地域不同:多个研究报道,不同种族、人种和国家的TOAST亚型比例不同;机遇的作用:各研究样本例数不同,研究中样本例数越大,偏倚越小,各研究所选样本例数不同,造成差异不可避免;饮食习惯、生活环境不同:高脂血症、糖尿病、肥胖者更易致大动脉粥样硬化;被研究人群提供病史的可靠程度和研究者提取资料的熟练程度对研究也有影响;辅助检查的完整性。因此,为减少分型差异,可采用尽量增加样本样的方法,并完善辅助检查,熟练掌握分型方法。
MMP-3又称为基质裂解素,是在动脉粥样斑块中表达的基质金属蛋白家族的主要成员[7],它广泛存在于动脉粥样病变处,它能降解细胞外基质的多数成分,诸如能特异性地降解明胶、纤维连接蛋白、层粘蛋白、玻璃连接蛋白和Ⅳ型胶原,同时还能激活其他的MMPs,国外研究报道[8],当粥样斑块有高浓度巨噬细胞浸润时,释放大量基质金属蛋白酶(MMPs),纤维帽基质被广泛降解,使斑块趋向不稳定,继发血栓形成堵塞血管。国外发现[9]MMP-3的表达与脑缺血损伤有关,应用抗MMP单克隆抗体可减轻缺缺血性脑损伤,提示MMPs参与了缺血性脑损伤,MMP-3可以通过降解各型蛋白及胶原,通过产生细胞因子、自由基、趋化因子和募集单核细胞来扩大缺血性损伤。同时还可激活MMP-9加重缺血性脑损伤。国内研究表明[10]脑梗死组血清MMP-3水平显著高于正常组。提示血清MMP-3可能与急性缺血性脑血管病的发生有关。研究发现脑梗死伴有颈动脉易损斑块患者的MMP-3水平高于稳定斑块组,差异有统计学意义,提示增高的MMP-3通过降解ECM成分而削弱斑块纤维帽的厚度和强度,在斑块的稳定性中起重要作用。
本研究结果显示,脑梗死患者发病第1天血清MMP-3水平与NIHSS评分有关,NIHSS评分越高,血清MMP-3水平也越高,两者呈正相关,表明脑梗死患者血清MMP-3水平可以反映脑梗死临床病情的轻重。研究结果还显示,MMP-3作为生物活性指标,有助于急性脑梗死的TOAST分型分型,并提供病变程度和预后的信息,同时也可以作为早期评定病情有无进展的指标之一。本研究中不同TOAST亚型进展性脑卒中发生率显示:进展性脑卒中发生率25.6%,大动脉亚型最高达到40%,心源性次之,小动脉型最少,不明原因型第3,这与TOAST分型中LAA、CE亚型预后较差,SAO预后较好的研究结果一致。
[1]Sood R R,Taheri S,Candelario-Jalil E,et al.Early beneficial effect of matrix metalloproteinase inhibition Off bloodbrain barrier permeability as measured by magnetic resonance imaging countered by impaired long-term recovery after stroke in rat brain[J].Cereb Blood Flow M etab,2008,28(2):431.
[2]Birschel P,Ellul J,Barer D,et al.Progressing stroke:towards all internationallyAgreed definition[J].Cerebrovasc Dis,2004,17(2-3):242.
[3]许晓辉,许予明,谈颂,等.缺血性卒中改良的TOAST分型与OCSP分型关系的研究[J].中国实用内科杂志,2008,28(7):538.
[4]张雷,郑正涛,李静.脑梗死急性期血清C反应蛋白水平与TOAST分型关系的研究[J].中国实用医药,2011,6(3):37.
[5]吴丽娥,刘鸣,张月辉,等.缺血性脑卒中TOAST病因分型和预后[J].中华神经科杂志,2004,37(4):292.
[6]Grau A J,Weimar C.Bussle F.Risk factom outcome and treatment in subtypes of ischemic stroke:the German stroke data bank[J].Stroke,2001,32(11):2559.
[7]李雪姣,李新强,李新娟,等.牛磺酸对弥漫性脑损伤大鼠脑皮层基质金属蛋白酶3表达的影响[J].新乡医学院学报,2010,27(2):123.
[8]Galis Z S,Khatri J J.Matrix metalloproteinase′s in vascular remodeling and atherogenesis:T he good,the bad,and the ugly[J].Circ Res,2002,90(3):251.
[9]Walker E J,Rosenberg G A.TIMP-3 and MMP-3 contribute to delayed inflammation and hippocampal neuronal death following global ischemia.Experimental Neurology,2009,216(1):122.
[10]李东芳,冀俊林,李光来,等.血清基质金属蛋白酶3与颈动脉粥样硬化斑块及缺血性脑卒中的关系[J].中国医师进修杂志,2011,13(3):302.

