对甲苯磺酸催化查尔酮的合成
谭昌会,郑荣选,罗淑云,林俏焰
(漳州师范学院 化学与环境科学系, 福建 漳州 363000)
对甲苯磺酸催化查尔酮的合成
谭昌会,郑荣选,罗淑云,林俏焰
(漳州师范学院 化学与环境科学系, 福建 漳州 363000)
研究了查耳酮的制备方法和缩合反应的影响因素选择最佳的反应条件,实验的结果表明,合成查尔酮的缩合反应的较佳条件是:n(苯乙酮)/n(间硝基苯甲醛)=1∶1,反应温度是70 ℃,反应的时间3 h,对甲苯磺酸为3 g,乙酸用量为20 mL,在此条件下查尔酮的收率达71.6%。
间硝基苯甲醛;苯乙酮;查尔酮
查尔酮及其衍生物是芳香醛酮及其衍生物发生羟醛缩合的产物,其化学名为1,3-二苯基丙烯酮,以它为母体的化合物存在于甘草、红花等多种天然植物体中,查尔酮是合成天然黄烷酮化合物的重要有机中间体[1],是多种药用植物的有效成分之一。查尔酮类化合物是一种多活性化合物在新型药物的研究与开发上受到广泛的应用,因此近年来引起了化学工作者们浓厚的研究兴趣。许多文献报道了多种查尔酮衍生物的合成方法及应用。
Laliberte早在1967年就报道了查尔酮具有抗蛲虫作用[2],Vincenzo在2000年发现了类黄酮化合物中的查尔酮具有化学预防和抗肿瘤活性[3],何克勤、程桂芳等也报导了某些查尔酮的化合物具有抗过敏作用[4]。
Shibata发现新疆甘草查尔酮具有抗肿瘤和抗炎活性,于是合成了40多种衍生物经药理实验表明它们可干拢肿瘤细胞的细胞周期,从而达到对肿瘤细胞增殖的抑制。另外还有许多科学家经研究也报道了一些天然的多酚羟基查尔酮类化合物可抑制恶性淋巴瘤,抑制清除氧自由基及抗氧化等药理作用[5]。
以查尔酮为原料制备的查尔酮二氢化衍生物可作为甜味剂,有些查尔酮衍生物还常被用作屏保和液晶显示材料[1],还有文献报道查尔酮的共轭效应使其电子流动性非常好, 且具有不对称的结构, 所以是优越的有机非线性光学材料, 可以作为光储存、光计算、激光波长转换材料[6,7]。此外, 查尔酮还可用作光化学中的光交联剂、荧光材料和液晶材料等[8,9]。除此之外查尔酮还是一种重要的有机合成中间体, 可用于香料和药物[10]等精细化学品的合成。
超分子化学已经成了一门新兴的学科,有些查尔酮可被用于修饰冠醚、环糊精等,形成高分子化合物而具有特殊功能。如:李廷盛等合成了一类新的查尔酮冠醚作为中性活性载体,制备了PVC钾离子选择性电极,并测定了他们的电极性能[7]。还有解宏智等合成了用查尔酮修饰的β-环糊精衍生物[11]。这种环糊精衍生物在水中能实现强烈的自包结作用,这种自包结的构象形式将对金属离子的配位产生影响。王辉等合成的二甲氨基查尔酮为荧光发色团[12]。
目前,查尔酮衍生物的合成方法越来越多,但是主要是以取代苯乙酮与取代苯甲醛在碱性醇溶液中或以强酸为催化剂进行缩合反应得到[13]。另外还有多种合成查尔酮的新方法如金属化合物催化合成[14,15]、微波超声波催化合成[16]、相转移催化剂合成[17]、绿色合成[18]等。随着科学研究不断地进展,合成查尔酮及其衍生物的方法越来越多,产率也越来越高。查尔酮的经典合成方法是使用强碱如醇钠,或者强酸来催化苯乙酮和苯甲醛的羟醛缩合,收率10%~70%。本文探索对甲苯磺酸催化合成查尔酮衍生物的最佳反应条件,其收率达71.6%。
1 实验部分
1.1 仪器与试剂
苯乙酮,对甲苯磺酸,乙酸等均为分析纯;间硝基苯甲醛为实验室自制;富里叶变换红外光谱仪(Nicol-360型,美国尼高利公司)、SB-2A型薄层色谱仪(天津市天分分析仪器)、DF-101S集热式恒温加热磁力搅拌器(巩义市英峪予华仪器厂)、ZK-82A型真空干燥箱(上海市实验仪器总厂)、BS 110 S电子天平(北京赛多利斯天平有限公司)。
1.2 合成原理
一分子的苯乙酮与一分子的间硝基苯甲醛在冰醋酸为溶剂,对甲苯磺酸为催化剂,在 70 ℃下进行反应生成目的产物查尔酮。反应式如下:
1.3 实验方法
在50 mL圆底烧瓶中加入1.5 g的间硝基苯甲醛,然后再加入20 mL 冰醋酸,在磁力搅拌下,使间硝基苯甲醛完全溶解,加入1.3 mL 苯乙酮,再加入3 g对甲苯磺酸,在70 ℃下反应3 h后,实验结束,冷却结晶把烧瓶中的物质倒入装有蒸馏水中,溶液有类似沸腾状的现象出现,沉淀和混合溶液都是浅黄色,然后用氢氧化钠溶液进行中和,使其达到pH=7。然后进行抽滤、洗涤,干燥后得到2.1 g浅黄色的粗查尔酮衍生物,工业乙醇重结晶,产率83.6%。
2 结果与讨论
2.1 缩合反应的影响因素
2.1.1 温度的影响
温度是影响反应生成查尔酮的重要的因素。从表1可知,当反应时间、乙酸量、催化剂量一定时,温度较低,降低了催化剂的活性,反应完全所需要的时间比较长。所以反应时间一定时所得到的反应产物较少;温度较高,副反应增多,从而使反应的产率降低;综上所述,最佳反应温度为70 ℃。

表1 温度对查尔酮衍生物产率的影响Table 1 Effect of the reaction temperature on yield
2.1.2 反应时间的影响
从表2可知,当反应温度、乙酸量、催化剂量一定时,反应的时间短,反应不完全,反应产物随时间的增加而不断的增加;而反应时间比较长,反应的产物随时间的增加而降低;出现的减少的趋势是由于随着反应时间的不断增加副反应产物也不断地增加,从而减少了主反应产物的量。综上所述,最佳反应时间为3 h。
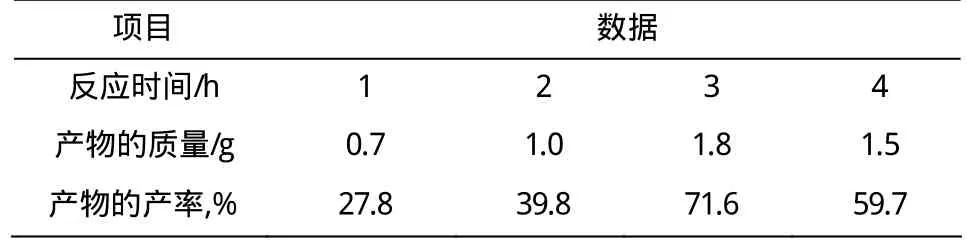
表2 时间对查尔酮衍生物产率的影响Table 2 Effect of the reaction time on yield
2.1.3 溶剂乙酸量的影响
从表3可知,反应温度、反应时间、催化剂量一定时,乙酸的量较少时,反应物的溶解速度慢,反应完全所需要花的时间比较长;乙酸的量较多,反应物被稀释,反应所需的时间也比较长;综上所述,乙酸的最佳用量为20 mL。

表3 溶剂量对查尔酮衍生物产率的影响Table 3 Effect of the dosage of solvent on yield
2.1.4 催化剂量的影响
由表4可知,反应温度、反应时间、乙酸量一定,对甲苯磺酸的量较少,反应不完全产率低;对甲苯磺酸的量比较多,溶液量比较多,反应物浓度太低,反应速率小,所以反应也不完全产率不高;综上所述,催化剂的最佳用量为3 g。
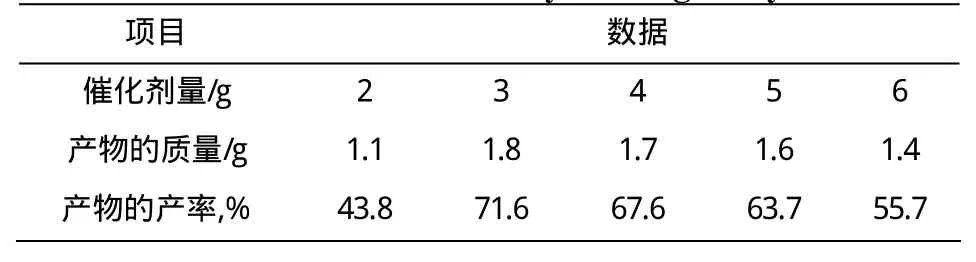
表4 催化剂对查尔酮衍生物产率的影响Table 4 Effect of the catalyst dosage on yield
2.2 红外光谱分析
产物经IR(KBr压片)测定: 1 527.07,1 354.70 cm-1吸收峰是硝基的伸缩振动;3 065.09 cm-1吸收峰是苯环C-H键的伸缩振动;1 659.19 cm-1是羰基键C=O的伸缩振动;777.90, 685.08 cm-1吸收峰归属于Ar-H面外弯曲振动,说明有间位取代苯的存在;1 440.88,1 500.27, 1 606.83 cm-1。
吸收峰归属于苯环C=C键的面内振动;731.49 cm-1吸收峰归属于 Ar-H面外弯曲振动,说明有单取代苯存在;与标准图谱吸收峰的位置及强度一致。综上所述,可以判定产物为查尔酮。
3 结 论
查尔酮类化合物作为一种多活性化合物,在医药、生物、化工等领域都将有广阔的发展前景,对查尔酮类化合物的研究将越来越多地受到人们的关注和重视。选择合适的催化剂是加快反应速度的重要因素,查尔酮的经典合成方法是使用强碱如醇钠,或者强酸来催化苯乙酮和苯甲醛的羟醛缩合,收率10%~70%。而本文在最佳反应条件下:n(苯乙酮)/n(间硝基苯甲醛)=1∶1,反应温度是70 ℃,反应的时间3 h,对甲苯磺酸为3 g,乙酸用量为20 mL,在此条件下查尔酮的收率达83.6%。
[1]曾平莉,王东,冯驸. 查尔酮的合成应用研究进展[J].化工生产与技术,2005,12(3):23-25.
[2] Laliberte R. Anthelmintic activihes of chalcone sand related compounds[J].Can J pharm Sci.,1967,2(2):37-43.
[3] De Vincenzo R, Ferlinic, Distefano M,et al.In vitro evaluation of newly developed Chalcone analogues in human cancer cells [J].Cancer chemother Pharmacol,2000,46(4):305-312.
[4]何克勤,程桂芳. 查尔酮类化合物对过敏性慢反应物质拮抗作用的构效关系[J].药学学报,1996,(11):878-880.
[5]张彦文,郭宗儒. 查尔酮类化合物的药理作用和构效关系[J].国外医学分册,1996,23(4):218-222.
[6] Martinc R. Struc ture, function, and regu lation of the cha lcone synthease [J].1993, 147: 233-284.
[7]方正, 唐伟方, 徐芳. 萘丁美酮的合成工艺改进[J].中国药科大学学报,2004, 35(1) : 90-91.
[8]楼定忠, 朱坡, 刘泽贵. 萘丁美酮合成路线图解[J].中国医药工业杂志,1996, 27(5) : 238-239.
[9]艾亨俭, 李文玉. 萘普酮的又一合成法[J].中国医药工业杂志,1985,16(11): 509-510.
[10]刘宝殿, 张志德, 孙云鸿.有机锡化合物在有机合成中应用的研究,查耳酮类化合物的合成[J].东北师范大学学报:自然科学版,1989(4): 41-50.
[11]解宏智,孙照勇,张兴康,等.查尔酮修饰β一环糊精与过渡金属离子间相互作用[J].化学学报,2001,59(5):793-798.
[12]王辉,梅明华,解宏智,等.二甲氨基查尔酮修饰的β-环糊精在不同溶剂中的光物理行为[J].物理化学学报,2002,18(6):495-499.
[13]郭宏雄,臧庶声,李文科,等.查尔酮的制备[J].兰州医学院学报,1998,24(2):12-13.
[14]陆文兴,颜朝国,顾惠芬.查尔酮的 KF—A12O3,催化合成[J].化学试剂.1995,17(4):253-254.
[15]李良助,赵志刚,袁音芳,等.应用芳基锂合成查尔酮[J].高等学校化学学报,1992,13(8):1071-1074.
[16]Li J T,Yang W Z,Wang S X,et a1.Improved synthesis of chalcones under ultrasound irradiation [J].Ultrasonic Sonochem,2002,9:237-239.
[17]蒋新宇, 赵爱丽. 聚乙二醇相转移催化法合成查尔酮[J]. 广州化工,2006, 31(3):126-129.
[18] 段宏昌, 姜恒, 宫红. 查尔酮衍生物的绿色合成[J].中国药业,2006, 15(15): 30-31.
Synthtsis of Chalcone Catalyzed by P-toluenesulfonic Acid
TAN Chang-hui,ZHENG Rong-xuan,LUO Shu-yun,XIN Qiao-yan
(Department of Chemistry and Enviromental Science, Zhangzhou Normal University, Fujian Zhangzhou 363000, China)
Synthesis methods of chalcone were studied, affecting factors of the condensation reaction were discussed so as to select the best reaction conditions. The experimental results show that the better reaction conditions of the synthesis are as follows:n(m-nitrobenzaldehyde) /n(preparation) = 1∶1, the reaction temperature is 70 ℃, the reaction time is 3 h, p-toluene sulfonic acid dosage and acetic acid dosage are 3 g and 20 mL , respectively. Under above conditions, the chalcone yield can reach 71.6%.
m-Nitrobenzaldehyde; Benzaldehyde; Chalcone
TQ 203
A
1671-0460(2012)01-0023-03
2011-10-28
谭昌会(1977-),女,四川广安人,副教授,博士,2005年毕业于吉林大学有机化学专业,研究方向:有机合成。E-mail:tanchh@163.com。

