基于UPLC/Q-TOF-MS不同比例人参配伍藜芦增毒的物质基础及动物毒性关联性研究
杨 亮, 王宇光, 梁乾德, 刘浩生, 马增春, 肖成荣,谭洪玲, 汤响林, 张伯礼, 高 月
(1.安徽医科大学研究生学院,安徽 合肥 230032; 2.军事医学科学院放射与辐射医学研究所药理毒理研究室,北京 100850;3.天津中医药大学,天津 300193)
2012-04-26;
2012-07-10
国家重点基础研究发展计划(批准号:2011CB505304,2012CB518402), 国家自然科学基金(批准号:81073149), 北京市自然科学基金(批准号:7112110)资助
杨 亮(1989~),男,硕士研究生,中药药理学专业。E-mail: yangliang19890322@163.com
王宇光,男,从事中药药理学研究。E-mail:wang-yuguang@139.com
高 月,女,博士,研究员,从事中药药理毒理研究。E-mail: gaoyue@nic.bmi.ac.cn
基于UPLC/Q-TOF-MS不同比例人参配伍藜芦增毒的物质基础及动物毒性关联性研究
杨 亮1,2, 王宇光2, 梁乾德2, 刘浩生1, 马增春2, 肖成荣2,谭洪玲2, 汤响林2, 张伯礼3, 高 月2
(1.安徽医科大学研究生学院,安徽 合肥 230032; 2.军事医学科学院放射与辐射医学研究所药理毒理研究室,北京 100850;3.天津中医药大学,天津 300193)
通过小鼠的急性毒性实验,探索中药十八反中藜芦与人参药对不同配比时毒性变化趋势,结合超高效液相色谱-四极杆-飞行时间质谱联用技术(UPLC/Q-TOF-MS)对不同配比对应的毒性成分进行分析,采用MassLynx4.1分析软件,结合主成分分析(PCA)及正交偏最小二乘法判别(OPLS-DA)分析生物碱类成分变化。固定藜芦用量时,藜芦与人参在不同配比情况下小鼠死亡率随人参剂量增大呈下降趋势,藜芦酰棋盘花胺、3-当归酰棋盘花胺、红介芬胺、计米亭碱、藜芦胺和3-藜芦酰基计明碱等生物碱含量在不同配比中的变化趋势与动物毒性变化一致。以上几种生物碱在藜芦与人参合用时可能是毒性效应的关键成分,能够反映配伍毒性的变化趋势。
藜芦;人参;急性毒性;UPLC/Q-TOF MS
中药成分复杂,自古人们对其探索的最大难点就是其化学本质,中药复方更是如此,但中药在临床上应用十分广泛。中药十八反是中药理论中重要组成部分,其配伍禁忌一方面限制了中药在临床上的应用,同时也给中药蒙上了一层神秘的面纱[1-2]。藜芦与人参就是中药十八反中非常重要的一对相反药对。藜芦有大毒,在中药复方中主要用于催吐,在临床使用时相当谨慎;人参是常见的补气药,也是名贵药材,享有“东北三宝”的美誉,但是受传统中药“十八反”理论的影响,限制了其临床使用[3-6],因此探究其相反作用的物质基础,并在化学层面上弄清二者不同配比对其毒性成分溶出和毒性影响的规律,对理解相关中药配伍禁忌和临床应用都有重要意义。目前研究藜芦化学成分的文献并不少见[7-10],藜芦中主要的毒性来源为其生物碱类,因此对生物碱类成分变化研究显得尤为关键。
本实验是在前期两味单药急性毒性实验结果的基础上进行的,即藜芦半数致死量(LD50)为2.566 g/kg,人参最大耐受量(MTD)为80 g/kg。首先固定藜芦用量,将藜芦与人参不同配比的水煎液进行小鼠的急性毒性实验,并对上述水煎液对应进行物质基础分析,即在两个层面上设计本实验:一方面考察藜芦与人参在不同配比时的动物毒性变化趋势,另一方面利用超高效液相色谱-飞行时间电喷雾质谱技术(UPLC/Q-TOF MS)分析毒性成分的变化规律,再结合主成分分析(PCA)及正交偏最小二乘法判别分析(OPLS-DA)[11-13],在化学层面上分析藜芦与人参在不同配比情况下毒性成分的变化规律,将毒性效应与毒性成分变化进行对应性研究[14-15],希望从中发现藜芦与人参配伍相反的规律及发挥毒性的物质,以期为临床合理应用相关药物提供参考。
1 试验部分
1.1试剂和仪器
1.1.1实验材料 KM小鼠雌雄各110只,18~22 g,6~8周龄,由军事医学科学院实验动物中心提供[合格证号:SCXK-(军)2007-004]。
藜芦:购自安徽丰原铜陵中药饮片公司,产自长春华家;人参:购自吉林银河参业科技开发有限公司,产自吉林抚松。均经军事医学科学院放射与辐射医学研究所马百平教授鉴定,分别为百合科藜芦属植物藜芦VeratrumnigrumLinn.的干燥根和五加科人参属植物人参PanaxginsengC.A. Mey.的干燥根。
1.1.2实验仪器 Acquity UPLC-Synapt MS色谱-质谱联用仪:美国Waters公司产品;Mass Lynx V14.1质谱工作站:美国Waters公司产品;Millipore Simplicity纯水仪;Herarus Labofuge 400R冷冻离心机;电子天平(BS 223S型):赛多利斯科学仪器(北京)有限公司产品;旋转蒸发器(RE52CS型):上海亚荣生化仪器厂产品;电子调温电热套(98-1-B型):天津市泰斯特仪器有限公司;电热恒温水浴锅:北京长安科学仪器厂产品;SHB-ⅢA循环水式多用真空泵:郑州长城科工贸有限公司产品。
1.1.3实验试剂 乙腈(色谱纯):购自Fisher Scientific公司;超纯水经Millipore纯水系统纯化;甲酸(HPLC级)[16]。
1.2实验过程
1.2.1供试样品的制备 藜芦、人参按一定量精确称重混合,加入700 mL蒸馏水,浸泡1 h后煎煮,微沸1 h提取滤液,3层纱布过滤。称量滤液,第二煎加入与第一煎得到的滤液等量的蒸馏水,煎煮1 h后用3层纱布过滤提取煎液,合并两次滤液,即为藜芦人参的合煎液;将上述水煎液置于无菌容器中待动物急性毒性实验用。
将上述制备的煎液静置,以13 000 r/min离心10 min,取上清液,经0.22 μm微孔滤膜过滤后,于4 ℃保存,待成分分析检测。各组的实验用量分布列于表1。
1.2.2急性毒性实验 KM小鼠适应2~3天后,随机分成A、B、C、D、E、F、G、H、I、J、K共11组,分别对应藜芦、人参的配比药对10∶1、8∶1、6∶1、4∶1、2∶1、1∶1、1∶2、1∶4、1∶6、1∶8、1∶10,给药前12 h禁食不禁水,精确称重后,按照0.4 mL/10 g口服给药,观察两周,并记录小鼠临床表现和死亡情况。

表1 各组动物实验所用的藜芦、人参的不同配比
1.2.3物质成分分析实验 采用Waters Acquity BEH C18(100 m×2.1 mm×1.7 μm)色谱柱;柱温45 ℃,流速0.5 mL/min,进样量5 μL;流动相A:0.1%甲酸水溶液;流动相B:0.1%甲酸乙腈溶液;正离子模式,梯度洗脱(0~1.0 min:2%B;1.0~2.0 min:2%~5%B;2.0~5.0 min:5%~20%B;5.0~7.0 min:20%~30%B;7.0~10.0 min:30%~33%B;10.0~13.0 min:33%~36%B;13.0~17.0 min:36%~40%B;17.0~18.0 min:40%~100%B;18.0~19.0 min:100%~2%B;20.0 min:2%B)。
采用电喷雾电离离子源(ESI),正离子模式检测;质量扫描范围:m/z100~1 200;毛细管电压3 kV;锥孔电压30 V;离子源温度100 ℃;雾化温度450 ℃;壳气流速900 L/h;以亮氨酸-脑啡肽进行精确质量校正([M+H]+556.277 1)。
液质联用数据采用Waters公司提供的Marker Lynx 4.1软件进行峰提取、峰对齐及归一化等处理,利用PCA和OPLS-DA找出各组之间化合物指纹图谱的差异,结合标准品和质谱数据库检索,对潜在的化学标记物进行快速鉴定。
2 结果与讨论
2.1实验结果
2.1.1急性毒性实验 固定藜芦用量为2.566 g/kg,按藜芦、人参10∶1~1∶10水煎液进行小鼠急性毒性实验,结果列于表2。
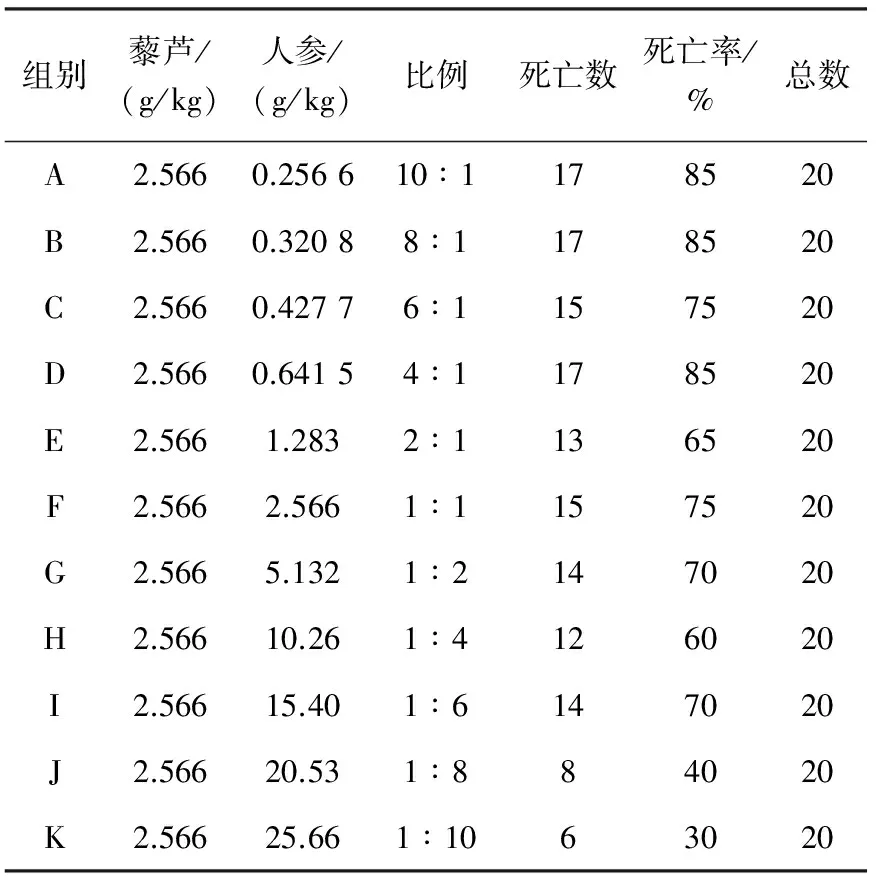
表2 藜芦、人参不同配比动物实验结果
2.1.2物质成分分析实验 将上述10∶1~1∶10水煎液进行动物毒性实验同时,对应地进行各组水煎液的物质成分分析,经过MassLynx4.1分析软件,结合主成分分析及正交偏最小二乘法判别对差异成分进行了鉴定,将差异成分在总离子流图中做出标记,示于图1。为了更清晰的表明毒性成分与毒性趋势的相关性,将两种药物A~K组合煎液在正离子模式下检测得到的差异成分化合物示于图2,用正交偏最小二乘法得到的差异成分鉴别结果示于图3。其中化合物5和6尚不能准确区分,化合物7未能鉴定。动物死亡趋势图示于图4。主要的差异物质离子流提取及质谱图示于图5。
实验分析中涉及到的化合物经过MHDB数据库的检索以及参考相关文献得到[17-19]。将各组总分析成分列于表3,A组与K组分析成分单独列于表4。
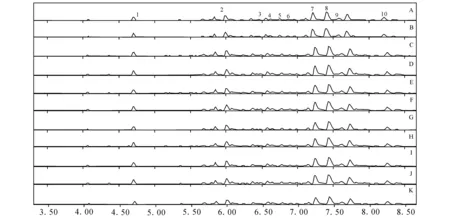
注:A.10∶1; B.8∶1; C.6∶1, D.4∶1; E.2∶1; F.1∶1; G.1∶2; H.1∶4; I.1∶6; J.1∶8; K.1∶10图1 藜芦人参不同配比正离子模式总离子流图Fig.1 The total ion chromatogram of veratrum nigrum and ginseng with different ratio

图2 藜芦人参合煎液A~K组正离子模式下差异成分化合物Fig.2 Selected ion intensity trend plots analyzed using Marker lynx 4.1 software

图3 人参藜芦合煎液A~K组正离子 图4 藜芦人参不同配比动物死亡趋势图模式下正交偏最小二乘法差异成分鉴别 Fig.4 The chart of death tendency from A to K Fig.3 OPLS-DA/Scores plot from A to K of ginseng and veratrum nigrum obtained using Pareto scaling with mean centering
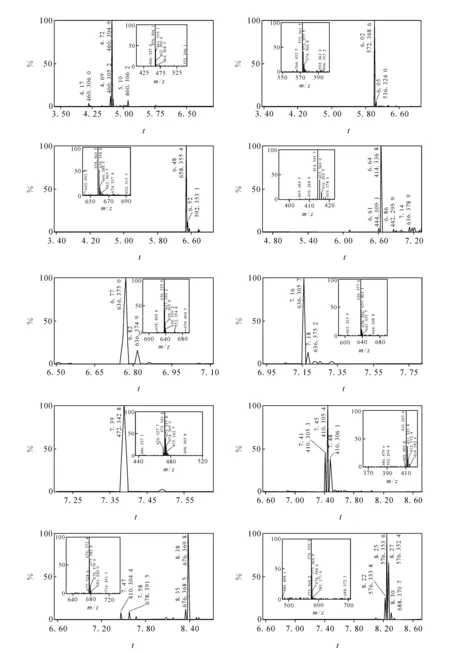
图5 藜芦人参不同配比的主要差异物质正离子模式离子流图Fig.5 The ion chromatogram of main toxicity component from veratrum nigrum and ginseng with different ratio
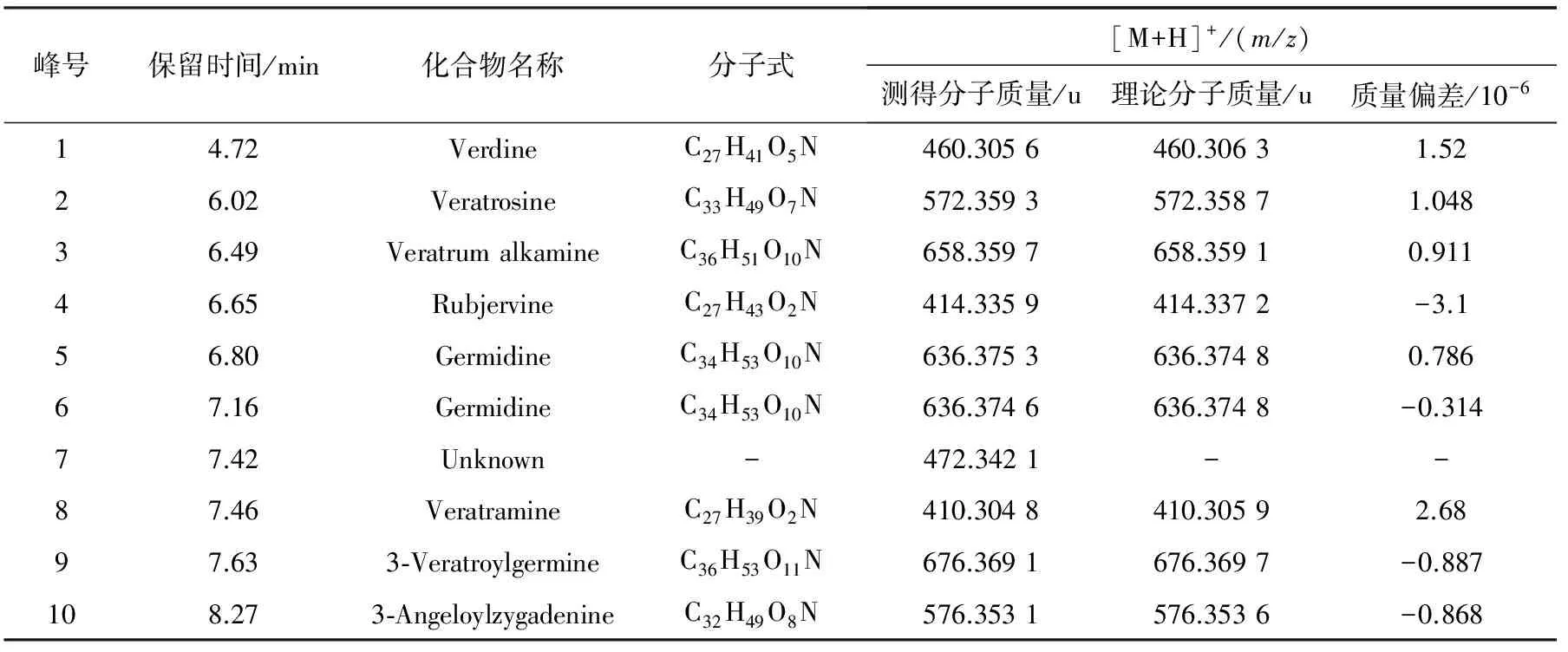
峰号保留时间/min化合物名称分子式[M+H]+/(m/z)测得分子质量/u理论分子质量/u质量偏差/10-614.72VerdineC27H41O5N460.3056460.30631.5226.02VeratrosineC33H49O7N572.3593572.35871.04836.49VeratrumalkamineC36H51O10N658.3597658.35910.91146.65RubjervineC27H43O2N414.3359414.3372-3.156.80GermidineC34H53O10N636.3753636.37480.78667.16GermidineC34H53O10N636.3746636.3748-0.31477.42Unknown-472.3421--87.46VeratramineC27H39O2N410.3048410.30592.6897.633⁃VeratroylgermineC36H53O11N676.3691676.3697-0.887108.273⁃AngeloylzygadenineC32H49O8N576.3531576.3536-0.868

表4 A组与K组人参藜芦合煎液的正离子模式下的分子离子峰鉴别
2.1.3A组与K组分析结果 为了进一步挖掘毒性成分的变化,选取藜芦与人参配伍比例差异最大的两组,也是毒性效应差别最为明显的A组和K组进行分析,试图进一步探究毒性成分与毒性趋势的相关性。其中物质成分差异图示于图6~8,各配伍组对应的动物毒性趋势图示于图9。
2.2讨论
人参与藜芦作为中药十八反中的重要药对,要想真正弄清其在体内代谢及发挥药效的有效成分,必须研究其物质成分与毒性的关联性。
在小鼠的急性毒性实验中,固定藜芦用量,当人参剂量较低时,小鼠死亡率较高,随着人参剂量增大,小鼠死亡率呈下降趋势。说明人参与藜芦配伍时人参比例较小时毒性增大,随着人参比例增加毒性下降。提示配伍禁忌不是绝对的,与二者用量有密切关系,人参用量大时,可能还会有减毒作用产生。
在物质成分分析实验中[20],分析了从A组(藜芦:人参=10∶1)到K组(藜芦:人参=1∶10)的物质成分变化,其中藜芦酰棋盘花胺、3-当归酰棋盘花胺、红介芬胺、计米亭碱、藜芦碱和3-藜芦酰基计明碱等随着人参比例增大含量下降,与动物实验结果相吻合,也说明这些成分在药物发挥毒性效应中起到重要作用。然后选取了配伍比例相差最大的A组和K组进行分析,这两组也是毒性效应差别最大的两组。结果显示,A组中藜芦新碱、计米亭碱、藜芦胺和3-当归酰棋盘花胺的含量明显高于K组。

图6 藜芦人参合煎液A组与K组正离子模式下正交偏最小二乘法差异成分鉴别Fig.6 OPLS-DA/Scores plot between A and K of ginseng and veratrum nigrum obtained using Pareto scaling with mean centering
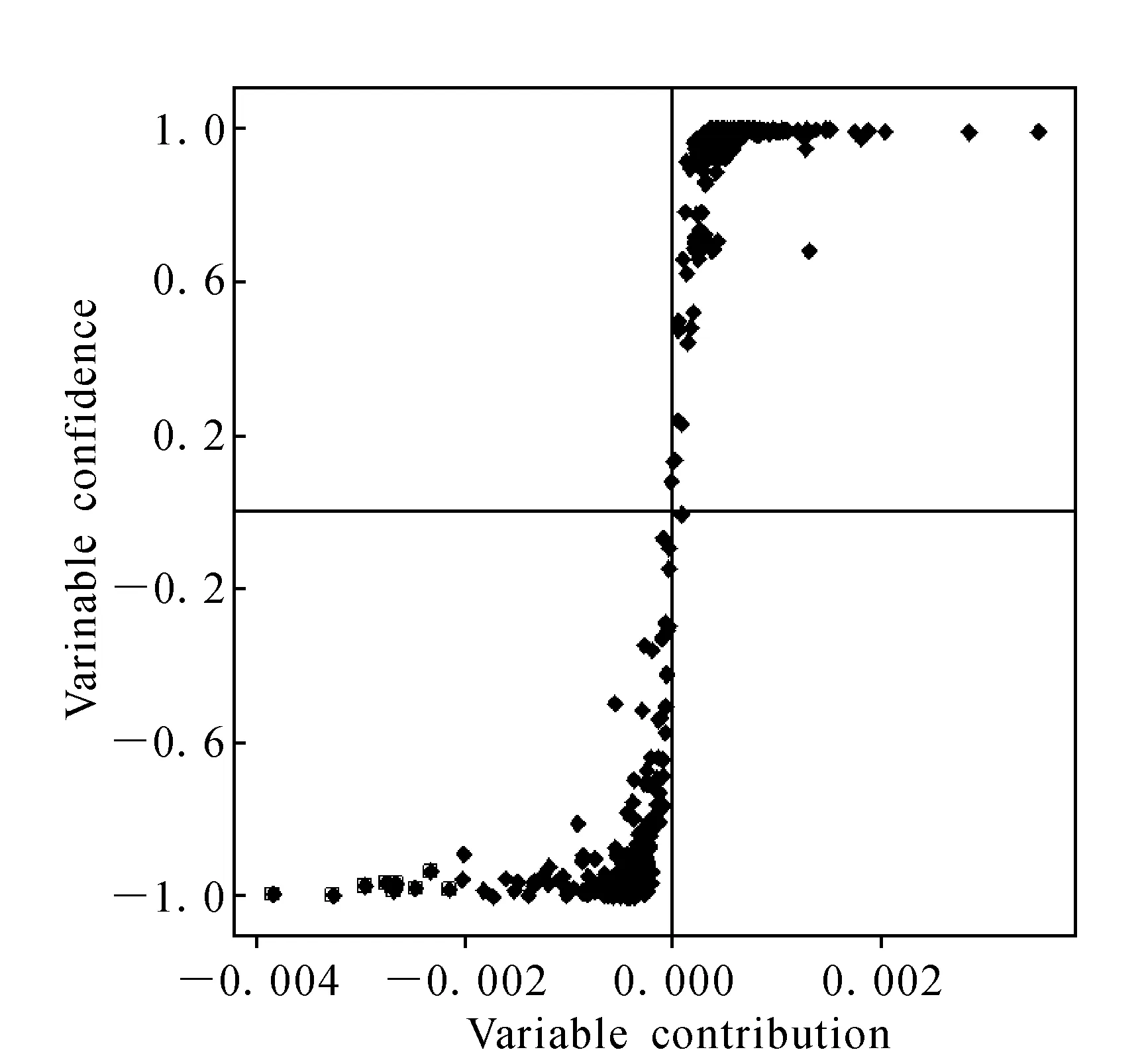
图7 藜芦人参合煎液A组与K组正离子模式下正交偏最小二乘法差异成分的S曲线Fig.7 OPLS-DA/S-Plot between A and K ginseng and veratrum nigrum obtained using Pareto scaling with mean centering

图8 藜芦人参合煎液A组与K组正离子模式下差异成分化合物Fig.8 Selected ion intensity trend plots analyzed using Marker lynx 4.1 software

图9 藜芦人参合煎液A组与K组动物死亡趋势 Fig.9 The chart of death tendency between A and K
综合考虑两部分实验结果:藜芦中含有的毒性生物碱很多,与人参配伍后,部分生物碱的含量在人参加入量较小时增大明显,随着人参加入量增大含量下降。反应在动物急性毒性实验上,即人参量小死亡率高,人参量大死亡率下降。因此在临床上,中药的剂量与毒性之间存在一定的关联性,同时毒性成分的变化可能是影响到动物死亡率变化的重要因素,这为进一步进行体内检测提供了线索。
[1] 王宇光,高 月. 中药十八反药理毒理研究进展[J]. 中国实验方剂学杂志,2003,9(3):60-63.
[2] 龚 雪,王 建,王 琼,等.“诸参”叛藜芦的实验研究概述[J]. 山东中医药大学学报, 2007,31(6):523-525.
[3] 王 斌,李慧梁,汤 建,等. 藜芦的黄酮类化学成分研究[J]. 药学服务与研究,2007,7(5):347-349.
[4] 张 旭,宋凤瑞,王隶书,等. 人参与藜芦配伍化学成分变化的HPLC-ESI-MS与ESI-MS研究[J]. 化学学报,2007,65 (9):829-833.
[5] 聂利月,汤 建,李慧梁,等. 兴安藜芦乙酸乙酯部位化学成分的研究[J] .中国药学杂志,2008,43(13):971-973.
[6] KAUFMAN A, BUTCHER P, MADEN K, et al.
Ultra-performance liquid chromatography coupled to time of fight mass spectrometry (UPLC-TOF): A novel tool for multiresidue screening of veterinary drugs in urine Kathryn [J].maden Analytica Chimica Acta, 2007, 586:13-21.
[7] 王 斌. 藜芦的化学成分研究[D]. 上海:第二军医大学, 2007.
[8] 闻伟锋. 乌苏里藜芦化学成分研究[D].大连:大连理工大学,2006.
[9] 周雪峰. 乌苏里藜芦化学成分分离与鉴定[D].大连:大连理工大学,2010.
[10] 吕轶峰. 狭叶藜芦的化学成分研究及部分生物碱的生物转化[D].沈阳:沈阳药科大学,2008.
[11] LI S L, SONG J Z, QIAO C F, et al. A novel strategy to rapidly explore potential chemical markers for the discrimination between raw and processedRadixRehmanniaeby UHPLC-TOFMS with multivariate statistical analysis[J].Journal of Pharmaceutical and Biomedical Analysis, 2009, 51(4): 812-823.
[12] 梁爱葵,于 艳,杨洪武,等.藜芦与人参三七洋参配伍后藜芦定的含量变化研究[J].辽宁中医杂志,2012,39(5):908-909.
[13] TETTEY-AMLALO R N O, KANFER I. Rapid UPLC-MS/MS method for the determination of ketoprofen in human dermal microdialysis samples[J]. Journal of Pharmaceutical and Biomedical Analysis, 2009,50:580-586.
[14] 宿树兰, 段金鳌, 李文林,等. 基于物质基础探讨中药“十八反”配伍致毒/增毒机制[J].中国实验方剂学杂志,2010,16(1):123-129.
[15] 王辰允, 叶 璇, 王宇光,等. 人参与藜芦合用对CYP1A酶活性的影响[J].解放军药学学报,2010,26(2):104-106.
[16] 王宇光 ,王 超, 梁乾德,等.十八反中藜芦与人参配伍化学成分变化的UPLC/Q-TOF MS研究[J] .中国科学,2011,41(10): 925-932.
[17] YUE H, PI Z F, SONG F R, et al. Studies on the aconitine- type alkaloids in the roots ofAconitumCarmichaeliDebxby HPLC/ESIMS/MSn[J]. Talanta, 2009, 77: 1 800-1 807.
[18] ZHENG X T, SHI P Y, CHENG Y Y, et al. Rapid analysis of a Chinese herbal prescription by liquid chromatography-time-of fight tandem mass spectrometry[J]. Journal of Chromatography A, 2008, 1 206: 140-146.
[19] 孟宪生,康廷国, 叶挺祥,等. 中药细辛与藜芦配伍化学成分变化的UPLC/Q-TOF MS研究[J].中华中医药杂志, 2010,28(4):754-759.
[20] 杨瑞杰,李绪文,张培旭,等.离子液体均匀提取-高效液相色谱法测定参附注射液中4中单酯型乌头碱的含量[J].高等学校化学学报,2011,32(12):2 752-2 756.
UPLC/Q-TOF-MSBasedtheDiversityofToxiferousCompositionoftheToxicityofAnimalsandinDifferentCombinationofVeratrumNigrumandGinseng
YANG Liang1,2, WANG Yu-guang2, LIANG Qian-de2, LIU Hao-sheng1, MA Zeng-chun2, XIAO Cheng-rong2, TAN Hong-ling2, TANG Xiang-lin2, ZHANG Bo-li3, GAO Yue2
(1.GraduateSchoolofAnHuiMedicalUniversity,Hefei230032,China; 2.InstituteofRadiationandIrradiationMedical,AcademyofMilitaryMedicalSciences,Beijing100850,China; 3.TianjinUniversityofTraditionalChineseMedicine,Tianjin300193,China)
In order to study toxicity changes in different matching between the herbal ginseng and veratrum nigrum of eighteen incompatible medication in traditional medicine, the acute toxicity of mice treated with veratrum nigrum-ginseng combination of the eighteen incompatibal (Shi Ba Fan) was explored. UPLC/TOF-MS with Principal Components Analysis (PCA) were used to analyze the same samples used in acute toxic experiment. The results showed that death rate of mice was decreased in the rise of compatibility of ginseng with fixed dose of veratrum nigrum, toxicity alkaloid series such as veratrosine, veratrum alkamine, 3-angeloylzygadenine, germidine, veretramine, rubijervine were also increased. Therefore, above alkaloid series may be key factors contributed to the poisoning effect of ginseng combined with veratrum nigrum.
veratrum nigrum; ginseng; acute toxicity; UPLC/Q-TOF-MS
O 657.63
A
1004-2997(2012)05-0257-08
——碳正离子的产生及稳定性比较

