Nephrin稳定血管紧张素Ⅱ诱导的足细胞细胞骨架改变的机制研究*
梁 伟, 任志龙, 韦忠平, 刘以鹏, 陈 铖, 丁国华
(武汉大学人民医院肾内科,湖北 武汉 430060)
1000-4718(2012)12-2216-06
2012-08-01
2012-10-17
国家自然科学基金资助项目(No.81100478;No.30900688;No.30871167);中央高校基本科研业务费专项资金(No.111031)
△通讯作者Tel: 027-88041911-82144;E-mail: ghxding@gmail.com
Nephrin稳定血管紧张素Ⅱ诱导的足细胞细胞骨架改变的机制研究*
梁 伟, 任志龙, 韦忠平, 刘以鹏, 陈 铖, 丁国华△
(武汉大学人民医院肾内科,湖北 武汉 430060)
目的研究足细胞裂孔膜分子nephrin调节血管紧张素Ⅱ(AngⅡ)诱导的足细胞骨架分布改变的分子机制。方法用AngⅡ及AngⅡ受体拮抗剂氯沙坦或Akt抑制剂LY294002刺激足细胞,FITC-phalloidin染色标记F-actin,分析足细胞骨架运动。Real-time RT-PCR、RT-PCR和Western blotting检测nephrin mRNA和蛋白表达。转染nephrin全长表达质粒(pcDNA3.1-mNPHS1),建立稳定转染足细胞系,Western blotting检测转染细胞的Akt磷酸化水平,FITC-phalloidin染色分析高表达nephrin对F-actin分布影响。结果AngⅡ和LY294002刺激后,足细胞的F-actin重组,应力纤维减少,形成F-actin外周环。氯沙坦显著抑制F-actin重排。AngⅡ刺激后nephrin mRNA和蛋白表达显著降低,Akt磷酸化水平降低。pcDNA3.1-mNPHS1转染显著上调足细胞Akt磷酸化水平,促进足细胞短线状足突形成,部分抑制AngⅡ诱导的骨架重排。结论PI3K/Akt是nephrin和AngⅡ的共同下游通路。Nephrin能通过PI3K/Akt途径部分稳定AngⅡ诱导的足细胞细胞骨架改变。
血管紧张素Ⅱ; 足细胞; Nephrin; 细胞骨架
足细胞即肾小球脏层上皮细胞,足突是足细胞的特殊结构,足细胞通过足突锚定于肾小球基底膜,相邻足突分子相互交联形成裂孔隔膜结构(slit diaphragm,SD),是肾小球滤过膜分子屏障的重要结构基础[1]。Nephrin是第一个被发现定位于SD的足细胞特异分子,其编码基因NPHS1突变导致芬兰型先天性肾病综合征。在多种人类肾小球疾病和动物模型中存在nephrin表达和(或)分布异常,同时伴有足细胞表型改变,如足突融合[2]。肾素-血管紧张素系统(renin-angiotensin system,RAS)活性增加是慢性肾脏病进展和足细胞损伤的重要因素之一。血管紧张素Ⅱ(angiotensinⅡ,AngⅡ)作为RAS的主要效应分子,能通过血流动力学和非血流动力学多种途径引起肾小球损伤。课题组前期研究发现AngⅡ持续输注大鼠肾小球足细胞凋亡和足突融合,nephrin表达异常[3]。本文拟进一步用体外培养的小鼠足细胞(mouse podocyte cell line,MPC)研究nephrin在调节AngⅡ诱导足细胞骨架分布改变中的作用及机制。
材 料 和 方 法
1主要材料
胎牛血清(FBS,Gibco),小鼠重组干扰素 γ(interferon γ,IFN-γ;Protech),AngⅡ(Sigma),氯沙坦(Merk),Trizol RNA提取试剂(Invitrogen),第1链cDNA合成试剂盒(Toyobo),real-time RT-PCR Master Mix和SYBR Green I(上海闪晶),PCR Master Mix(MBI),豚鼠抗nephrin多克隆抗体(Progen),鼠抗β-actin单克隆抗体(Santa Cruz),FITC-phalloidin(Sigma),Akt抑制剂LY294002和抗p-Akt抗体(Thr308),兔抗Akt抗体(Cell Signal Technology)。小鼠nephrin全长表达质粒(pcDNA3.1-mNPHS1)由美国密歇根大学Holzman教授惠赠。
2方法
2.1细胞培养[4]小鼠永生化足细胞系由美国纽约Mount Sinai医学院 Peter Mundel教授惠赠,本实验室保存。在33 ℃、5% CO2培养箱中用含1×104U/L IFN-γ的培养基传代培养,在37 ℃、5% CO2培养箱中用不含IFN-γ的培养基培养分化7~14 d用于实验,实验前用1%FBS低血清培养基同步化12 h。
2.2FITC-phalloidin标记足细胞F-actin细胞骨架 弃培养基,4 ℃预冷PBS轻洗,0.1% Triton X-100+2%多聚甲醛,4 ℃冰上固定30 min弃上清, PBS轻洗,FITC-phalloidin(1∶1 000,1%DMSO稀释),4 ℃避光孵育过夜,PBS漂洗,PI复染(2 mg/L),室温避光孵育15min,PBS漂洗后,抗荧光淬灭甘油封片,荧光显微镜下观察,摄像。肌动蛋白外周环评分(cortical F-actin score,CFS)[5]:F-actin形成正常应力纤维,0分; F-actin外周环<1/2胞膜边缘,1分; F-actin外周环>1/2胞膜边缘,2分; F-actin形成完整外周环,3分;每个视野计数100个细胞,取平均值。
2.3蛋白印迹 预冷PBS清洗细胞后,加入RIPA裂解液,4 ℃、12 000×g离心10 min,收集上清,BCA法测定蛋白浓度,20~40 μg总蛋白SDS-PAGE电泳,转膜,5%脱脂奶粉封闭2 h,分别Ⅰ抗(抗p-Akt抗体、兔抗Akt抗体、豚鼠抗nephrin多克隆抗体和鼠抗β-actin单克隆抗体)4 ℃孵育过夜, TBST清洗,加入相应的辣根过氧化物酶标记的Ⅱ抗室温孵育1 h,TBST 洗膜,ECL化学发光试剂盒显色,X光胶片曝光、显影、定影,凝胶成像分析系统行密度扫描。
2.4pcDNA3.1-mNPHS1质粒转染和稳定转染细胞株筛选 用脂质体法转染pcDNA3.1-mNPHS1质粒,1∶10传代后,加入合适浓度(200 mg/L)G418筛选,挑选单克隆扩增培养,获得稳定转染细胞株。
2.5Real-time RT-PCR和RT-PCR法检测nephirn mRNA表达 Trizol法抽提细胞总RNA,M-MuLV逆转录酶逆转录合成第1链cDNA,送上海闪晶生物有限公司行real-time RT-PCR法检测nephrin mRNA表达,nephrin上游引物5’-ATGATGCGGAGTACGAGTGC-3’,下游引物5’-GGATGAAGATGATGTCAGGTGC-3’,扩增产物片段为210 bp;β-actin上游引物5’-GAGACCTTCAACACCCCAGC-3’,下游引物5'- ATGTCACGCACGATTTCCC-3’,扩增产物片段263 bp,引物由上海闪晶生物有限公司合成。双标准曲线法分析nephrin mRNA表达水平,用各组与对照组nephrin拷贝数比值表示nephrin相对含量。RT-PCR法检测pcDNA3.1-mNPHS1质粒转染后nephrin mRNA,nephrin上游引物5’-CCCAACACTGGAAGAGGTGT-3’,下游引物5’-CCCCTTGGGTCCTCATATTTT-3’,扩增产物片段为198 bp;β-actin上游引物5’-AGCCATGTACGTAGCCATCC-3’,下游引物5'-TCTCAGCTGTGGTGGTGAAG -3’,扩增产物片段227 bp。扩增条件为:预变性94 ℃ 3 min,94 ℃ 30s,53.5 ℃ 30 s,72 ℃ 30 s。共30个循环,延伸2 min。扩增产物琼脂糖凝胶电泳,摄片。
3统计学处理
结 果
1AngⅡ对足细胞形态影响
正常足细胞在亚融合状态下,细胞伸出较多足突,多呈线状伪足,见图1A白色箭头所示;AngⅡ(10-8mol/L)刺激后细胞足突回缩,胞体变圆,足突呈片状伪足,见图1B黑色箭头所示。
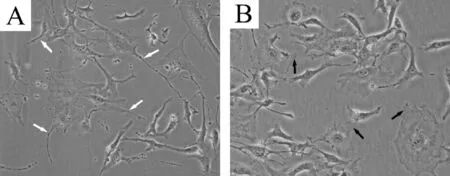
Figure 1. Podocyte morphology under inverted phase-contrast microscope(×400). A: normal podocytes; B: podocytes exposed to AngⅡ. White arrows indicate filopodia, and black arrows indicate lamellipodia.
图1倒置相差显微镜下足细胞形态
2AngⅡ对足细胞F-actin分布的影响
正常足细胞F-actin聚集成束,呈微丝样结构,沿细胞长轴分布,形成应力纤维,见图2A,AngⅡ刺激后F-actin发生重组,排列紊乱,微丝样结构消失,F-actin沿胞体外周分布,形成F-actin环,见图2B~E。如图2G所示随着AngⅡ刺激时间延长,形成F-actin外周环细胞逐渐增多,外周环评分逐渐增高,差异有统计学意义(P<0.05)。
3氯沙坦对AngⅡ诱导足细胞F-actin重排的影响
AngⅡ受体特异性拮抗剂氯沙坦提前预处理1 h后与AngⅡ共孵育18 h,能显著抑制F-actin重排,降低外周环评分,见图2F、H。
4AngⅡ对足细胞nephrin表达的影响
AngⅡ刺激12 h后nephrin mRNA较对照组显著降低,刺激24 h后nephrin mRNA约为正常对照的50%,差异有统计学意义(P<0.05),见图3A。AngⅡ刺激6 h后nephrin蛋白水平较对照组显著降低(P<0.05),并呈时间依赖性降低,见图3B。


图2AngⅡ和氯沙坦对足细胞F-actin分布的影响
5抑制Akt活性对足细胞F-actin分布的影响
正常足细胞F-actin呈束状沿细胞长轴分布,形成应力纤维;Akt抑制剂LY294002(50 μmol/L)孵育6 h后,部分足细胞应力纤维结构消失,F-actin排列紊乱沿细胞外周聚集,细胞伪足呈片状,CFS指数显著高于正常足细胞(P<0.05),见图4。


图3AngⅡ刺激不同时间对足细胞nephrin表达的影响
6pcDNA3.1-mNPHS质粒稳定转染细胞株nephrinmRNA和蛋白表达
pcDNA3.1-mNPHS稳定转染足细胞nephrin mRNA和蛋白水平较空载体转染细胞和正常细胞显著增加,差异有统计学意义(P<0.05),见图5。
7pcDNA3.1-mNPHS1转染对足细胞Akt活性的影响
AngⅡ(10-8mol/L)刺激15 min后正常足细胞和空载体转染细胞Akt磷酸化水平显著低于同种细胞未加AngⅡ的磷酸化水平;pcDNA3.1-mNPHS1稳定转染足细胞Akt磷酸化水平显著高于正常足细胞和空载体转染足细胞,AngⅡ刺激15min后Akt磷酸化水平较pcDNA3.1-mNPHS1稳定转染细胞降低,但差异无统计学意义,见图6。
8pcDNA3.1-mNPHS1转染对AngⅡ诱导足细胞F-actin分布的影响
正常足细胞F-actin呈应力纤维分布;AngⅡ刺激后F-actin沿胞体外周分布;pcDNA3.1-mNPHS1稳定转染足细胞F-actin同样呈应力纤维样分布,部分细胞沿胞膜伸出短线状伪足;pcDNA3.1-mNPHS1稳定转染足细胞并用AngⅡ(10-8mol/L)刺激18 h后,F-actin束状应力纤维结构减少,F-actin沿胞膜外周分布,部分细胞仍伸出短线状伪足结构,但CFS较未转染质粒的AngⅡ刺激细胞显著降低,见图7。


图4Akt抑制剂LY294002对足细胞骨架的影响
讨 论
AngⅡ作为RAS的主要效应分子,能通过血流动力学和非血流动力学多种途径引起肾小球损伤。课题组前期研究发现,AngⅡ持续输注大鼠肾小球足细胞凋亡和足突融合[3],用永生化小鼠足细胞系研究发现AngⅡ以浓度和时间依赖方式诱导小鼠足细胞凋亡,SD特异分子nephrin可通过PI3K/Akt途径抑制AngⅡ诱导的小鼠足细胞凋亡[6]。本文研究nephrin在调节AngⅡ诱导足细胞骨架分布改变中的作用,进一步探讨足细胞足突融合及调节机制。
以足细胞损伤或功能异常为起始的肾小球疾病称为足细胞病(podocytopathy),多种原发(如微小病变、局灶节段硬化和膜性肾病)和继发(如糖尿病肾病、HIV相关肾病、狼疮性肾炎等)性肾小球疾病均存在不同程度足细胞损伤和表型改变,而足突融合见于多种肾小球疾病[7-9]。足突融合是足细胞损伤的特征性表型改变,足突的细胞骨架是由短枝状F-actin和细胞骨架相关蛋白相互交联形成的环状微丝束[10-11]。本研究发现正常足细胞F-actin主要形成应力纤维,AngⅡ刺激后F-actin排列紊乱向细胞外周边集,形成F-actin外周环,CFS随刺激时间延长逐渐增加,AngⅡ诱导的骨架重排被AngⅡ受体拮抗剂氯沙坦抑制。倒置相差显微镜下还观察到AngⅡ刺激后足细胞伪足由长丝状伪足转变为短片状伪足,细胞形态发生明显改变。因此,AngⅡ可以诱导F-actin重排使足细胞足突和细胞形态发生改变,是足突融合重要的损伤因素。
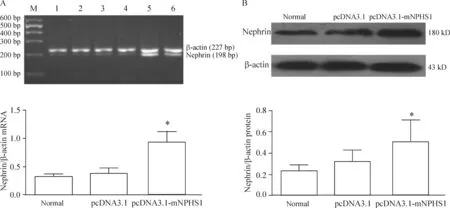

图5pcDNA3.1-mNPHS质粒转染对足细胞nephrinmRNA和蛋白表达的影响


图6pcDNA3.1-mNPHS质粒转染对足细胞磷酸化Akt影响

图7pcDNA3.1-mNPHS1转染对AngⅡ诱导足细胞骨架重排的影响
Nephrin是首先发现的定位于裂孔膜的足细胞特异分子,属免疫球蛋白超家族成员,分为胞外段、跨膜段和胞内段。相邻足突nephrin或其它裂孔膜蛋白胞外段相互交联形成裂孔膜结构,胞内段含多个酪氨酸残基,酪氨酸残基磷酸化后,与含SH2、SH3结构的结合蛋白(主要包括podocin、CD2AP和Nck)的亲和力显著增加,参与多种细胞信号转导[2]。Huber等[12]研究表明,在HEK293T细胞中PI3K的P85调节亚单位可以分别和CD2AP、nephrin发生免疫共沉淀。Nephrin转染能通过活化PI3K-Akt,明显抑制犬肾细胞(Madin-Daby canine kidney cells,MDCK)和条件永生性足细胞由脱离基质而诱导的细胞凋亡。新近研究发现,磷酸化nephrin能通过与适配蛋白Nck结合,调节肌动蛋白微丝重组[13-14]。
PI3K/Akt通路的下游信号除参与调节细胞增殖和凋亡外,近年研究发现还与细胞骨架组装有关。Somanath等[15]在内皮细胞和成纤维细胞中发现Rac1(小G蛋白磷酸酶)是Akt的下游信号分子,参与调节细胞骨架重组。本研究用Akt抑制剂LY294002可诱导肌动蛋白骨架重组,推测PI3K/Akt也可能通过Rac1信号通路参与足细胞肌动蛋白骨架重组。pcDNA3.1-mNPHS1质粒转染后可上调Akt磷酸化水平,因此PI3K/Akt可能是nephrin的下游信号通路影响细胞骨架重排。Zhu等[16]报道nephrin可直接通过PI3K/Akt/Rac1信号通路影响肌动蛋白重排。本研究还发现pcDNA3.1-mNPHS1转染能促进足细胞应力纤维和线状伪足形成,但不能完全阻止AngⅡ诱导的细胞骨架重排。因此,nephrin和AngⅡ可共同通过PI3K/Akt信号通路影响足细胞肌动蛋白骨架重排,但除PI3K/Akt外,AngⅡ还可能通过非nephrin依赖的信号转导影响肌动蛋白骨架重排,仍有待进一步研究。
综上所述,PI3K/Akt是nephrin和AngⅡ的共同下游通路。Nephrin能通过PI3K/Akt途径部分稳定AngⅡ诱导足细胞细胞骨架改变。这些结果对明确足突融合分子机制有一定的意义。
[1] Greka A, Mundel P. Cell biology and pathology of podocytes[J]. Annu Rev Physiol, 2012, 74: 299-323.
[2] Patrakka J, Tryggvason K. Nephrin:a unique structural and signaling protein of the kidney filter[J]. Trends Mol Med, 2007, 13(9): 396-403.
[3] Jia J, Ding G, Zhu J, et al. Angiotensin II infusion induces nephrin expression changes and podocyte apoptosis[J]. Am J Nephrol, 2008, 28(3): 500-507.
[4] Shankland SJ, Pippin JW, Reiser J, et al. Podocytes in culture: past, present, and future[J]. Kidney Int, 2007, 72(1): 26-36.
[5] Hsu HH, Hoffmann S, Endlich N, et al. Mechanisms of angiotensin II signaling on cytoskeleton of podocytes[J]. J Mol Med, 2008, 86(12): 1379-1394.
[6] 梁 伟,韦忠平,任志龙,等. Nephrin通过PI3K-Akt途径抑制血管紧张素Ⅱ诱导的足细胞凋亡[J]. 中华肾脏病杂志,2011,27(10): 746-751.
[7] Wiggins RC. The spectrum of podocytopathies: a unifying view of glomerular diseases[J]. Kidney Int, 2007, 71(12): 1205-1214.
[8] Barisoni L, Schnaper HW, Kopp JB. Advances in the biology and genetics of the podocytopathies: implications for diagnosis and therapy[J]. Arch Pathol Lab Med, 2009, 133(2): 201-216.
[9] 戴厚永,汤日宁,郑 敏,等. 结缔组织生长因子在高糖诱导的足细胞上皮间充质转化中的作用[J]. 中国病理生理杂志,2011,27(12):2291-2295.
[10]Welsh GI, Saleem MA. The podocyte cytoskeleton:key to a functioning glomerulus in health and disease[J]. Nat Rev Nephrol, 2012, 8(1): 14-21.
[11]Faul C, Asanuma K, Yanagida-Asanuma E, et al. Actin up: regulation of podocyte structure and function by components of the actin cytoskeleton[J]. Trends Cell Biol, 2007, 17(9): 428-437.
[12]Huber TB, Hartleben B, Kim J, et al. Nephrin and CD2AP associate with phosphoinositide 3-OH kinase and stimulate AKT-dependent signaling[J]. Mol Cell Biol, 2003, 23(14): 4917-4928.
[13]Tryggvason K, Pikkarainen T, Patrakka J. Nck links nephrin to actin in kidney podocytes[J]. Cell, 2006, 125(2): 221-224.
[14]Verma R, Kovari I, Soofi A, et al. Nephrin ectodomain engagement results in Src kinase activation, nephrin phosphorylation, Nck recruitment, and actin polymerization[J]. J Clin Invest, 2006, 116(5): 1346-1359.
[15]Somanath PR, Byzova TV. 14-3-3beta-Rac1-p21 activated kinase signaling regulates Akt1-mediated cytoskeletal organization, lamellipodia formation and fibronectin matrix assembly[J]. J Cell Physiol, 2009, 218(2): 394-404.
[16]Zhu J, Sun N, Aoudjit L, et al. Nephrin mediates actin reorganization via phosphoinositide 3-kinase in podocytes[J]. Kidney Int, 2008, 73(5): 556-566.
RoleofnephrininpreventingangiotensinⅡ-inducedcytoskeletalrearrangementinglomerularpodocytes
LIANG Wei, REN Zhi-long, WEI Zhong-ping, LIU Yi-peng, CHEN Cheng, DING Guo-hua
(DivisionofNephrology,People’sHospitalofWuhanUniversity,Wuhan430060,China.E-mail:ghxding@gmail.com)
AIM: To investigate the role of nephrin, a slit diaphragm-associated protein, in angiotensinⅡ (AngⅡ)-induced cytoskeleton rearrangement in podocytes.METHODSImmortalized mouse podocytes were exposed to AngⅡ (10-8mol/L) with or without AngⅡ receptor antagonist lorsatan and Akt inhibitor LY294002. FITC-conjugated phalloidin was used to stain F-actin, and semi-quantitative system with cortical F-actin score (CFS) was introduced to analyze the degree of actin cytoskeleton arrangement. The expression of nephrin was assessed by quantitative real-time RT-PCR,RT-PCR and Western blotting. Undifferentiated podocytes were transfected with pcDNA3.1-mNPHS1 plasmid containing the full length of nephrin. The stably transfected cell line was generated by G418 selection. Phosphorylation level of Akt was assessed by Western blotting, and F-actin distribution was further evaluated in transfected cells exposed to AngⅡ or not.RESULTSCytoskeletal rearrangements including cortical F-actin ring formation and stress fiber attenuation were observed in Ang II-and LY294002-stimulated podocytes. Pretreatment with losartan significantly prevented Ang II-induced actin cytoskeleton reorganization. The mRNA and protein levels of nephrin and phosphorylation of Akt were obviously decreased in the podocytes exposed to Ang II, which were dramatically reversed by pcDNA3.1-mNPHS1 transfection. Transfection of pcDNA3.1- mNPHS1 induced the formation of short filopodia and partially prevented AngⅡ-induced F-actin remodeling.CONCLUSIONPI3K/Akt signaling is a common downstream pathway of nephrin and Ang Ⅱ. Nephrin is able to stabilize AngⅡ-induced cytoskeletal rearrangement via PI3K/Akt signaling pathway.
Angiotensin II; Podocytes; Nephrin; Cytoskeleton
R34
A
10.3969/j.issn.1000-4718.2012.12.019

