干扰盐皮质激素受体基因对RAW 264.7细胞增殖和凋亡的影响*
姬文婕, 胡道川, 陈雪芬, 马永强, 卢芮伊, 周 欣, 魏路清
(中国人民武装警察部队后勤学院 1附属医院呼吸与重症医学科, 2武警部队心血管病研究所,天津 300162)
1000-4718(2012)12-2261-05
2012-06-28
2012-09-29
国家自然科学基金资助项目(No. 81102088);天津市自然科学基金一般项目(No. 12JCYBJC16600);武警医学院科研项目(No.WYB201108)
△通讯作者 Tel: 022-24716466; E-mail: wenjieji@gmail.com
干扰盐皮质激素受体基因对RAW 264.7细胞增殖和凋亡的影响*
姬文婕1△, 胡道川1, 陈雪芬1, 马永强1, 卢芮伊2, 周 欣2, 魏路清1
(中国人民武装警察部队后勤学院1附属医院呼吸与重症医学科,2武警部队心血管病研究所,天津 300162)
目的应用RNA干扰技术沉默小鼠RAW 264.7巨噬细胞盐皮质激素受体(MR)基因,建立稳定干扰细胞株,并观察其对细胞增殖和凋亡的影响。方法针对MR基因设计合成重组MRshRNA质粒,脂质体法转染质粒至RAW 264.7细胞,经G418筛选后获得稳定表达细胞株。细胞分为3组:野生型(WT)组、阴性对照(NC)组和干扰(shMR)组。荧光显微镜下观察确定细胞的转染效率;实时定量PCR法检测细胞中MR mRNA的表达;CCK-8方法检测细胞增殖活性;流式细胞术分析细胞周期分布和凋亡情况。结果(1)MRshRNA能明显抑制RAW 264.7细胞的MR基因表达,抑制率70%以上。(2) 从第3 d开始,shMR组细胞的生长速度明显低于NC和WT组 (P<0.05),说明MRshRNA能明显抑制细胞增殖。(3) WT、NC和shMR组的增殖指数分别为(37.2±0.5)%、(37.5±1.6)%和(31.0±1.3)%,shMR组的细胞周期出现改变,S期和G2/M期比例明显下降,增殖指数下降(P<0.05)。(4) WT、NC和shMR组的细胞凋亡率分别为(2.18±0.36)%、(6.65±0.81)%和(7.70±1.34)%,shMR组略高于NC组,但二者的差异无统计学意义(P>0.05)。结论本研究成功构建了稳定干扰MR基因表达的RAW 264.7细胞株,MRshRNA能够明显抑制RAW 264.7细胞增殖,但对其凋亡无明显影响。
受体,盐皮质激素; RNA干扰; RAW 264.7细胞; 细胞增殖; 细胞凋亡
巨噬细胞是具有多功能的异质性细胞群体,在体内具有抵抗微生物侵犯,参与免疫应答以及其它炎症疾病的作用。不同的环境中,巨噬细胞可以具有不同的活化类型,发挥不同的功能,继而影响相关病理生理过程。近年来研究发现盐皮质激素受体(mineralocorticoid receptor,MR)参与了巨噬细胞的活化表型调节[1],而且MR受体拮抗剂亦可改善自发高血压大鼠的心肌纤维化程度以及减轻实验性肺纤维化等[2-3]。因此本研究采用RNA干扰技术,构建稳定干扰MR基因的小鼠RAW 264.7巨噬细胞,观察对其增殖和凋亡等生物学特性的影响,从而为进一步探讨MR在巨噬细胞相关的病理生理学过程的调控机制提供有力的分子生物学工具。
材 料 和 方 法
1材料
小鼠巨噬细胞株RAW 264.7由南开大学生命科学院韩际宏教授惠赠;shRNA干扰表达载体系统购自上海吉玛制药技术有限公司;高糖DMEM液体培养基和胎牛血清购自HyClone;G-418购自Amesco;OPTI MEM转染培养基、LipofectamineTM2000和TRIzol购自Invitrogen;CCK-8试剂盒购自Dojindo;MMLV反转录酶和dNTPs购自Promega;SYBR Green实时定量PCR试剂盒购自Roche;碘化丙啶(propidium iodide,PI)购自Sigma;Annexin V-FITC凋亡检测试剂盒购自Biolegend。
2主要方法
2.1shRNA表达质粒的构建 设计合成4对针对小鼠MR基因序列(Gene ID:110784)的shRNA序列,以与目的基因shRNA序列和任何小鼠基因序列无同源性的序列为阴性对照。所有序列经BLAST分析与已知的小鼠基因序列无同源性。将有短发夹结构的寡核苷酸序列,克隆到空载体pGPU6/GFP/Neo,构建shRNA重组质粒。shRNA质粒靶位点及序列见表1。
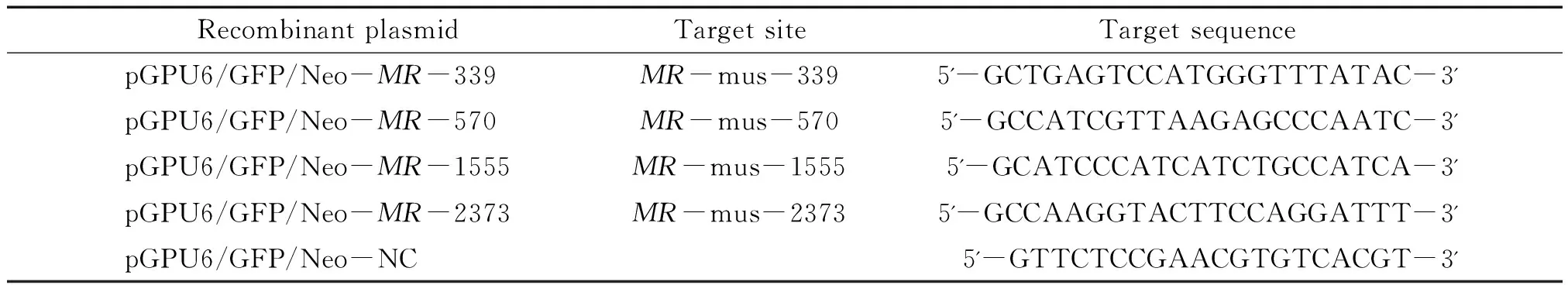
表1 MR shRNA重组质粒靶位点及靶序列
2.2细胞转染和干扰位点的筛选 小鼠巨噬细胞株RAW 264.7用高糖DMEM培养基(含12%胎牛血清、4 mmol/L L-谷氨酰胺),置于37 ℃、5%CO2培养箱中培养,取对数生长期细胞用于实验。将重组质粒按照LipofectamineTM2000说明书转染细胞,主要步骤如下:取对数生长期RAW 264.7细胞计数后接种于6孔板,每孔4×105个,使转染时达到80%~90%的融合;将4个不同干扰位点质粒(表1)和阴性质粒分别转染RAW 264.7,空白对照组以完全培养基代替转染复合物;转染24 h后用荧光显微镜观察各组细胞的荧光比例,确定转染效率。TRIzol法提取细胞总RNA,实时定量PCR法检测MR mRNA的表达量,筛选出干扰效率最高的重组质粒进行后续实验。
2.3稳定细胞株的建立 细胞培养、接种及转染步骤同2.2,用2.2筛选出的靶位点作为有效干扰位点。细胞分为3组:野生型(wild type,WT)组、阴性对照(negative control,NC)组和干扰(RNA interference byMRshRNA,shMR)组。转染36 h后,用G418(500 mg/L)筛选转染细胞,然后挑取单克隆进行扩大培养,传代3次后,用荧光显微镜观察细胞荧光有无丢失,RT-PCR法检测MR基因干扰效果,若细胞状态稳定,则表明稳定转染细胞系RAW 264.7-shMR和RAW 264.7-NC构建成功。
2.4实时定量PCR法检测细胞中MR mRNA的表达水平 按照TRIzol说明书提取各组细胞的总RNA,反转录成cDNA,然后用SYBR Green法进行实时定量PCR检测,同一样本设2个复孔,实验重复3次。MR上游引物5’-GGCTACCACAGTCTCCCTGA-3’,下游引物5’-AGAACGCTCCAAGGTCTGAG-3’;内参照β-actin上游引物5’-CTAAGGCCAACCGTGAAAAG-3’,下游引物5’-ACCAGAGGCATACAGGGACA-3’。以上引物均由北京三博远志生物技术有限公司合成。反应条件为:50 ℃ 2 min,95 ℃ 10 min,(95 ℃ 15 s、60 ℃ 1 min)40个循环,标准熔解曲线分析。用2-ΔΔCt法计算mRNA相对表达量,其中ΔΔCt=实验组(Ct目的基因-Ct内参照基因)-对照组(Ct的基因-Ct内参照基因)。
2.5CCK-8法测定细胞增殖活性 分别将对数生长期的shMR、NC和WT组细胞计数后,接种于96孔板,每孔1×103个,每组设6个复孔,分别于培养1 d、2 d、3 d、4 d和5 d后,每孔加入CCK-8 10 μL,继续培养4 h后,测定450 nm波长处吸光度值(A),实验重复3次,计算平均值。根据各组细胞每天的A值绘制细胞生长曲线,并计算生长抑制率(inhibitory rate,IR)公式如下:
2.6细胞周期的测定 取各组对数生长期细胞,制备成单细胞悬液,用70%乙醇固定,PBS洗涤,加入PI染液(含50 mg/L PI、0.05%Triton X-100和100 mg/L RNase),37 ℃孵育40 min,尼龙滤网过滤后,用Beckman Coulter FC500流式细胞仪测定细胞DNA含量,并用FlowJo软件进行分析,实验重复3次,计算平均值。增殖指数(proliferation index,PI)公式如下:
2.7细胞凋亡的检测 采用Annexin V-FITC/PI双染色法,按照试剂盒说明进行操作。收集各组对数生长期细胞,Binding Buffer重悬细胞;加入10 μL Annexin V-FITC混匀后,加入5 μL PI,室温避光反应15 min,流式细胞仪进行检测。重复测定3次,计算各组细胞的平均凋亡率。
3统计学处理
结 果
1MRshRNA干扰稳定细胞株的建立
在荧光显微镜下观察,转染24 h后各组细胞均转染成功,转染效率约为75%左右,见图1。Real-time PCR结果显示(图2),与NC组相比,不同干扰位点的shRNA组的MR mRNA水平的表达均降低(P<0.05),其中MR-mus-2373的干扰效果最明显,抑制率为70%左右。因此,选用重组质粒pGPU6/GFP/Neo-MR-2373构建稳定干扰细胞株。将上述质粒及阴性质粒分别转染细胞,经G418抗性筛选获得稳定表达GFP的细胞,连续传3代后,经real-time PCR检测,RAW 264.7-shMR细胞的MR mRNA的抑制率仍在70%以上,说明成功构建了稳定干扰细胞株。
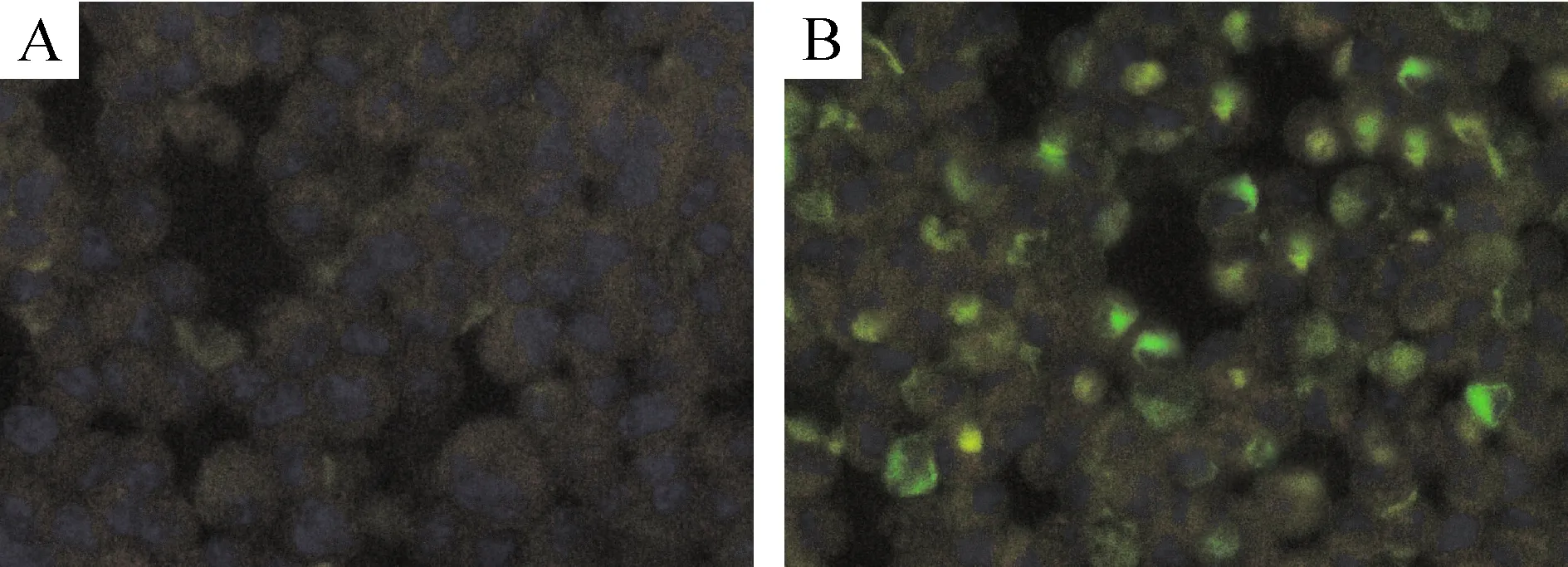
Figure 1. Fluorescent images of RAW 264.7 cells after transfection with recombinant plasmid pGPU6/GFP/Neo (×400).A: blank control; B: shRNA transfection.
图1荧光显微镜下观察转染效率

图2shRNA转染后RAW264.7细胞中MRmRNA的表达
2MRshRNA对RAW264.7细胞增殖活性的影响
从各组细胞的生长曲线可以看出,从第3 d开始,shMR组细胞的生长速度明显低于NC和WT组 (P<0.05),而后者之间无显著差异,见图3,说明MRshRNA能明显抑制细胞增殖。与NC相比,shMR组细胞的第3 d生长抑制率为25.92%,第4 d为37.58%,第5 d为42.09%。
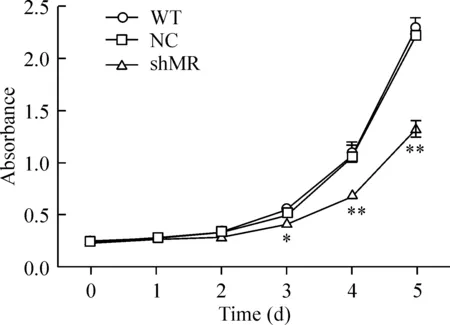
图3MRshRNA对RAW264.7细胞增殖活性的影响
3MRshRNA对RAW264.7细胞周期的影响
WT、NC和shMR组的增殖指数分别为(37.2±0.5)%、(37.5±1.6)%和(31.0±1.3)%,见图4。与WT和NC组相比,shMR组的细胞周期出现改变,S期和G2/M期比例明显下降,增殖指数下降,差异有统计学意义;而NC与WT组的细胞周期分布无明显差异。
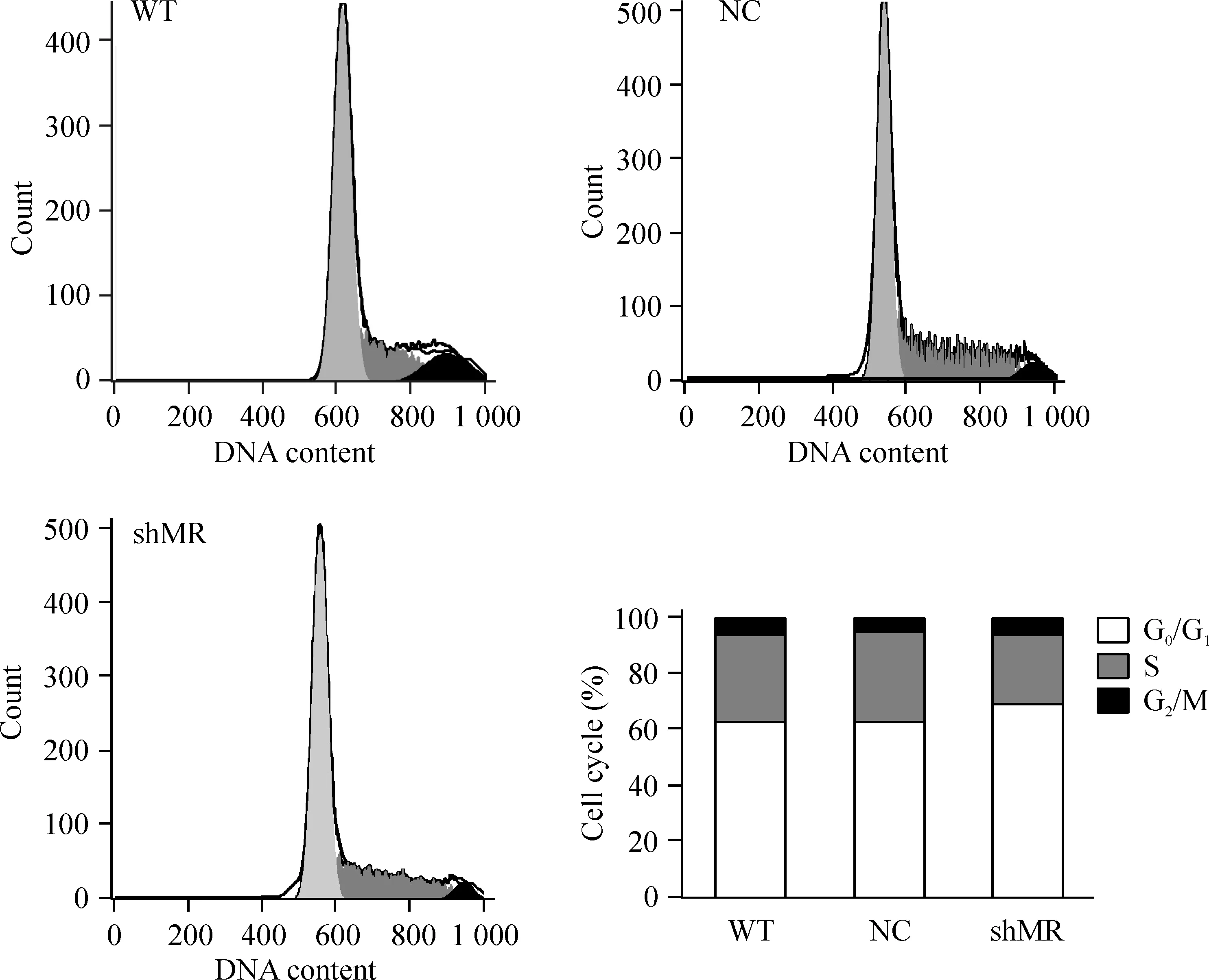
Figure 4. Cell cycle of RAW 264.7 cells assayed by flow cytometry.
图4流式细胞术检测MRshRNA对RAW264.7细胞细胞周期的影响
4MRshRNA对RAW264.7细胞凋亡的影响
WT、NC和shMR组的细胞凋亡率分别为(2.18±0.36)%、(6.65±0.81)%和(7.70±1.34)%,NC较WT组的细胞凋亡率有明显上升(P<0.05),shMR组略高于NC组,但二者的差异无统计学意义(P>0.05),见图5。


图5流式细胞术检测MRshRNA对RAW264.7细胞凋亡的影响
讨 论
巨噬细胞是具有吞噬、抗原递呈和免疫调节等功能的免疫细胞,在各种不同的刺激下,巨噬细胞会表现出不同的功能:促进炎症与抑制炎症、免疫应答与免疫耐受、组织损伤与组织修复等。在不同环境中,巨噬细胞可以发生不同性质的活化,成为具有不同分子表型和功能特征的亚群,从而决定了其在各种环境和不同疾病中发挥的作用[4]。目前认为巨噬细胞至少存在2种活化状态,即经典活化(classical activation, M1)和替代活化(alternative activation, M2)[5]。M1巨噬细胞通常认为是经干扰素γ激活,主要表现为促进炎症(分泌TNF-α、IL-1、IL-6等促炎因子)和氧化应激反应(诱导型一氧化氮合酶表达上调)、增强的吞噬活性;M2巨噬细胞主要经IL-4和IL-13激活,主要表现为抑制炎症反应,并与组织的修复和纤维化过程有关(分泌多种生长因子)。2种状态的平衡对于机体维持正常免疫功能是必须的,任何一种活化失衡状态都可能对组织炎症的恢复产生不良影响。
盐皮质激素受体是一种典型的胞核甾体类激素受体,它的经典配体为醛固酮,与细胞的增殖、分化和凋亡等病理生理过程有密切联系[6-8]。传统观点认为MR主要存在于心血管系统和肾脏相应的靶细胞,但是新近研究发现单核-巨噬细胞也存在这类受体,并且参与了对巨噬细胞表型的调控,即盐皮质激素受体活化(如与醛固酮结合)可使巨噬细胞向M1分化,而盐皮质激素受体被拮抗(如与螺内酯结合)则可使巨噬细胞向M2分化[1]。选择性敲除巨噬细胞MR基因后,盐皮质激素依赖性心脏纤维化、炎症以及高血压等明显减轻[9-10]。肺巨噬细胞数量和功能的动态演变在时间和空间上均与肺纤维化病程和病情密切相关,增殖和凋亡是调节巨噬细胞数量的重要机制,研究发现实验性肺纤维化模型中,急性炎症期呈现肺泡巨噬细胞增殖明显,数量增多,而在纤维化期,则出现巨噬细胞凋亡增加,数量减少[11]。因此,通过对MR的调控,改变巨噬细胞活化状态,调节巨噬细胞数量功能,有可能达到有效的抗炎效果,从而改变疾病的预后和转归。
本研究中采用基于质粒载体的shRNA系统,用脂质体将重组质粒pGPU6/GFP/Neo-MRshRNA转染至RAW 264.7细胞,经过G418抗性筛选后获得稳定表达细胞株。实验结果表明MRshRNA有效地抑制了RAW 264.7 细胞中MR mRNA的表达,明显地抑制了RAW 264.7细胞的生长,S期和G2/M期比例明显下降,而对细胞的凋亡基本没有影响。但是目前尚未阐明MR对巨噬细胞表型调控的机制与其它信号转导通路之间的相互关系,以及在一些疾病发生发展过程中的意义等。因此,本实验中成功构建的稳定干扰细胞株将为进一步探讨巨噬细胞MR的病理生理学机制提供有力的研究工具和奠定初步的实验基础。
[1] Usher MG, Duan SZ, Ivaschenko CY, et al. Myeloid mineralocorticoid receptor controls macrophage polarization and cardiovascular hypertrophy and remodeling in mice[J]. J Clin Invest, 2010, 120(9): 3350-3364.
[2] 许 明, 杨汉东, 闽新文,等. 安体舒通改善自发高血压性大鼠心肌纤维化[J]. 中国病理生理杂志, 2008, 24(7): 1281-1285.
[3] 蔡志刚, 石玉珍, 张贺芳,等. 醛固酮拮抗剂对大鼠肺纤维化的干预作用及其机制[J]. 中华结核和呼吸杂志, 2005, 28(9): 636-638.
[4] Edwards JP, Zhang X, Frauwirth KA, et al. Biochemical and functional characterization of three activated macrophage populations[J]. J Leukoc Biol, 2006, 80(6): 1298-1307.
[5] Gordon S, Martinez FO. Alternative activation of macrophages: mechanism and functions[J]. Immunity, 2010, 32(5): 593-604.
[6] Stockand JD, Meszaros JG. Aldosterone stimulates proliferation of cardiac fibroblasts by activating Ki-RasA and MAPK1/2 signaling[J]. Am J Physiol Heart Circ Physiol, 2003, 284(1): H176-H184.
[7] Caprio M, Feve B, Claes A, et al. Pivotal role of the mineralocorticoid receptor in corticosteroid-induced adipogenesis[J]. FASEB J, 2007, 21(9): 2185-2194.
[8] Crochemore C, Lu J, Wu Y, et al. Direct targeting of hippocampal neurons for apoptosis by glucocorticoids is reversible by mineralocorticoid receptor activation[J]. Mol Psychiatry, 2005, 10(8): 790-798.
[9] Rickard AJ, Morgan J, Tesch G, et al. Deletion of mineralocorticoid receptors from macrophages protects against deoxycorticosterone/salt-induced cardiac fibrosis and increased blood pressure[J]. Hypertension, 2009, 54 (3): 537-543.
[10]Bienvenu LA, Morgan J, Rickard AJ, et al. Macrophage mineralocorticoid receptor signaling plays a key role in aldosterone-independent cardiac fibrosis[J]. Endocrinology, 2012,153(7):3416-3425.
[11]陈晓玲, 黄善生, 李文斌,等. 大鼠肺纤维化形成中肺巨噬细胞增殖和凋亡的变化[J]. 中国病理生理杂志, 2004, 20 (3): 433-436.
EffectofmineralocorticoidreceptorgenesilencingbyRNAinterferenceonproliferationandapoptosisofmurinemacrophagecelllineRAW264.7
JI Wen-jie1, HU Dao-chuan1, CHEN Xue-fen1, MA Yong-qiang1, LU Rui-yi2, ZHOU Xin2, WEI LU-qing1
(1DepartmentofRespirologyandCriticalCareMedicine,AffiliatedHospital,2ArmedPoliceForcesInstituteforCardiovascularDiseases,LogisticsUniversityofChinesePeople’sArmedPoliceForces,Tianjin300162,China.E-mail:wenjieji@gmail.com)
AIM: To establish stable knockdown of mineralocorticoid receptor (MR) expression through short hairpin RNA (shRNA)-mediated silencing in murine RAW 264.7 macrophages.METHODSStableMRsilencing in RAW 264.7 cells was achieved by recombinant shRNA plasmid targeting murineMRgene via liposome-mediated transfection, followed by G418 selection. The efficacies of plasmid transfection andMRsilencing in G418-resistant cells were verified by immunofluorescent microcopy and real-time PCR, respectively. Proliferative activity ofMR-silencing cell line was analyzed by CCK-8 assay. Cell cycle and apoptosis were evaluated by flow cytometry.RESULTSMRgene expression was down-regulated by 70% compared with the negative control (NC) plasmid transfection. In addition,MR-silencing cells exhibited lower proliferative activity compared with NC and wide type RAW 264.7 cells (P<0.05), along with reduced proliferation index of 31.0%±1.3% (P<0.05), compared with the wide type cells (37.2%±0.5%) and the NC cells (37.5%±1.6%). In resting state, the apoptotic rate in wide type, NC andMR-silencing cells were 2.18%±0.36%, 6.65%±0.81% and 7.70%±1.34%, respectively, and no statistical difference was observed between NC andMR-silencing cells (P>0.05).CONCLUSIONMRgene silencing inhibits the proliferation of RAW 264.7 macrophages, but has no obvious effect on the apoptosis of the resting state cells.
Receptors,mineralocorticoid; RNA interference; RAW 264.7 cells; Cell proliferation; Apoptosis
R329.21
A
10.3969/j.issn.1000-4718.2012.12.027

