NAC-1特异的siRNA增强紫杉醇诱导的人卵巢癌细胞凋亡*
桂 玲, 王 静, 祝爱珍, 刘成成, 刘革修△
(1湖南省肿瘤医院妇瘤科,湖南 长沙 410013;2暨南大学医学院血液病研究所, 广东 广州 510632)
1000-4718(2012)03-0439-06
2011-09-29
2011-11-07
湖南省卫生厅科研计划资助项目(No.B2011-089)
△通讯作者 Tel:020-85220262;E-mail: tliugx@jnu.edu.cn
NAC-1特异的siRNA增强紫杉醇诱导的人卵巢癌细胞凋亡*
桂 玲1, 王 静1, 祝爱珍2, 刘成成2, 刘革修2△
(1湖南省肿瘤医院妇瘤科,湖南 长沙 410013;2暨南大学医学院血液病研究所, 广东 广州 510632)
目的探讨NAC-1 (nucleus accumbens-1)基因特异的小干扰RNA(small interfering RNA,siRNA)联合紫杉醇诱导人卵巢癌HO8910细胞凋亡的协同作用及其可能机制。方法测定不同浓度NAC-1基因特异的siRNA与紫杉醇单用或者合用对HO8910细胞增殖与凋亡的作用,设立阴性siRNA对照和空白对照。以实时荧光定量RT-PCR 检测NAC-1 mRNA表达水平、Western印迹法检测NAC-1蛋白、表皮生长因子受体(EGFR)下游信号磷酸化Akt(p-Akt)和磷酸化细胞外信号调节激酶(p-ERK),以MTT法检测细胞增殖率,流式细胞术检测细胞周期分布和凋亡。结果单用NAC-1基因特异的siRNA作用48 h能抑制HO8910细胞NAC-1 mRNA和蛋白的表达,分别下调71.2%和80.5%,细胞周期被阻滞于G1期,p-Akt和p-ERK蛋白水平分别下降43.7%和49.8%;作用72 h细胞增殖被抑制45.6%,与转染阴性siRNA 及未转染组比较,差异显著(P<0.05)。NAC-1 siRNA(0.5 μmol/L)与紫杉醇(2 μmol/L)联合作用于卵巢癌HO8910细胞72 h细胞凋亡率为(30.93±4.57)%,显著高于单用紫杉醇时的细胞凋亡率[(23.85±3.65)%],P<0.05。结论靶向抑制NAC-1基因表达能显著抑制卵巢癌HO8910细胞增殖,增强其对紫杉醇的敏感性,这与部分抑制EGFR下游信号途径有关。
Nucleus accumbens-1蛋白; 紫杉醇; 卵巢肿瘤; 细胞增殖; 细胞凋亡
紫杉醇(paelitaxel)是目前治疗卵巢癌的重要药物,有效改善了卵巢癌患者的生存率。但是临床应用发现其存在一些缺陷,一方面癌细胞对其易产生耐药性,另一方面,患者出现骨髓抑制、过敏反应、胃肠道反应、神经毒性反应、心脏毒性反应、关节/肌肉痛、肝脏毒性反应、肾脏毒性反应等不良反应。所以,研究增强其抗癌效果和/或者减少其不良反应的方法具有重要意义。
最近研究发现,卵巢癌发生、发展及其治疗效果与卵巢癌干细胞具有密切关系[1-7]。Nakayama等[8]和Jinawath等[9]研究不仅发现NAC-1 (nucleus accumbens-1)是一种极强的干细胞因子,而且证实在浆液性卵巢癌组织和细胞株中NAC-1表达和紫杉醇体外耐药相关,通过部分抑制Gadd45gip1的表达、负向调节Gadd45肿瘤抑制途径的组成包括Gadd45α和其结合蛋白Gadd45gip1,从而促进肿瘤的生长和存活。所以,为了增强紫杉醇作用、减少其不良反应,本研究采用RNA干扰技术沉默NAC-1基因以协同紫杉醇抑制卵巢癌HO8910细胞增殖并诱导凋亡,探索卵巢癌治疗的新的联合方法,为临床提供依据。
材 料 和 方 法
1材料和试剂
人卵巢癌细胞系HO8910购自中国科学院上海细胞生物研究所,由暨南大学生命科学技术学院生殖研究室保存;RPMI-1640培养液购于Gibco;新生牛血清购于杭州四季青生物工程科技有限公司;MTT购于Sigma;脂质体转染试剂盒LipofectamineTM2000购于Invitrogen;Trizol、反转录试剂盒和SYBR GreenⅠMix试剂盒购自Tiangen;MTT试剂盒、蛋白裂解液和电化学发光(electrochemilum-inescence,ECL)试剂盒购自碧云天生物技术有限公司;以NAC-1基因为靶标的特异性siRNA和阴性对照siRNA均由广州市锐博生物科技有限公司合成及纯化。磷酸化Akt[phosphorylated Akt,p-Akt(Ser473)]多克隆抗体购自Santa Cruz;NAC-1多克隆抗体和磷酸化细胞外信号调节激酶(phosphorylated extracellular signal-regulated kinase,p-ERK)多克隆抗体购自Cell Signaling Technology。
2靶向NAC-1基因寡核苷酸的设计
根据NAC-1基因的序列号NM-052876.21,遵循siRNA设计规则设计siRNA序列,使用BLAST程序对序列进行人类基因组相似性评估证实序列在人类基因组中具有唯一性。经预实验筛选出NAC-1基因特异性高效的siRNA:5’-UGACAGGCACCAACGUGUACA-3’;阴性对照siRNA:5’-GACTTCATAAGGCGCATGC-3’,与已知的人类基因无同源性。
3细胞培养与实验分组
将对数生长期的人卵巢癌HO8910细胞以1×105细胞/瓶接种于75 cm2培养瓶,用含10%胎牛血清的RPMI-1640培养液培养于5%CO2、37 ℃培养箱中。当细胞生长至约70%汇合度时,以每孔100 μL(5×103细胞)接种于96孔板,细胞贴壁后,分别加入不同浓度的紫杉醇(0.5、1.0、2.0、4.0、8.0、16.0和32.0 μmol/L)、不同浓度的NAC-1-siRNA(0.05、0.10、0.20、0.40、0.80、1.60和3.20 μmol/L)以及NAC-1 siRNA 0.5 μmol/L,此浓度根据单用NAC-1 siRNA的半数抑制浓度(half maximal inhibitory concentration,IC50)确定]联合不同浓度的紫杉醇(0.5、1.0、2.0、4.0、8.0、16.0和32.0 μmol/L),进行药物干预,每个浓度设3个复孔。同时设空白对照组、仅含有DMSO的阴性对照组和阴性siRNA (negative siRNA)组。siRNA转染参考试剂盒说明书。
4MTT法检测细胞增殖活性
继续培养72 h后,每孔加入MTT(5 g/L)10 μL,37 ℃培养4 h后低速离心10 min吸弃上清液,每孔加入DMSO 150 μL,振荡15 min使沉淀充分溶解,用酶联免疫检测仪在波长490 nm处测定吸光度(A)值。细胞生长抑制率=(实验组平均A值-空白组平均A值)/(对照组平均A值-空白组平均A值)×100%。采用直线回归方法计算药物的IC50值。实验重复3次。
5细胞周期与凋亡检测
采用PI单染流式细胞术检测细胞周期:siRNA处理48 h后,收集、洗涤细胞,冰预冷的70%乙醇,4 ℃固定24 h;离心去乙醇, PBS漂洗,加入50 mg/L PI、20 mg/L RNase、1 g/L枸橼酸钠、1% Triton X-100,上机检测。采用AnnexinⅤ/PI双荧光染色法分析细胞凋亡:收集siRNA、紫杉醇单用或者联用72 h后的细胞,用冷PBS洗涤2次,加入结合缓冲液重悬细胞,调整细胞密度为1×109/L。吸取100 μL细胞悬液,加入AnnexinⅤ-FITC溶液5 μL,轻轻混匀后室温避光孵育15 min,再加碘化丙啶(propidium iodide,PI)10 μL,混匀后避光并室温下孵育5 min,加入结合缓冲液400 μL,立即上流式细胞仪分析。以未染色细胞调零,以AnnexinⅤ-FITC单染管和PI单染管作为基准对照,测定每个上样管数据,测定凋亡细胞百分比。
6计算紫杉醇和NAC-1siRNA的联合作用效果
根据中效原理,采用Chou-Talalay联用指数法[10]来判定2种药物对HO8910细胞增殖的联合作用。按中效方程式计算出不同抑制率时两药的单用和联用浓度,公式如下:D=Dm[fa/(1-fa)]1/m;式中D为药物浓度,Dm为中效浓度,fa为细胞增殖抑制率,m为斜率。2种药物的联用指数(combination index,CI)的计算公式如下:CI=(D)1/(Dx)1+(D)2/(Dx)2+a(D)1(D)2/ (Dx)1(Dx)2;其中(Dx)1和(Dx)2分别为2种药物单用时产生某一效应值fa时的浓度,(D)1和(D)2则是2种药物联用时产生相同效应fa时各自所需要的浓度。当2种药物的相互作用为非排斥性时,a=1;当2种药物的相互作用为排斥性时,a=0。求出CI值,如果CI<1,认为两药物联用为协同作用;如果CI=1,认为两药联用为相加作用;如果CI>1,则认为两药联用为拮抗作用。
7实时荧光定量RT-PCR法检测NAC-1mRNA表达
处理48 h后收集细胞,提取总RNA并用紫外分光光度计定量,取1 μg总RNA逆转录合成cDNA。以cDNA为模板、NAC-1基因特异性引物进行实时荧光定量PCR分析,根据2-ΔΔCt方法分析目的基因的mRNA相对表达水平。NAC-1基 因 上 游 序 列 为 5 ’ - CCAGACACTGCAGATGGAGA-3’,下游序列为5’-AAGCTGAGGATCTGCTGGAA-3’,扩增片段为227 bp;内参照GAPDH 上游序列为5’-GAGTCAACGGATTTGGTCGT-3’,下游序列为5’-TTGATTTTGGAGGGATCTCG-3’,扩增片段为219 bp。
8Western印迹法检测蛋白水平
处理48 h后收集细胞,提取细胞总蛋白,采用BCA法进行蛋白定量。取等量蛋白30 μg上样,进行10%SDS-PAGE,120 V恒压电泳1 h,200 mA恒流转膜1 h。然后,用含5%脱脂奶粉的TBST对膜封闭30 min,加入抗人NAC-1、p-Akt(Ser473)抗体、p-ERK抗体或兔抗人GAPDH抗体(Sigma)于4 ℃孵育过夜,第2 d加入辣根过氧化物酶(horseradish peroxidase, HRP)标记的相应Ⅱ抗IgG(稀释比例为1∶3 000)于室温孵育1 h,TBST洗膜10 min×3次。最后,ECL发光显色,采集图像,采用Gel-Pro 4.0软件对目的蛋白进行定量分析。以GAPDH作为内参照。
9统计学处理
结 果
1NAC-1siRNA、紫杉醇单用或者合用对卵巢癌HO8910细胞增殖的影响
MTT检测结果显示,NAC-1 siRNA和紫杉醇分别以不同浓度单独作用于HO8910细胞72 h,均显示抑制细胞增殖作用,且在一定浓度范围内呈浓度依赖性,见表1,与对照组比较差异有统计学意义(P<0.05)。NAC-1 siRNA作用72 h的IC50值为(0.82±0.08)μmol/L,而紫杉醇的IC50值为(3.81±0.56)μmol/L。根据合用指数计算公式,计算出NAC-1 siRNA和紫杉醇合用在不同效应(0.90、0.80、0.75、0.70、0.65、0.60、0.50、0.40)时的CI分别为0.534、0.574、0.593、0.674、0.737、0.835、0.936、0.941。结果显示当fa为0.90、0.80、0.75、0.65、0.60、0.50、0.40时两药作用为协同。
表1不同浓度NAC-1siRNA与紫杉醇单用或合用对HO8910细胞的生长抑制率

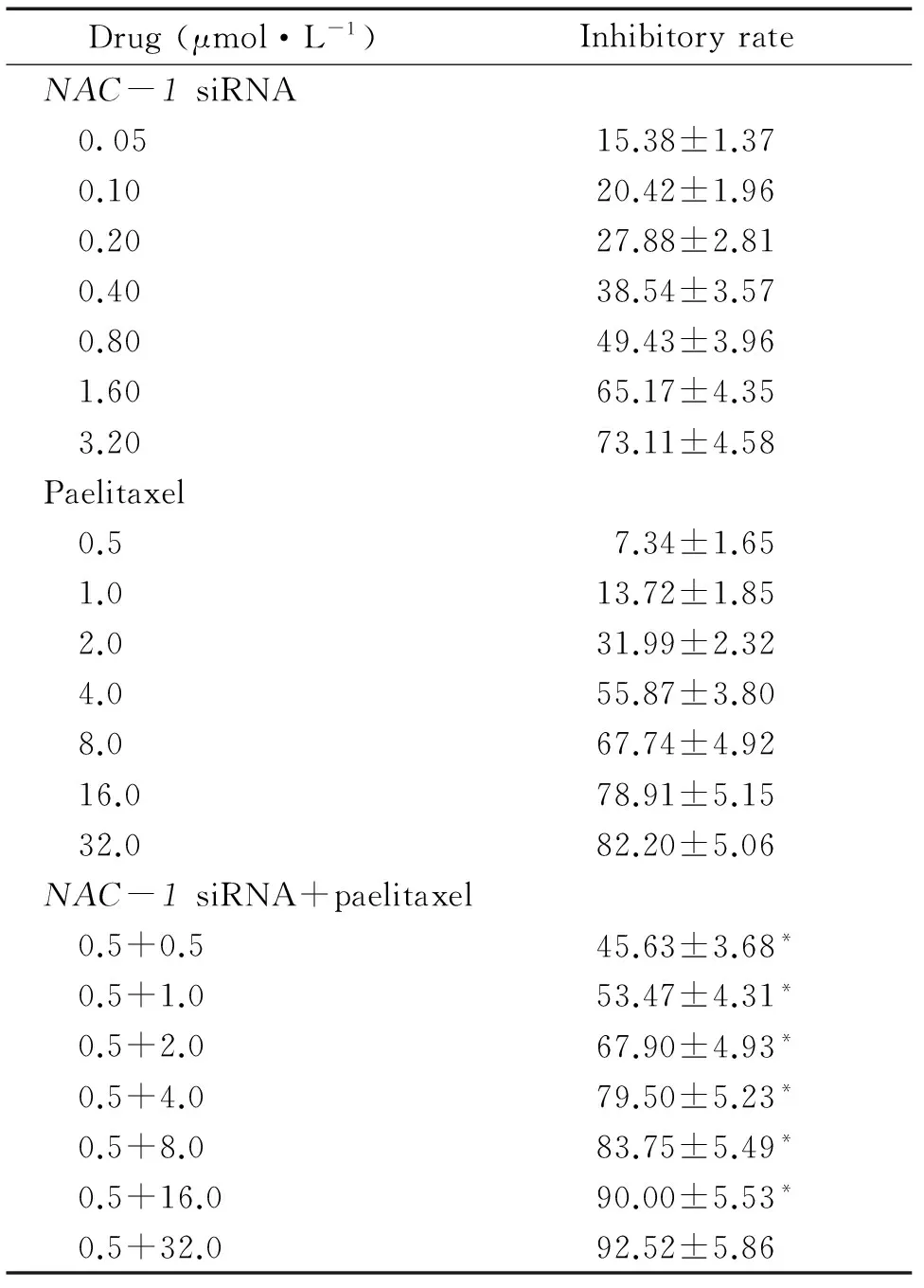
Drug(μmol·L-1)InhibitoryrateNAC-1siRNA 0.0515.38±1.37 0.1020.42±1.96 0.2027.88±2.81 0.4038.54±3.57 0.8049.43±3.96 1.6065.17±4.35 3.2073.11±4.58Paelitaxel 0.57.34±1.65 1.013.72±1.85 2.031.99±2.32 4.055.87±3.80 8.067.74±4.92 16.078.91±5.15 32.082.20±5.06NAC-1siRNA+paelitaxel 0.5+0.545.63±3.68* 0.5+1.053.47±4.31* 0.5+2.067.90±4.93* 0.5+4.079.50±5.23* 0.5+8.083.75±5.49* 0.5+16.090.00±5.53* 0.5+32.092.52±5.86
*P<0.05vsthe concentration-matched paelitaxel groups.
2NAC-1siRNA对卵巢癌HO8910细胞NAC-1基因表达水平的影响
实时荧光定量PCR和Western印迹法结果显示,转染NAC-1特异siRNA(0.5 μmol/L)能有效沉默NAC-1基因的表达, NAC-1 mRNA和蛋白表达水平分别下降71.2%和80.5%,与空白对照组、阴性siRNA组相比较,差异有统计学意义(P<0.05) ,见图1A、B。


图1NAC-1基因特异性siRNA转染对卵巢癌HO8910细胞细胞中NAC-1基因表达的影响
3NAC-1siRNA单用对卵巢癌HO8910细胞表皮生长因子受体(epidermalgrowthfactorreceptor,EGFR)下游信号分子活性的影响
Western blotting结果显示,0.5 μmol/L浓度的NAC-1 siRNA能抑制EGFR活性,其下游信号蛋白Akt和ERK活性被抑制,作用48 h后,不仅NAC-1蛋白水平显著下降,而且细胞p-Akt和p-ERK活性水平也显著下降,分别下降(43.70±4.25)%和(49.80±4.38)%,见图2。

Figure 2. Effects ofNAC-1 siRNA on NAC-1 protein and the activity of protein kinases of EGFR downstream signaling pathway in ovarian cancer HO8910 cells. Con:control; Neg:negative siRNA; Exp:NAC-1 siRNA.
图2NAC-1siRNA对卵巢癌HO8910细胞NAC-1蛋白和EGFR信号途径下游蛋白激酶活性的影响
4NAC-1siRNA对卵巢癌HO8910细胞周期分布的影响
细胞周期检测结果显示,空白对照组与阴性siRNA组中卵巢癌HO8910细胞的细胞周期分布差异无统计学意义(P>0.05),而转染NAC-1 siRNA后G1期HO8910细胞比例显著增高(P<0.05),见图3、表2,提示NAC-1 siRNA转染能够阻滞细胞周期在G1期。
5NAC-1siRNA单用或者与紫杉醇合用对卵巢癌HO8910细胞凋亡的影响
FCM法检测结果显示,用浓度低于IC50的NAC-1 siRNA(0.5 μmol/L)或紫杉醇(2.0 μmol/L)单独作用于卵巢癌HO8910细胞72 h后,细胞凋亡率分别为(7.63±2.38)%和(23.85±3.65)%;而将NAC-1 siRNA(0.5 μmol/L)和紫杉醇(2.0 μmol/L)联合作用72 h后,HO8910细胞的凋亡率为(30.93±4.57)%。联合用药组的细胞凋亡率高于单独用药组,差异有统计学意义(P<0.05);且随着两者的浓度增加,细胞凋亡率亦呈增高趋势。由此可见,NAC-1 siRNA可增强紫杉醇诱导细胞凋亡的作用。
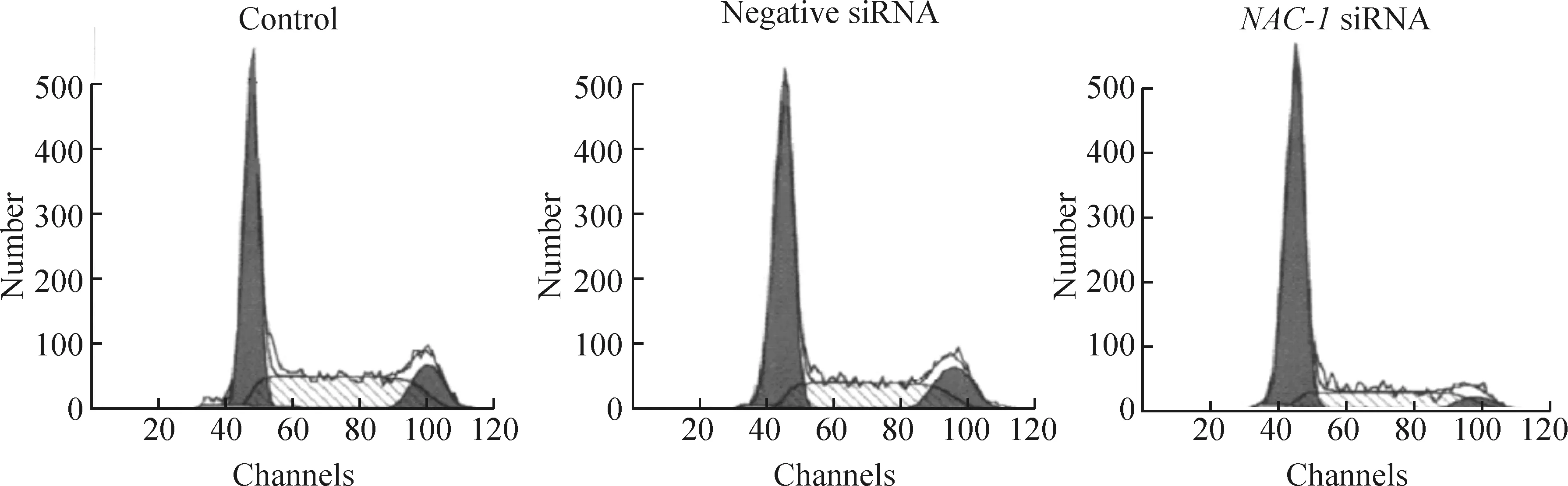
Figure 3. Effect ofNAC-1 siRNA on cell cycle distribution of ovarian cancer HO8910 cells analyzed by flow cytometry.
图3FCM法检测NAC-1siRNA对卵巢癌HO8910细胞周期分布的影响
表2NAC-1siRNA对卵巢癌HO8910细胞细胞周期分布的影响

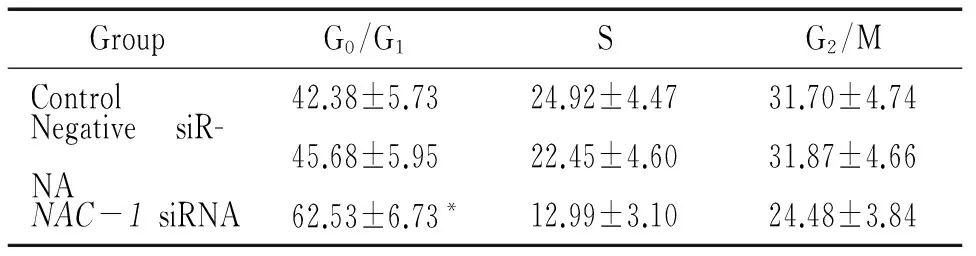
GroupG0/G1SG2/MControl42.38±5.7324.92±4.4731.70±4.74NegativesiR-NA45.68±5.9522.45±4.6031.87±4.66NAC-1siRNA62.53±6.73*12.99±3.1024.48±3.84
*P<0.05vscontrol.
讨 论
NAC-1属于BTB/POZ转录因子家族成员,是干细胞多能性因子。NAC-1通过调节其它多能分化因子的表达,如Nanog、Oct4、Sox2、Klf4、Sall1 和 Sall4等,参与蛋白质间的相互作用和转录调控网络,参与胚胎干细胞的自我更新和多能性分化,对胚胎干细胞的多能分化是至关重要的[8]。最近研究显示,NAC-1在多种恶性肿瘤中表达上调,包括:胰癌、大肠癌、乳腺癌、肾细胞癌、肝癌和宫颈癌[11]。Ishibashi等[12]在卵巢癌研究中发现化疗后复发的患者体内NAC-1表达水平明显高于初发未治者。Nakayama等[8]和Jinawath等[9]则不仅证实在浆液性卵巢癌组织和细胞株中NAC-1表达和紫杉醇体外耐药相关,而且发现,NAC-1通过部分抑制Gadd45gip1的表达、负向调节Gadd45肿瘤抑制途径的组成包括Gadd45α和其结合蛋白Gadd45gip1,从而促进肿瘤的生长和存活。Ueda等[13]则发现NAC-1对于维持卵巢癌细胞中脂肪酸合成酶蛋白和mRNA水平的表达必不可少,并与卵巢癌复发有关。这些资料表明,NAC-1是高度恶性的卵巢癌复发相关基因。
本研究结果显示,通过脂质体转染方法将NAC-1 siRNA导入卵巢癌细胞后,不仅能有效沉默NAC-1基因,抑制NAC-1 mRNA与蛋白表达,而且细胞的生长活性明显受到抑制、细胞周期被阻滞于G1期,同时部分抑制EGFR下游信号途径,p-Akt和p-ERK水平显著下降;NAC-1 siRNA和紫杉醇合用则进一步增强了紫杉醇诱导HO8910细胞凋亡作用。结果表明NAC-1在卵巢癌细胞的生长和存活中起着重要的作用,NAC-1 siRNA能提高卵巢癌细胞对化疗药物的敏感性。这为改善卵巢癌临床治疗方法提供新的依据。
[1] Hu L, McArthur C, Jaffe RB. Ovarian cancer stem-like side-population cells are tumourigenic and chemoresistant[J]. Br J Cancer, 2010, 102(8):1276-1283.
[2] Dyall S, Gayther SA, Dafou D. Cancer stem cells and epithelial ovarian cancer[J].J Oncol, 2010, 2010:105269.
[3] Alvero AB, Chen R, Fu HH, et al. Molecular phenotyping of human ovarian cancer stem cells unravels the mechanisms for repair and chemoresistance[J].Cell Cycle, 2009, 8(1):158-166.
[4] Szotek PP, Pieretti-Vanmarcke R, Masiakos PT, et al. Ovarian cancer side population defines cells with stem cell-like characteristics and Mullerian Inhibiting Substance responsiveness[J]. Proc Natl Acad Sci USA, 2006, 103(30):11154-11159.
[5] Bapat SA, Mali AM, Koppikar CB, et al. Stem and progenitor-like cells contribute to the aggressive behavior of human epithelial ovarian cancer[J]. Cancer Res, 2005, 65(8):3025-3029.
[6] Zhang S, Balch C, Chan MW, et al. Identification and characterization of ovarian cancer-initiating cells from primary human tumors[J]. Cancer Res, 2008, 68(11):4311-4320.
[7] Kobayashi Y, Seino K, Hosonuma S, et al. Side population is increased in paclitaxel-resistant ovarian cancer cell lines regardless of resistance to cisplatin[J]. Gynecol Oncol, 2011, 121(2):390-394.
[8] Nakayama K, Nakayama N, Wang TL, et al.NAC-1 controls cell growth and survival by repressing transcription of Gadd45GIP1, a candidate tumor suppressor[J]. Cancer Res, 2007, 67(17):8058-8064.
[9] Jinawath N, Vasoontara C, Yap KL, et al.NAC-1, a potential stem cell pluripotency factor, contributes to paclitaxel resistance in ovarian cancer through inactivating Gadd45 pathway[J]. Oncogene, 2009, 28(18):1941-1948.
[10]Chou TC. Preclinicalversusclinical drug combination studies[J]. Leuk Lymphoma, 2008, 49(11):2059-2080.
[11]Nakayama K, Nakayama N, Davidson B, et al. ABTB/POZprotein, NAC-1, is related to tumor recurrence and is essential for tumor growth and survival[J]. Proc Natl Acad Sci USA, 2006, 103(49):18739-18744.
[12]Ishibashi M, Nakayama K, Yeasmin S, et al. A BTB/POZ gene,NAC-1, a tumor recurrence-associated gene, as a potential target for Taxol resistance in ovarian cancer[J]. Clin Cancer Res, 2008, 14(10):3149-3155.
[13]Ueda SM, Yap KL, Davidson B, et al. Expression of fatty acid synthase depends on NAC1 and is associated with recurrent ovarian serous carcinomas[J]. J Oncol, 2010, 2010:285191.
NAC-1-specificsiRNAenhancespaelitaxel-inducedapoptosisofovariancancercelllineHO8910
GUI Ling1, WANG Jing1, ZHU Ai-zhen2, LIU Cheng-cheng2, LIU Ge-xiu2
(1DepartmentofGynecologicOncology,HunanProvincialTumorHospital,Changsha410013,China;2InstituteofHematology,SchoolofMedicine,JinanUniversity,Guangzhou510632,China.E-mail:tliugx@jnu.edu.cn)
AIM: To observe the effect ofNAC-1-specific siRNA alone, or in combination with paelitaxel on proliferation and apoptosis of human ovarian cancer cell line HO8910.METHODSOvarian cancer cells were treated withNAC-1 siRNA alone or in combination with paelitaxel. The level of NAC-1 mRNA was assessed by real-time quantitative PCR. Western blotting analysis was used to detect NAC-1 protein and the activation of epidermal growth factor receptor(EGFR) downstream signals,Akt and ERK. The cell proliferation rate was measured by MTT assay, and the cell cycle and apoptosis were determined by flow cytometry.RESULTSAfter treated withNAC-1-specific siRNA for 48 h, the expression of NAC-1 at mRNA and protein levels in HO8910 cells decreased by 71.1% and 80.5%, respectively. The cells in G1phase increased. The protein levels of p-Akt and p-ERK were decreased by 43.7% and 49.8%, respectively. After treated withNAC-1-specific siRNA for 72 h, the proliferation inhibitory rate of the cells was increased to 45.6% as compared with the cells treated with negative siRNA. Apoptotic rate of the cells treated withNAC-1 siRNA (0.5 μmol/L combined with 2 μmol/L of paelitaxel) for 72 h was (30.93±4.57)%,higher than that of the cells treated with paelitaxel alone[(23.85±3.65)%].CONCLUSIONNAC-1 siRNA suppressesNAC-1 gene expression and EGFR downstream signaling activation, inhibits cell proliferation and enhances the responsiveness of ovarian cancer cells to paelitaxel. The combination treatment produces synergistic inhibition.
Nucleus accumbens-1 protein; Paelitaxel; Ovarian neoplasms; Cell proliferation; Apoptosis
R737.14
A
10.3969/j.issn.1000-4718.2012.03.010

