乏氧条件下PTEN、KAI1基因双转染对胰腺癌AsPC1细胞增殖、转移的影响
李宏宇 李建军 郭晓钟 刘旭 吴春燕 赵佳钧 陈延志
·论著·
乏氧条件下PTEN、KAI1基因双转染对胰腺癌AsPC1细胞增殖、转移的影响
李宏宇 李建军 郭晓钟 刘旭 吴春燕 赵佳钧 陈延志
目的观察乏氧环境下PTEN和KAI1基因双转染人胰腺癌AsPC1细胞后对其增殖、迁移的影响。方法应用我们前期构建的PTEN和KAI1基因过表达载体同时转染乏氧环境培养的人胰腺癌AsPC1细胞,采用蛋白质印迹法检测PTEN和KAI1蛋白的表达,四甲基偶氮唑蓝(MTT)法检测细胞的增殖,克隆形成实验观察肿瘤细胞形成集落能力,Transwell小室实验观察细胞的迁移能力。结果双基因转染后,乏氧培养的AsPC1细胞的PTEN、KAI1蛋白表达量较空载体转染组细胞增加2.05倍及1.51倍;细胞增殖显著减缓(0.5比0.8,P=0.000);克隆形成数显著下降[(41.67±5.03)个比(86.00±7.81)个,P=0.017)];细胞迁移能力明显减弱(0.68±0.05比1.23±0.03,P=0.003)。结论乏氧条件下PTEN、KAI1基因双转染AsPC1细胞后能够抑制其增殖、迁移能力,基因联合治疗胰腺癌可能具有潜在的应用价值。
胰腺肿瘤; 细胞系,肿瘤; 缺氧; 转染
肿瘤组织内部因血管分布不均一所造成供血供氧不足的乏氧状态是肿瘤细胞生长的微环境,也是实体肿瘤中十分常见的现象[1]。研究表明,乏氧与肿瘤的抗凋亡、上皮间质转化(EMT)及血管生成有关,可促进肿瘤的增殖和转移[2],同时可降低放、化疗及其他治疗的效果[3]。本研究将抑癌基因PTEN(phosphatase and tensinhomology deleted on chromo-some ten)和肿瘤转移抑制基因KAI1联合转染乏氧条件下的胰腺癌AsPC1细胞,观察其对细胞增殖、迁移的影响,探讨多基因联合治疗的意义。
材料和方法
一、PTEN和KAI1基因双转染
AsPC1细胞株为本科室保存。携带PTEN基因的pEAK8质粒(pE-PTEN)和含有KAI1基因的腺病毒(Ad-KAI1)由我们前期构建[4-5]。利用乏氧设备在完全密闭的方盒中持续通入乏氧气体(1% O2、5% CO2和94% N2),将处于对数生长期的AsPC1细胞在乏氧环境中培养1周后接种到6孔板。采用Lipofectamine 2000(美国Invotrogen公司)将pE-PTEN和Ad-KAI1共同转染AsPC1细胞(双转染组),经筛选后扩增培养。以空质粒pEAK8和腺病毒Ad转染细胞(空转染组)及未转染细胞作为对照。
二、蛋白质印迹法
取2×106个双转染细胞,裂解后收集细胞总蛋白,常规行蛋白质印迹法检测PTEN及KAI1蛋白。PTEN抗体及KAI1抗体均购自美国Santa Cruz公司,以GAPDH作为内参,最后ECL发光显色,采用ImageJ软件分析灰度值。以空转染细胞为对照组。
三、四甲基偶氮唑蓝(MTT)法
PTEN和KAI1双转染的AsPC1细胞接种到96孔板,每孔2×103个细胞,在乏氧环境中培养5 d,每天取5个孔,每孔加入MTT(5 mg/ml)10 μl,4 h后吸出孔内液体,加入DMSO 100 μl,5 min后测各孔490 nm的吸光值(A490值)。以空转染细胞为对照组。以时间为横坐标,A490值为纵坐标,绘制细胞生长曲线。
四、克隆形成实验
将双转染组与空转染组细胞分别接种6孔板,每孔200个细胞,每组设3个复孔,在乏氧环境中培养14 d,中途换液并观察细胞状态。实验终止时PBS洗涤细胞2次,多聚甲醛固定,PBS再洗涤2次,Giemsa染色10 min,去离子水洗涤3次,计数克隆并拍照。
五、Transwell小室实验
Transwell小室(美国Corning公司)的上室加入无血清培养液悬浮的双转染组或空转染组细胞2×104个,下室加入含30%胎牛血清的培养液,在乏氧环境中培养8 h。倒扣小室于吸水纸上以去除培养液,用棉签轻拭去小室上层非穿膜细胞,用Giemsa染色30 min,漂洗数次,显微拍照后10%醋酸溶解,以570 nm的吸光值(A570值)代表细胞的迁移率。
六、统计学处理
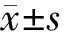
结 果
一、转染效果
双转染组细胞的PTEN和KAI1蛋白表达水平明显升高,分别为空转染组的2.05倍及1.51倍,而空转染组与未转染组间差异无统计学意义(图1)。
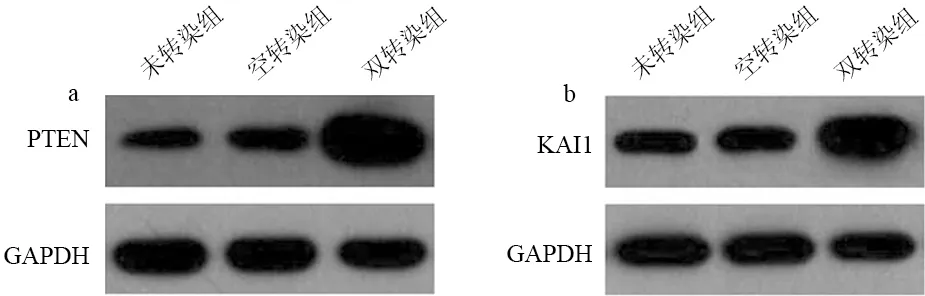
图1 各组细胞的PTEN(a)和KAI1(b)蛋白表达
二、细胞增殖
双转染细胞的增殖速率明显减缓,从第2天起均较空转染组细胞显著降低(P=0.000,图2)。
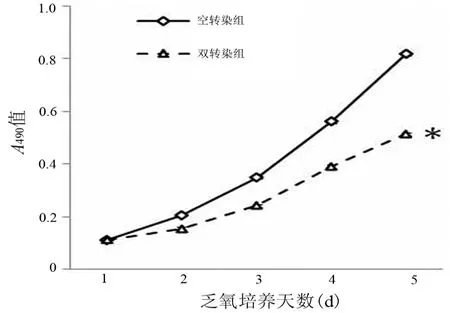
图2 双转染组及空转染组细胞的生长曲线
三、细胞克隆形成
双转染组细胞形成>50个细胞的克隆数为(41.67±5.03)个,空转染组细胞的克隆数为(86.00±7.81)个,双转染组显著低于空转染组(P=0.017)。同时,显微镜下见双转染组细胞形成的单个克隆中的细胞数亦较空转染组少(图3)。
四、细胞迁移能力
双转染组细胞迁移能力较空转染组明显降低(图4)。双转染组细胞的迁移率为0.68±0.05,显著低于空转染组细胞的1.23±0.03(P=0.003)。
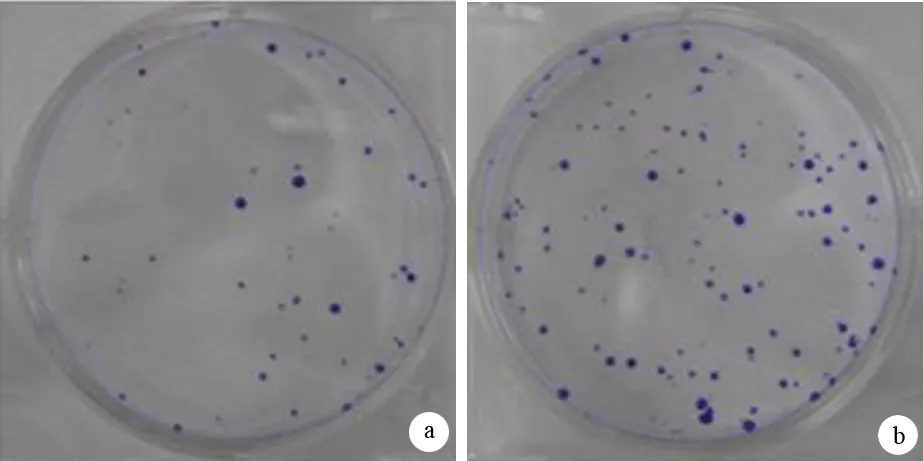
图3 双转染组(a)及空转染组(b)形成的细胞克隆
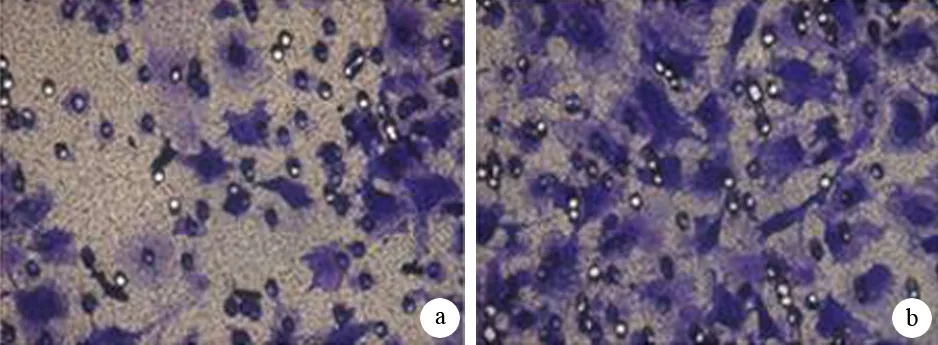
图4 双转染组(a)及空转染组(b)的穿膜细胞(×400)
抑癌基因PTEN是在1997年被分离出的继P53后另一个较为广泛与肿瘤关系密切的抑癌基因,位于10号染色体10q23.3,有9个外显子和8个内含子,是一个高度保守的基因。它调控细胞周期和增殖,抑制细胞的生长[6-8]。我们前期的研究发现,PTEN基因可以使胰腺癌AsPC1细胞阻滞在G2/M期,增加乏氧可诱导AsPC1细胞凋亡以及放射线引起G2/M期细胞阻滞的能力,并且抑制AsPC1细胞在常氧及乏氧情况下的增殖[9-10]。1995年,KAI1/CD82 作为肿瘤转移抑制基因首次从前列腺癌细胞系中分离出来,其属于跨膜4超家族(TM4SF),编码分子质量29 6000的跨膜糖蛋白,具有调节细胞运动、分化和抑制肿瘤转移的作用[11]。我们前期的研究结果显示,KAI1基因与人胰腺癌的转移密切相关。转染KAI1基因后胰腺癌细胞生长受抑,迁移能力减弱;动物体内实验也发现经KAI1质粒注射治疗的荷瘤鼠的瘤体积缩小,肝、肺的转移灶数目减少[12-14]。
我们以往的研究只显示单一基因的作用,未能体现胰腺癌发生、发展中的多基因联合效应,同时对影响胰腺癌预后和治疗敏感性的乏氧环境也缺乏足够的探讨。本研究将PTEN和KAI1基因同时转染ASPC1细胞,并在接近肿瘤自然生存环境的乏氧环境下培养。结果显示,在乏氧条件下,PTEN和KAI1双转染后能够抑制细胞的增殖和克隆形成能力,降低细胞的迁移能力,显示出可喜的应用前景。笔者在此基础上,将对放疗敏感性及动物实验做进一步验证,以提供更加有力的证据。
[1] Otrock ZK, Hatoum HA, Awada AH, et al.Hypoxia-inducible factor in cancer angiogenesis: structure, regulation and clinical perspectives. Crit Rev Oncol Hematol, 2009, 70:93-102.
[2] Hill RP, Marie-Eqyptienne DT, Hedley DW.Cancer stem cells,hypoxia and metastasis. Semin Radiat Oncol, 2009,19:106-111.
[3] Cosse JP, Michiels C.Tumour hypoxia affects the responsiveness of cancer cells to chemotherapy and promotes cancer progression.Anticancer Agents Med Chem, 2008, 8:790-797.
[4] 李宏宇, 于皆平, 郭晓钟, 等. 体外转染PTEN对胰腺癌细胞增殖能力的影响. 中华内科杂志, 2005, 44: 191-194.
[5] 张巍巍,郭晓钟,王立生,等.KAI1复制缺陷型腺病毒载体抑制人胰腺癌细胞迁移实验研究.胰腺病学,2006,6:131-134.
[6] Chu EC, Tarnawski AS. PTEN regulatory functions in tumor suppression and cell biology. Med Sci Monit, 2004, 10: RA235-RA241.
[7] Saito Y, Swanson X, Mhashilkar AM, et al. Adenovirus-mediated transfer of the PTEN gene inhibits human colorectal cancer growth in vitro and in vivo. Gene Ther, 2003,10: 1961-1969.
[8] Yamada KM, Araki M. Tumor suppressor PTEN: modulator of cell signaling, growth, migration and apoptosis. J Cell Sci, 2001, 114: 2375-2382.
[9] 李建军, 李宏宇, 陈延治, 等. 外源性PTEN增强乏氧诱导胰腺癌细胞ASPC-1凋亡. 中华肿瘤杂志, 2006, 28:33-36.
[10] 李宏宇, 于皆平, 郭晓钟, 等. 染色体缺失磷酸酶及张力蛋白同源物对胰腺癌细胞系细胞周期和增殖能力的影响. 中华消化杂志,2005, 25:162-165.
[11] Sridhar SC, Miranti CK. Tetraspanin KAI1/CD82 suppresses invasion by inhibiting integrin-dependent crosstalk with c-Met receptor and Src kinases. Oncogene, 2006,25:2367-2378.
[12] 郭晓钟, 徐建华, 刘民培, 等. KAI1基因抑制胰腺癌细胞转移机制的探讨. 中华内科杂志, 2004, 43: 360-362.
[13] 徐建华, 郭晓钟, 刘民培, 等. KAI1基因转染的胰腺癌细胞系的建立. 胰腺病学,2004, 4:141-144.
[14] 郭晓钟, 刘民培, 夏玉亭,等. KAI1基因与胰腺癌转移的关系. 中华内科杂志, 2000,39:626.
EffectsofPTENandKAI1doublegenetransfectiononproliferation,metastasisonpancreaticcancerAsPC1cellsunderhypoxiccondition
LIHong-yu,LIJian-jun,GUOXiao-zhong,LIUXu,WUChun-yan,ZHAOJia-jun,CHENYan-zhi.
DepartmentofGastroenterology,ShenyangGeneralHospitalofPLA,Shenyang110840,China
GUOXiao-zhong,Email:guoxiaozhong1962@163.com
ObjectiveTo investigate the effects of PTEN and KAI1 double gene transfection on proliferation, metastasis in AsPC1 pancreatic cancer cells under hypoxic condition.MethodsRecombinant vectors that over expressing PTEN and KAI1 protein which was established previously were double transfected into hypoxic AsPC1 cells. Western blot was performed to measure the expression level of PTEN and KAI1. Then, cell proliferation was detected by MTT, and colony forming assay were used to test the ability of tumor cells forming colonies, and transwell assay was used to evaluate metastatic function.ResultsAfter double gene transfection, both PTEN and KAI1 protein expression was significantly up-regulated, which was 2.05 and 1.51 folds higher than that of empty vector group; and cell proliferation of hypoxic AsPC1 cells was suppressed significantly (0.5vs0.8,P=0.00031), number of colony formation was significantly decreased [(41.67±5.03)vs(86.00±7.81),P=0.017)]; the capacity of metastasis was significantly decreased (0.68±0.05vs1.23±0.03,P=0.0025).ConclusionsDouble gene transfection of PTEN and KAI1 could inhibit proliferation and metastatic activity of hypoxic AsPC1 cells, which might indicate that combined gene therapy may play a role in the treatment of pancreatic cancer.
【Keywrods】 Pancreatic neoplasms; Cell line, tumor; Anoxia; Transfection
10.3760/cma.j.issn.1674-1935.2012.02.014
辽宁省博士启动基金(20081044);辽宁省教育厅基金(L2010627)
110840 沈阳,沈阳军区总医院消化内科(李宏宇、郭晓钟、刘旭、吴春燕、赵佳钧);中国医科大学附属第一医院放疗科(李建军、陈延志)
郭晓钟,Email: guoxiaozhong1962@163.com
2011-06-28)
(本文编辑:吕芳萍)

