抑癌基因ppENK甲基化在胰腺癌发病机制中的作用
杨立新 杨红 李景南 郝建宇 钱家鸣
·论著·
抑癌基因ppENK甲基化在胰腺癌发病机制中的作用
杨立新 杨红 李景南 郝建宇 钱家鸣
目的检测胰腺组织ppENK 基因甲基化状态,探讨ppENK基因甲基化在胰腺癌发生发展过程中的作用。方法采用甲基化特异性PCR(MSP)法检测胰腺癌组织、胰腺癌细胞株、正常胰腺组织中ppENK基因甲基化状态,分析其与临床病理特征的关系。RT-PCR法检测组织及细胞ppENK mRNA表达。应用去甲基化药物5-氮杂-2′-脱氧胞苷(5-Aza-dC)处理胰腺癌细胞株(PANC1、AsPC1),采用四甲基偶氮唑蓝(MTT)法检测细胞的增殖,流式细胞仪检测细胞凋亡及细胞周期,蛋白质印迹法检测DNA甲基转移酶3a(DNMT3a)蛋白表达。结果正常胰腺组织表达ppENK mRNA,基因非甲基化。胰腺癌组织ppENK基因甲基化率为90.3%(28/31),ppENK基因甲基化与临床病理特征无相关性。SW1990、PANC1、PC3、AsPC1、PuPan-1胰腺癌细胞株均无ppENK mRNA表达,基因均表现为甲基化,ppENK mRNA表达与其甲基化呈负相关。5-Aza-dC处理后,PANC1、AsPC1细胞的ppENK基因被去甲基化,ppENK mRNA恢复表达;细胞的增殖呈浓度依赖性被抑制;细胞凋亡率增加[(31.57±6.76)%比(3.21±1.43)%,P=0.002,(16.6±8.22)%比(3.82±1.71)%,P=0.058];DNMT3a表达减少;PANC1的G1期细胞比例显著增加[(67.87±2.72)%比(54.57±7.18)%,P=0.040],S期细胞比例显著减少[(22.37±4.31)%比(33.73±4.63)%,P=0.036],AsPC1的G1期、S期细胞比例无明显变化(P=0.236、0.075)。结论ppENK基因甲基化是引起ppENK表达抑制的重要分子事件。ppENK基因去甲基化后可抑制胰腺癌细胞增殖,促进凋亡,细胞周期被阻滞在G1期,DNMT3a蛋白表达减少。
胰腺肿瘤; 前脑啡肽原基因; DNA甲基转移酶3a; 甲基化
某些基因异常甲基化是肿瘤发生过程中一个较早的分子事件。随着对DNA甲基化研究的深入,发现那些因甲基化状态改变而失活的基因序列并未改变,那么改善其甲基化状态有可能使基因恢复表达而作为新的治疗靶点[1]。前脑啡肽原基因(preproenkephalin,ppENK),也称前脑啡肽原A,是有研究前景的与胰腺癌相关的抑癌基因。本研究检测胰腺癌组织及细胞株ppENK甲基化状态,并应用去甲基化药物5-氮杂-2′-脱氧胞苷(5-Aza-dC)处理胰腺癌细胞株,观察其对细胞ppENK基因表达、甲基化状态、细胞增殖、凋亡、细胞周期及DNA甲基转移酶3a(DNMT3a)表达的影响。
材料和方法
一、DNA提取及甲基化修饰
32例胰腺癌标本来自北京协和医院、安徽医科大学附属医院、浙江医科大学附属医院。组织块切片、HE染色后用5 ml注射器针头在显微镜下精确取少许胰腺癌组织,置TE+0.5%Tween20缓冲液中,37℃孵育72 h,95℃ 10 min灭活蛋白酶K,常规提取DNA。人胰腺癌细胞株PANC1、AsPC1、PC3、PuPan-1、SW1990购自美国组织培养库(ATCC),常规培养,提取细胞DNA。应用甲基化修饰试剂盒(Intergen公司)行甲基化修饰,按说明书操作。
二、ppENK基因甲基化及mRNA 表达检测
应用甲基化特异性PCR(methylation-specific PCR,MSP)法检测ppENK基因甲基化。ppENK非甲基化引物上游5′-TTGTGTGGGGAGTTATTGAGT-3′,下游5′-CACCTTCACAAAAAAAATCAATC-3′,产物100 bp;ppENK甲基化引物上游5′-TGTGGG-GAGTTATCGAGC-3′,下游5′-GCCTTCGCGAAAAAA-ATCG-3′,产物96 bp。PCR反应条件:94℃ 13 min,94℃ 30 s,62℃ 30 s,72℃ 30 s,72℃ 3 min,45个循环。应用RT-PCR法检测ppENK mRNA表达。ppENK引物上游5′-CCGAATGCAGCCAGGATTG-3′,下游5′-GTGCTGGTGCCATCTTGAG-3′,产物179 bp。PCR反应条件:95℃ 5 min;95℃ 30 s、60℃ 30 s、72℃ 30 s;循环35次;最终72℃ 10 min;MSP反应条件:94℃ 13 min;94℃ 30 s、62℃ 30 s、72℃ 30 s;最终72℃ 3 min。
三、细胞增殖检测
采用四甲基偶氮唑蓝法(MTT)检测细胞增殖。取1×103个PANC1、ASPC1细胞分别接种于96孔板,培养液中分别含0(对照)、0.4、0.6、0.8、1.0 μmol/L 5-Aza-dC,每个浓度设3个复孔,常规培养1~7 d。每天分别加入10 μl 10 mg/ml MTT孵育4 h后吸出上清液,加入150 μl DMSO充分振荡,在酶标仪上测490 nm的吸光度值(A490值)。实验重复3次,取均值,绘制生长曲线。
四、细胞凋亡、细胞周期检测
采用流式细胞仪检测。AsPC1、PANC1细胞生长至50%~60%融合时加入1 μmol/L 5-Aza-dC,以不加5-Aza-dC作为对照。培养5 d后收获细胞,PBS洗3遍后用70%乙醇5 ml 4℃固定过夜,PBS洗两遍,加1 mg/ml RNaseA 37℃ 孵育30 min,再加20 μg/ml PI 4℃ 放置1 h。上流式细胞仪分别检测凋亡细胞百分率和细胞周期。实验重复3次,取均值。
五、细胞DNMT3a蛋白表达检测
采用蛋白质印迹法检测,按常规方法操作。
六、统计学分析
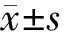
结 果
一、正常胰腺组织、胰腺癌细胞株ppENK mRNA表达及其甲基化状态
正常胰腺组织表达ppENK mRNA,而SW1990、PANC1、PC3、AsPC1、PuPan-1胰腺癌细胞株均无ppENK mRNA表达(图1)。

图1正常胰腺组织(1)及胰腺癌细胞株(2~6)ppENK mRNA表达
正常胰腺组织ppENK为非甲基化,而5株胰腺癌细胞株均出现甲基化(图2)。

图25株胰腺癌细胞株ppENK甲基化状态
二、胰腺癌组织ppENK甲基化状态及其与肿瘤临床病理特征的关系
31例胰腺癌组织中28例有甲基化,甲基化率为90.3%(图3)。胰腺癌组织ppENK甲基化与其临床病理特征均无相关性(表1)。

M:甲基化产物;U:非甲基化产物
图3胰腺癌组织ppENK基因不完全甲基化(1)、甲基化(2)及非甲基化(3)状态

表1 胰腺癌ppENK甲基化与其临床病理特征的关系
注:OR值即下/上相比得到ppENK甲基化的概率
三、5-Aza-dC对胰腺癌细胞增殖的影响
5-Aza-dC处理后,AsPC1、PANC1细胞的增殖均被抑制,且呈浓度依赖性(表2)。
四、5-Aza-dC对胰腺癌细胞凋亡的影响
经5-Aza-dC处理后,PANC1细胞凋亡率显著增加[(31.6±6.8)%比(3.2±1.4)%,P=0.002];AsPC1细胞凋亡率无显著增加[(16.6±8.2)%比(3.8±1.7)%,P=0.058)]。

表2 各组AsPC1、PANC1细胞的A490值
注:与0 μmol/L对照组比较,aP<0.05
五、5-Aza-dC对胰腺癌细胞周期的影响
PANC1、AsPC1的G1期细胞比例分别为(54.57±7.18)%、(52.43±3.46)%,S期细胞为(33.73±4.63)%、(35.20±0.85)%;5-Aza-dC处理后,PANC1、AsPC1的G1期细胞比例分别为(67.87±2.72)%、(61.20±10.35)%,S期细胞为(22.37±4.31)%、(27.27±5.67)%,其中PANC1的G1期细胞比例较未处理组显著增加(P=0.04),S期细胞比例显著降低(P=0.036),而AsPC1的细胞周期无明显变化(P=0.236、0.075)。
六、5-Aza-dC对胰腺癌细胞ppENK mRNA表达、甲基化状态、DNMT3a表达的影响
PANC1、AsPC1细胞不表达ppENK mRNA;5-Aza-dC处理后,PANC1、AsPC1细胞均恢复ppENK mRNA的表达,表达量分别为0.117±0.056、0.336±0.092(图4),且均未检测到ppENK甲基化条带(图5),同时细胞DNMT3a蛋白表达明显减少。

图4正常胰腺(1)、5-Aza-dC处理前后AsPC1(2、3)、PANC1(4、5)及阴性对照(6)的ppENK mRNA表达

M:甲基化产物;U:非甲基化产物
图55-Aza-dC处理后AsPC1(1)、PANC1(2)及胰腺癌组织(3)ppENK甲基化状态
讨 论
ppENK长约5.2kb,由4个外显子和3个内含子组成,位于8号染色体。它编码的甲硫氨酸-脑啡肽(met-enkephalin)由267个氨基酸组成,能够在体内和体外条件下抑制包括结肠癌、胰腺癌、头颈部肿瘤、肾癌、卵巢癌和神经系统肿瘤等肿瘤生长,是有研究前景的与胰腺癌相关的抑癌基因[2-5]。
本研究显示,胰腺癌组织ppENK甲基化率高达90.3%,5株胰腺癌细胞株ppENK基因亦均表现为甲基化,高甲基化的胰腺癌组织或细胞株均无ppENK mRNA表达。而正常胰腺组织的ppENK基因无甲基化,高表达ppENK mRNA。提示ppENK甲基化状态是引起其不表达的重要分子事件。
胰腺癌细胞株PANC1分化程度较高,而AsPC1分化低,转移能力高。给予5-Aza-dC处理后,两株细胞的生长均被抑制,且无明显差异。5-Aza-dC处理后,两株细胞的凋亡率均增加,但PANC1细胞凋亡的增加有统计学意义,而AsPC1细胞凋亡的增加无统计学意义;PANC1细胞G1期比例增加,S期比例减少,与对照组比较差异有统计学意义,而AsPC1细胞周期比例的变化与对照组比较差异无统计学意义。其原因可能为胰腺癌细胞株存在异质性的缘故。
5-Aza-dC处理后,细胞ppENK甲基化被逆转,但未能达到完全去甲基化。ppENK mRNA表达则有不同程度的逆转。若增加5-Aza-dC剂量或许会取得更为理想的效果。
Dnmt3a是主要的从头甲基化酶,在很多癌变组织表达增加,且发生在DNA甲基化之前,可能是引起DNA甲基化异常的原因。本研究显示,PANC1、AsPC1细胞表达DNMT3a,给予5-Aza-dC处理后,DNMT3a蛋白表达较给药前明显减弱,提示DNMT3a在ppENK基因甲基化中可能起了重要作用[6-7]。
[1] Egger G, Liang G, Aparicio A, et al. Epigenetics in human disease and prospects for epigenetic therapy. Nature, 2004,429:457-463.
[2] 朱文玉,王晓民.阿片肽族∥陈元芳,TADATAKA YAMADA.胃肠肽类激素基础与临床.北京:中国协和医科大学出版社,1997.
[3] Cmob M,Seeburg PH,Adelman J, et al.Primary structure of the human Met-and Leu-enkephalin precursor and its mRNA.Natrue,1982,295:663-666.
[4] Jiao L, Zhu J, Hassan MM, et al. K-ras mutation and p16 and preproenkephalin promoter hypermethylation in plasma DNA of pancreatic cancer patients: in relation to cigarette smoking.Pancreas, 2007,34:55-62.
[5] Zagon IS, McLaughlin PJ. Opioid growth factor (OGF) inhibits anchorage-independent growth in human cancer cells. Int J Oncol, 2004,24:1443-1448.
[6] Denis H, Ndlovu MN, Fuks F. Regulation of mammalian DNA methyltransferases: a route to new mechanisms. EMBO Rep, 2011,12:647-656.
[7] Chédin F. The DNMT3 family of mammalian de novo DNA methyltransferases. Prog Mol Biol Transl Sci, 2011,101:255-285.
MethylationstatusoftumorsuppressorgeneppENKinthepathogenesisofpancreaticcarcinoma
YANGLi-xin,YANGHong,LIJing-nan,HAOJian-yu,QIANJia-ming.
DepartmentofGastroenterology,BeijingChaoyangHospital,CapitalMedicalUniversity,Beijing100020,China
QIANJia-ming,Email:yuanjiah@263bj.com
ObjectiveTo detect the methylation status of ppENK and its role in the pathogenesis of pancreatic carcinoma.MethodsThe ppENK methylation status in human tissues of pancreatic cancer, pancreatic carcinoma cell lines and normal pancreas was detected by methylation-specific RT-PCR(MSP). The association of methylation status of ppENK gene with clinicopathological parameters was analyzed. The expression of ppENK mRNA was detected by RT-PCR. Two pancreatic carcinoma cell lines (PANC1, AsPC1) were treated with demethylating agent (5-aza-dC). The cell growth was measured by MTT. Apoptosis and cell cycle was analyzed by flow cytometry. The expression of DNMT3a was measured by Western blot.ResultsppENK mRNA was expressed in normal pancreas. And methylation of ppENK was not detected in normal pancreas. Methylation of ppENK was detected in 90.3%(28/31) of pancreatic carcinoma tissue, and there were no correlation between methylated ppENK with clinicopathological features of pancreatic carcinoma. There was no ppENK mRNA expression in SW1990, PANC1, PC3, AsPC1, PuPan-1, and ppENK was methylated. Methylated ppENK was associated with no ppENK mRNA expression. After 5-Aza-dC treatment, PANC1, AsPC1 was demethylated and ppENK mRNA expression was reversed. The proliferation of PANC1 and AsPC1 was inhibited in a dose dependent manner. The apoptotic rates of PANC1 and AsPC1 were increased [(31.57±6.76)%vs(3.21±1.43)%,P=0.002, (16.6±8.22)%vs(3.82±1.71)%,P=0.058];the expression of DNMT3a protein was decreased; the PANC1 cells of G1phase significantly increased [(67.87±2.72)%vs(54.57±7.18)%,P=0.040], but PANC1 cells of S phase significantly decreased [(22.37±4.31)%vs(33.73±4.63)%,P=0.036]. But the percentage of G1, S phase in AsPC1 cell line was not significantly changed (P=0.236, 0.075).ConclusionsppENK demethylation is an important molecular event in inducing ppENK expression inhibition, which can inhibit pancreatic cancer proliferation, promote apoptosis, arrest cell cycle at G1and decrease the expression of DNMT3a protein.
Pancreatic neoplasms; ppENK; DNMT3a; Methylation
10.3760/cma.j.issn.1674-1935.2012.02.012
100020 北京,首都医科大学附属北京朝阳医院消化科(杨立新、郝建宇);中国医学科学院 中国协和医科大学 北京协和医院消化科(杨红、李景南、钱家鸣)
钱家鸣,Email:yuanjiah@263bj.com
2011-10-31)
(本文编辑:屠振兴)

