氧化震颤素对AVP引起低温的影响与环境温度的关系
沈字玲 杨永录 王 念 孟 立 唐 瑜
精氨酸加压素(arginine vasopressin,AVP)是体内一种重要的内源性退热物质,有限制发热和促进退热的作用[1~3]。值得关注的是有一些研究发现,AVP在正常体温调节中也有重要作用,往动物大脑腹中隔区注射AVP能引起正常动物体温降低;当狗的前脑基底部局部受热时,可见血浆中AVP浓度明显升高;视前区及隔区受热时,AVP升高尤其明显[2,3]。最近笔者研究发现,内源性AVP通过V1a受体参与昼光期正常大鼠紧张性体温调节过程,在昼光期不仅血浆中AVP浓度明显高于暗光期,而且V1a受体阻断剂也能明显升高正常大鼠体温[4]。另外,乙酰胆碱(acetylcholine,ACh)也参与体温调节过程,不仅能降低机体产热和提高散热反应,而且还能促进内源性退热物质AVP的分泌或释放[5~7]。所以,本实验观察了胆碱能激动剂氧化震颤素在AVP引起低温中的作用以及环境温度变化对二者引起低温反应的影响。
材料与方法
1.动物与试剂:实验用成年雌性SD大鼠112只(四川省医学科学院实验动物中心提供),体重200~250g。AVP、氧化震颤素和甲基东莨菪碱均购买于Sigma公司。用生理盐水将AVP配置成10μg/m l溶液于-40℃保存。为消除氧化震颤素的外周作用,实验用1.0mg/m l外周胆碱能阻断剂甲基东莨菪碱溶液,将氧化震颤素配置成0.25mg/ml的溶液于4℃保存,以备实验用。
2.动物手术:腹腔注射4%戊巴比妥钠(40mg/kg)麻醉大鼠,剔去腹部手术部位鼠毛,将动物置于大鼠手术台上,用碘伏常规消毒手术部位,腹部正中线做1.5cm切口,腹腔置入无线温度遥测传感器(DSI公司,model TA10TA-F40),用于测量动物体核温度(Tc)和活动变化,最后缝合腹部肌肉和皮肤。手术结束后,所有动物肌内注射青霉素2×104U预防感染,分别单笼饲养7天以上进行实验。
3.Tc和活动的纪录:采用美国DSI公司无线遥控测温系统测量大鼠Tc和活动。实验前1天下午,将腹腔内埋置传感器的大鼠称重后移入清洁鼠笼,置于人工气候箱的无线摇测信号接收板上适应性过夜,动物处于自由活动、进食进水状态。气候箱温度按要求分别设置为25℃、30℃和18℃,湿度70%~80%,箱内明暗时间各12h,昼光时间早6:00~晚18:00。实验当天上午8:00开始记录大鼠Tc和活动,10:00给药,连续观察7h。每隔5min记录1次Tc和活动,活动信号根据动物在鼠笼内移动时,腹腔内传感器的天线在接收板上所处位置的不同来反映。
4.实验分组与步骤:分别观察中性(25℃)、热(30℃)和冷(18℃)环境中,氧化震颤素和AVP引起大鼠Tc和活动的变化。每个环境温度均分为4组,分别是对照组(盐水+盐水)、氧化震颤素组(氧化震颤素 +盐水)、AVP组(盐水 +AVP)、氧化震颤素+AVP组。每组不少于8只。实验当天上午10时给大鼠皮下注射生理盐水(1m l/kg)或氧化震颤素(0.25mg/kg)后立刻腹腔注射生理盐水(1m l/kg)或AVP(10μg/kg)。
5.统计学方法:采用SPSS 13.0进行统计学分析。实验数据用均数±标准差(x±s)表示。不同环境温度中,AVP和氧化震颤素对大鼠Tc和活动变化的影响采用方差分析(ANOVA),P<0.05为差异有统计学意义。
结 果
1.不同环境温度对AVP引起大鼠低温和活动变化的影响:25℃、30℃和18℃环境中,大鼠在给药前的基线体温和活动无明显差异,分别给3种环境温度中的大鼠注射AVP后,均引起Tc迅速降低,活动轻度增加,低温反应维持2h后恢复至给药前水平(图1~图3)。18℃环境中大鼠Tc的降低明显>25℃(P<0.05,图1~图3)和30℃(P<0.01,图1~图3)。18℃环境中Tc较给药前降低2.75±0.83℃,而25℃和30℃环境中Tc 较给药前分别降低1.75 ±0.41℃和1.41 ±0.54℃。不同环境温度中的对照组大鼠注射生理盐水后,Tc升高,活动增加,约1h后恢复正常(图1~图3)。
2.不同环境温度对氧化震颤素引起大鼠低温和活动变化的影响:分别给3种环境中的大鼠注射氧化震颤素后均引起Tc迅速降低,活动轻度增加,低温反应维持2h后恢复至给药前水平(图1~图3)。18℃环境中Tc的降低明显 >25℃和30℃(P<0.01,图1~图3)。18℃环境中 Tc较给药前降低3.22±0.63℃,而25℃和30℃环境中Tc较给药前分别降低1.89 ±0.59℃和1.55 ±0.51℃(图1 ~ 图3)。
3.氧化震颤素在AVP引起大鼠低温中的作用及环境温度变化对二者引起低温反应的影响:3种环境温度中,给大鼠皮下注射氧化震颤素再立刻腹腔注射AVP后均引起Tc迅速降低,而且均明显低于AVP组(P<0.05,图1~图3),活动轻度增加,低温反应维持3.3h后恢复至给药前水平。在18℃环境中,Tc的降低明显>25℃(P<0.05,图1~图3)和30℃(P<0.01,图1~图3)。18℃环境中 Tc较给药前降低3.82±0.59℃,而25℃和30℃环境中Tc较给药前分别降低2.65 ±0.89℃和1.99 ±0.66℃。

图1 25℃环境中皮下注射生理盐水或氧化震颤素后即刻腹腔注射生理盐水或AVP引起大鼠腹腔温度(A)和活动度(B)变化的时间曲线
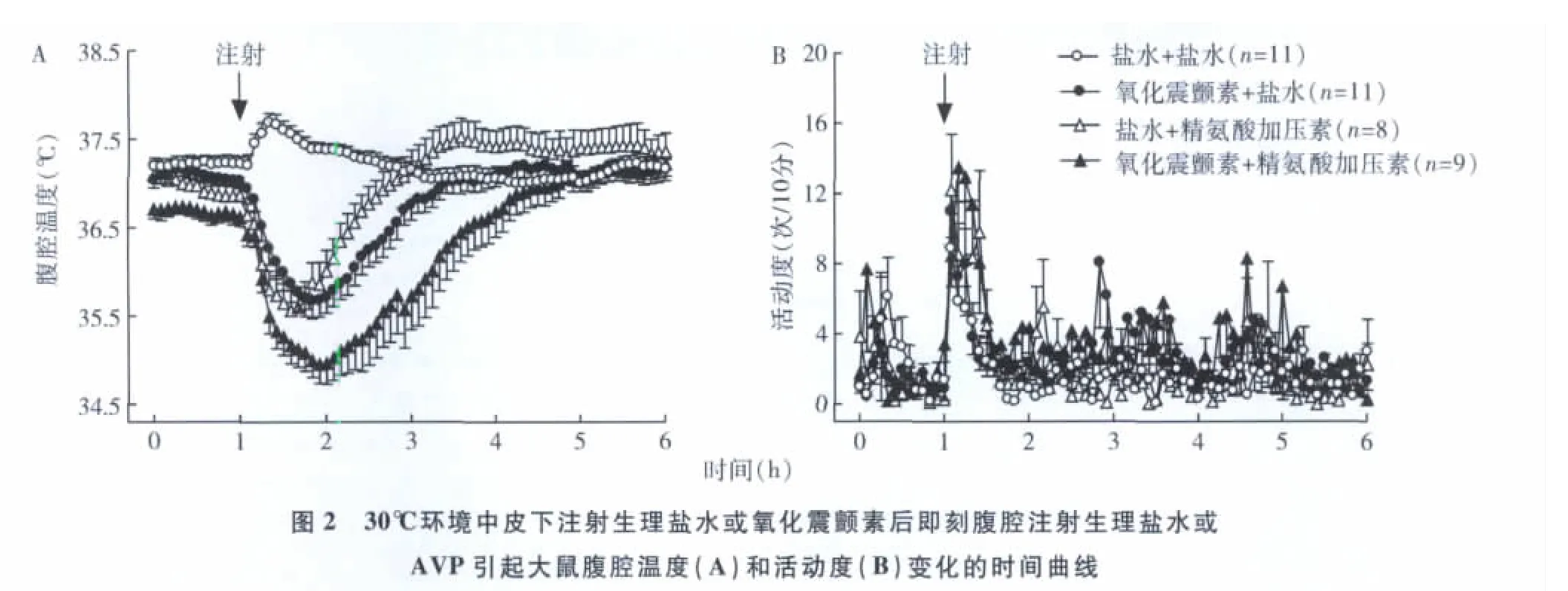
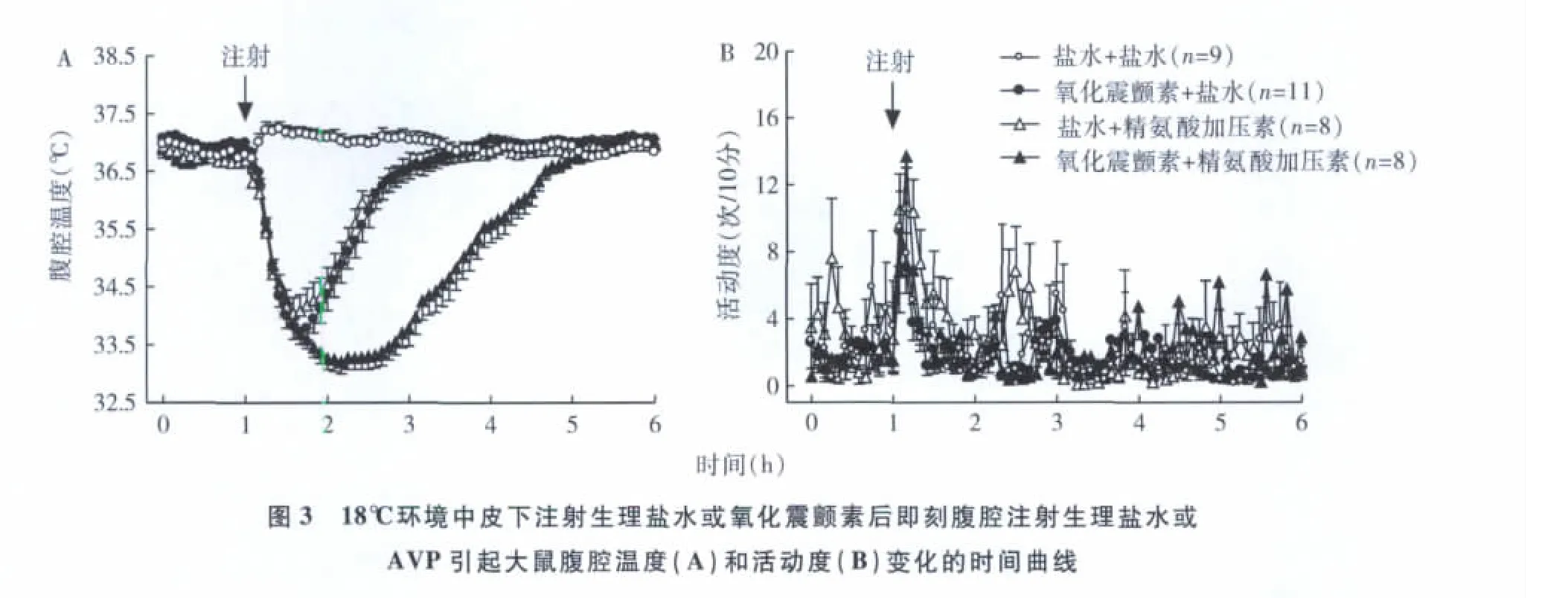
讨 论
环境温度发生变化时,恒温动物在体温调节中枢的控制下,机体产热和散热能力发生相应改变,使体温维持于相对稳定的状态。通常将机体新陈代谢率和皮肤散热量处于最低状态,耗能最少,感到最舒适的环境温度范围称为热中性温度区。当环境温度低于中性温度区时,除了外周血管收缩,皮肤散热减少外,机体还可以通过战栗或非战栗产热,以补充丢失到环境中的热量。环境温度高于中性温度区时,皮肤血管舒张,散热增加,当环境温度接近和大于体核温度时,机体通过蒸发散热保持热平衡[8]。本实验中,在25℃、30℃和18℃环境中给大鼠注射生理盐水后,体温和活动均迅速升高,这是由于注射药物的刺激和移动动物引起的应激性体温过高反应。
在热中性环境温度中,AVP引起正常大鼠体温降低,说明AVP不仅具有退热和限制发热的作用,对正常大鼠体温也有调节作用[1~3]。我们的前期工作发现,使用AVP V1a受体阻断剂可以明显提高正常大鼠的体温,提示AVP引起的低温反应可能与AVP V1a受体的作用有关。实验中还发现,环境温度的降低使AVP引起的低温反应更明显,说明AVP引起的是调节性低温,可能与体温调定点的下移有关[4]。因为通常机体在冷环境中会引起产热增加,使体温维持在正常水平。既然环境温度降低能促进AVP引起的低温反应,说明当动物暴露在冷环境时,AVP仍然能抑制产热或增加散热。调定点学说认为,视前区—下丘脑前部(PO/AH区)在体温调节中起着调定点的作用,调定点规定的温度值高低决定着体温水平。当体温与调定点水平一致时,产热和散热取得平衡。当调定点下移,低于体核温度时,动物产热减少而散热增加,动物选择凉爽或冷环境,使体温与环境温度差距更大,有助于增加散热,这种反应一直持续到体核温度达到调定点规定的温度值,使机体处于低温状态[9]。大鼠尾部是主要的散热器官,当环境温度在28℃以下,体内热量约25%经尾部皮肤血管舒张而散失[10]。环境温度的降低使AVP引起的低温反应更明显的原因,可能是环境温度的降低使体核温度和环境温度的差距增大,有利于尾部皮肤散热,体温因散热量的增加而下降更明显。
在中性、热和冷3种环境温度中,氧化震颤素均能引起大鼠低温反应,而且环境温度的降低使氧化震颤素引起的低温反应更明显。提示氧化震颤素激活中枢胆碱能系统引起的低温也是一种调节性低温,可能与体温调定点的下移有关。由此可见,氧化震颤素引起低温的机制与AVP相似,所以本实验又观察了氧化震颤素对AVP引起低温的影响及其与环境温度变化的关系。实验证明,在中性、热和冷3种环境中,氧化震颤素均能使AVP引起的低温反应更明显,且动物维持在低温状态的时间更长,体温的恢复明显延迟,说明中枢胆碱能系统可能参与了AVP引起的低温反应。本实验室前期研究发现,可逆性抗胆碱酯酶药毒扁豆碱和难逆性抗胆碱酯酶药毒死蜱在引起低温反应的同时均能促进下丘脑AVP的分泌[10,11]。因此,氧化震颤素增强AVP引起的大鼠低温反应的作用,可能与其激活中枢胆碱能系统,促进下丘脑视上核和室旁核AVP的分泌,进而使血液中AVP的浓度在较长时间内维持在较高水平有关。实验中还发现,环境温度的降低使氧化震颤增强AVP引起低温反应的作用更明显,提示氧化震颤素可能通过影响体温调定点参与AVP引起的低温反应。当体温调定点下移低于体核温度时,动物产热减少而散热增加,由于环境温度的降低使体核温度和环境温度的差距增大,更有利于尾部皮肤散热,所以体温下降更明显。
总之,环境温度的降低使AVP引起的低温反应更明显,提示AVP引起的低温可能与体温调定点下移有关。氧化震颤素能够增强AVP引起的低温反应,而且这种作用在冷环境中更明显,所以氧化震颤素可能通过影响调定点参与AVP引起的低温反应。
1 Richmond CA.The Role of Arginine Vasopressin in Thermoregulation during Fever[J].JNeurosci Nurs,2003,35(5):281 -286
2 Roth J.Endogenous antipyretics[J].Clin Chim Acta,2006,371(1-2):13-24
3 杨永录,沈字玲,黄涛.精氨酸加压素在调节性低温中的作用及其机制的研究进展[J].成都医学院学报,2009,4(1):61-65
4 杨永录,赖雁,唐瑜,等.内源性精氨酸加压素在昼光期大鼠紧张性体温调节中的作用[J].中国病理生理杂志,2011,27(12):2345-2350
5 Rodrigues AG,Lima NRV,Coimbra CC,et al.Intracerebroventricular physostigmine facilitatesheat lossmechanisms in running rats[J].JAppl Physiol,2004,97(1):333 -338
6 Prímola - Gomes TN,Pires W,Rodrigues LOC,et al.Activation of the central cholinergic pathway increases post-exercise tail heat loss in rats[J].Neurosci Lett,2007,413(1):1 -5
7 Raber J,Pich EM,Koob GF,et al.IL-1B potentiate the acetylcholine-induced release of vasopressin from the hypothalamus in vitro,but not from the amygdale[J].Neuroendocrinology,1994,59(3):208-217
8 杨永录,刘亚国.体温生理学——基础与临床[M].北京:人民军医出版社,2007:1-88
9 Gordon CJ.The therapeutic potential of regulated hypothermia[J].Emerg Med J,2001,18(2):81-89
10 Yang YL,Gordon CJ.Possible role of vasopressin in the thermoregulation response to chlorpyrifos in the rat[J].Pharmacol Toxicol,2002,90(6):311-316
11 Yang YL,Shen ZL,Zou Q,etal.Physostigmine-induced hypothermic response in rats and its relationship with endogenous arginine vasopressin[J].Life Sci,2009,85(15 -16):586 -591

