血清FS及CA125用于卵巢癌诊断的比较研究
陈芳芳,任 平,于 宏,柳忠辉,侯文佳,孙 洋,牛立慢,崔雪玲*
(1.吉林大学中日联谊医院 唐 敖庆特聘教授实验室,吉林 长 春130033;2.吉林大学第一医院,长春130021;3.吉林大学白求恩医学院免疫学系,长春130021)
卵巢癌是女性最常见恶性肿瘤,预警主要是检测肿瘤标志物CA125,但有关研究显示,CA125的检测并不能有效地降低死亡率[1]。因此,寻找更有效的卵巢癌肿瘤诊断标志物具有重要意义。卵泡抑素(Follistatin,FS)最初是从猪和牛的卵泡液中分离获得的单链糖蛋白,能够抑制垂体前叶腺细胞分泌卵泡刺激素(FSH)[2,3]。研究发现,FS不仅在性腺组织表达,在外周血中也能检测到FS成熟蛋白的分泌,血清中FS水平变化与女性妊娠以及肿瘤等有关[4,5]。为了明确外周血FS在卵巢肿瘤诊断中的意义,本研究通过比较卵巢癌患者外周血FS及CA125水平变化及二者用于卵巢癌诊断的敏感度和特异性,进而阐述FS在临床诊断卵巢癌中的意义。
1 材料与方法
1.1 主要试剂 FS ELISA检测试剂盒购自R&D(Minneapolis,MN,USA),CA125电化学发光试剂盒购自罗氏公司(Mannheim,GER)。
1.2 研究对象 选择自2009年1月至2011年12月在吉林大学第一医院及中日联谊医院住院的经病理和细胞学诊断证实的卵巢癌及卵巢囊肿患者。对照组来自吉林大学第一医院体检中心体检的健康女性。
1.3 血清样本处理 血清采自患者入院后第二日晨时空腹静脉血,经3 000 r/min离心10 min,分离血清,-80℃保存待测。
1.4 ELISA法检测血清FS 按照试剂盒操作说明检测血清中FS水平,测定450 nm波长光吸收值,根据标准曲线计算血清FS含量。
1.5 电化学发光法检测血清CA125 采用电化学发光双抗体夹心法检测血清中CA125水平。首先在标本中加入生物素化的抗CA125亚单位的单克隆抗体和钌标记的抗CA125另一亚单位单克隆抗体并将反应体系混匀,形成双抗体夹心抗原抗体复合物;然后添加链霉亲和素包被的磁性微粒进行孵育,抗原抗体复合体与磁珠通过生物素和链霉亲和素的作用结合。将反应液吸入测量池中,通过电磁作用将磁珠吸附在电极表面,给电极加以一定的电压,使复合体化学发光,并通过光电倍增器测量发光强度,根据标准曲线计算CA125含量。
1.6 统计学方法 所得数据采用IBM SPSS(version 19.0,IBM Inc.,NY,USA)统计软件进行分析。采用ANOVA统计方法比较各组数据之间的差异,ROC曲线分析CA125及FS在卵巢癌诊断中的工作能力,以健康对照组95%可信区间衡量CA125、FS的敏感度和特异性,P≤0.05具有统计学意义。
2 结果
2.1 研究对象临床特征
健康对照组60例,均为健康成年女性,卵巢囊肿患者40例,卵巢癌患者45例。各组在年龄上比较差异无显著性(P>0.05)。见表1。

表1 实验分组及临床资料
2.2 卵巢癌患者外周血FS及CA125水平比较
分别采用ELISA和电化学发光法检测健康成年女性、卵巢囊肿及卵巢癌患者血清FS及CA125水平,结果如图1所示,卵巢癌患者外周血FS及CA125水平明显高于健康对照组及卵巢囊肿,P<0.01。不同的是,卵巢囊肿患者外周血CA125水平明显高于健康对照组,而FS水平较健康对照组无明显差异。

图1 ELISA法及电化学发光法检测卵巢癌、卵巢囊肿、健康对照组外周血FS及CA125水平
2.3 外周血FS、CA125检测用于卵巢癌诊断敏感性及特异性比较 以对照组95%可信区间判断CA125、FS用于卵巢癌诊断的敏感性和特异性,结果如表2所示,血清CA125检测敏感性(77.8%)高于FS(53.3%),而血清FS检测特异性(93.3%)远高于CA125(65%)。

表2 各组血清FS、CA125阳性率
2.4 共同检测卵巢癌患者血清FS和CA125结果比较 CA125是常用的卵巢癌诊断血清学标记物,因此,我们进一步分析卵巢癌患者血清FS水平与CA125水平的相关性。结果表明,在24例CA125阳性的卵巢癌患者中有23例FS呈阳性,这表明卵巢癌患者血清FS和CA-125密切相关(23/24=95.8%)。由于血清CA125在良性卵巢囊肿患者有较高的假阳性率,因此,我们还检测了16例CA125阳性的卵巢囊肿及健康对照者血清FS水平。结果显示,这16血清FS均为阴性。此外,利用ROC曲线评价FS、CA125用于卵巢癌诊断的准确性,结果如图2所示,FS应用于卵巢癌诊断时曲线下面积(0.902)与 CA125相似(0.886),特异性高于 CA-125。上述结果表明,血清FS可能被用来作为卵巢癌诊断的肿瘤标志物,与CA125联合检测有助于提高诊断特异性。
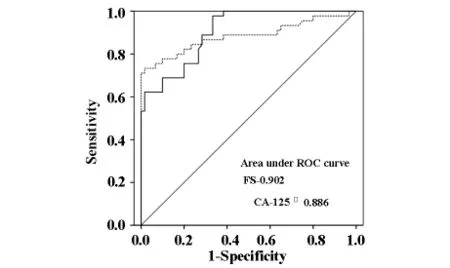
图2 外周血FS及CA125水平用于卵巢癌诊断的ROC曲线
3 讨论
卵巢癌是女性生殖系统常见的恶性肿瘤,因早期无症状、发现的时候大多数患者已处于晚期、死亡率高而被称为“安静的”杀手。决定卵巢癌患者生存率最重要的因素就是诊断的阶段,卵巢癌局限于子宫时5年生存率为70-82%。然而,大多数卵巢癌患者诊断时已处在疾病的进展期,5年生存率仅为15%[6]。
目前卵巢癌的临床诊断主要包括以CA125为主的肿瘤标记物的血清学检测以及阴道镜等侵入性检查。CA125是女性生殖系统肿瘤的常规检测指标之一,通常表达于子宫内膜、子宫颈及输卵管以及腹膜、心包膜、胸膜的上皮细胞。尽管CA125被广泛用于检测生殖系统肿瘤,但仍存在许多挑战,一个首要的问题就是对于早期卵巢癌的敏感性过低和假阳性高,因为在排卵或者子宫内膜移位、子宫肌瘤及其他一些良性肿瘤时CA125也会同时升高。另外,识别CA125检测阳性的指标 (30 or 35 U/m L)是通过有临床症状的患者建立起来的,该指标不适合用于筛查无症状的卵巢癌患者。Saundra S.Buys等人[1]花费了8年观察CA125及阴道镜作为筛查手段对卵巢癌死亡率的影响,共对39,105个妇女进行了4年以上的每年一次的筛查,同时选取了39,111个妇女作为对照。研究结果表明,该筛查手段与对照组相比并没有降低死亡率,69%经该筛查项目诊断的卵巢癌患者已经处于晚期,稍稍低于对照组,说明检测CA125及阴道镜检测并不能诊断早期卵巢癌;如果把CA125血清水平阳性阈值降低(低于常规35 U/ml),则有可能有助于卵巢癌早期诊断,但是会因为更多的假阳性诊断而花费不必要代价——更多的侵入性检查及其相关的痛苦。在日本的静岗市,同样采用CA125及阴道镜作为筛查手段历时9年对60,000多日本女性进行卵巢癌的筛查,结果表明,干预组有35人患病而对照组有32人患病,同样提示该筛查手段对肿瘤的早期诊断无价值[7]。本实验研究结果表明,卵巢癌患者外周血CA125检测阳性率为77.8%,但是卵巢囊肿患者外周血CA125检测阳性率也很高,为25%,健康对照组阳性率为10%。可见,外周血CA125用于卵巢癌诊断时其假阳性率较高,必定会给良性疾病患者甚至是健康人带来不必要的精神和经济负担以及不必要的侵入性检查引起的创伤。可见,寻找有效的卵巢癌诊断指标具有重要的意义。
FS与激活素的相互作用共同调控卵巢排卵[8]和卵巢损伤上皮的修复[9]与细胞增殖[10,11],FS与激活素共同存在、共同表达构成一个维持卵巢正常生长的平衡系统,其中一项的过度表达或另一项的减少引起的激活素-FS系统的失衡,将伴随卵巢生理过程的失调和肿瘤的发生[12-16]。本研究在部分肿瘤患者外周血中检测到FS水平升高,以卵巢癌患者的升高最明显,阳性率最高(53.3%),肝癌患者FS的阳性率为25%[17],其他肿瘤患者的FS水平与健康人比无显著差异。因此,外周血FS有可能成为一种有效的临床辅助卵巢癌诊断的肿瘤指标物。我们选取临床常用的卵巢癌诊断血清标记物CA125作为对照,探讨血清FS用于卵巢癌诊断的准确性。
与CA125相比,血清FS检测阳性率(53.3%)虽然略低于CA125,但其特异性远远高于CA125。在60例健康人及40例卵巢囊肿患者中,血清FS的检测特异性分别为98.3%和95%,而CA125的特异性只有75%;FS在不同病理类型卵巢癌中表达强度不同[17],而CA125表达强度与卵巢癌分型无关,可见FS除了诊断特异性高于CA125外,对卵巢癌的临床病理分型也具有一定的辅助诊断意义。同时检测卵巢癌、卵巢囊肿、健康对照组外周血FS及CA125水平表明,卵巢癌患者血清FS和CA-125密切相关,相关性为95.8%,ROC曲线结果同样说明,外周血FS检测用于卵巢癌的诊断的工作能力与CA125相似,特异性略高于CA125,证明FS是一个很有意义的卵巢癌诊断血清学标志物。
综上所述,本研究证实,具有广泛组织分布,参与多种生物学作用的FS在卵巢癌患者外周血中高表达,外周血FS水平测定与CA125一样,对卵巢癌的临床诊断具有一定的价值,与CA125联合应用,有助于提高卵巢癌诊断的特异性。
[1]Buys SS,Partridge E,Black A,et al.Effect of screening on ovarian cancer mortality:the Prostate,Lung,Colorectal and Ovarian(PLCO)Cancer Screening Randomized Controlled Trial[J].JAMA,2011,305(22):2295.
[2]Robertson DM,Klein R,de Vos FL,et al.The isolation of polypeptides with FSH suppressing activity from bovine follicular fluid which are structurally different to inhibin[J].Biochem Biophys Res Commun,1987,149(2):744.
[3]Ueno N,Ling N,Ying SY,et al.Isolation and partial characterization of follistatin:a single-chain Mr 35,000 monomeric protein that inhibits the release of follicle-stimulating hormone[J].Proc Natl Acad Sci USA,1987,84(23):8282.
[4]Wakatsuki M,Shintani Y,Abe M,et al.Immunoradiometric assay for follistatin:Serum Immunoreactive follistatin level in normal adult and pregnant women[J].Clin Endocrinol Metab,1996,81(2):630.
[5]Liu ZH,Shintani Y,Sakamoto Y,et al.Effects of LHRH,FSH and activin A on follistatin secretion from cultured rat anterior pituitary cells[J].Endocrine,1996,43(3):321.
[6]Brown PO,Palmer C:The preclinical natural history of serous ovarian cancer:defining the target for early detection[J].PLoS Med,2009,6(7):e1000114.
[7]Kobayashi H,Yamada Y,Sado T,et al.A randomized study of screening for ovarian cancer:a multicenter study in Japan[J].Int J Gynecol Cancer,2008,18(3):414.
[8]Schneyer AL,Fujiwara T,Fox J,et al.Dynamic changes in the intrafollicular inhibin/activin/follistatin axis during human follicular development:relationship to circulating hormone concentrations[J].Clin Endocrinol Metab,2000,85(9):3319.
[9]Harrison CA,Gray PC,Vale WW,et al.Antagonists of activin signaling:mechanisms and potential biological applications[J].Trends Endocrinol Metab,2005,16(2):73.
[10]Di Simone N,Crowley WF Jr,Wang QF,et al.Characterization of inhibin/activin subunit,follistatin,and activin type II receptors in human ovarian cancer cell lines:a potential role in autocrine growth regulation[J].Endocrinology,1996,137(2):486.
[11]Xu G,Zhou H,Wang Q,et al.Activin Receptor-Like Kinase 7 Induces Apoptosis through Up-Regulation of Bax and Down-Regulation of Xiap in Normal and Malignant Ovarian Epithelial Cell Lines[J].Mol Cancer Res,2006,4(4):235.
[12]Leung PH,Salamonsen LA,Findlay JK.Immunolocalization of inhibin and activin subunits in human endometrium across the menstrual cycle[J].Hum Reprod,1998,13(12):3469.
[13]Ingman WV,Jones RL.Cytokine knockouts in reproduction:the use of gene ablation to dissect roles of cytokines in reproductive biology[J].Hum Reprod Update,2008,14(2):179.
[14]Kimura F,Bonomi LM,Schneyer AL.Follistatin regulates germ cell nest breakdown and primordial follicle formation[J].Endocrinology,2011,152(2):697.
[15]Do TV,Kubba LA,Antenos M,et al.The role of activin A and Akt/GSK signaling in ovarian tumor biology[J].Endocrinology,2008,149(8):3809.
[16]Mabuchi Y,Yamoto M,Minami S,et al.Immunohistochemical localization of inhibin and activin subunits,activin receptors and Smads in ovarian endometriosis[J].Int J Mol Med,2010,25(1):17.
[17]陈芳芳,王轶楠,汪 丽,等.血清卵泡抑素水平检测用于卵巢癌诊断的研究[J].中国实验诊断学,2010,14(2):207.

