实时荧光PCR法与流式细胞术两种方法检测HLA-B27的比较
陈慧毅,褚为靖,张会英*,葛艳玲,张 茜
(1.北京积水潭医院 检验科,北京100035;2.卫生部北京医院 检验科)
人类白细胞抗原(HLA)是一组位于人体细胞膜表面能够识别“自己”或“非己”的抗原分子,由位于人类6号染色体短臂上的一组主要组织相容性复合体基因(MCH)编码。这些基因包括很多基因座位,例如:HLA-A,HLA-B,HLA-DR等,每个基因座位包括很多等位基因。其中HLA-B27是HLAB基因座位上的一个重要的等位基因。现在研究表明HLA-B27与强直性脊柱炎(Ankylosing spondylitis,AS)具有高度的相关性[1]。Brown等[2]报道AS患者中,HLA-B27抗原呈阳性者高达94%,而健康人群仅为9%。因此,HLA-B27检测已经成为临床上支持AS诊断的重要依据。检测HLA-B27的方法有多种,大多数实验室常采用的有:微量细胞毒试验、酶联免疫方法、流式细胞仪检测法、PCR法等。以PCR为基础的多种分子生物学技术被用于检测 HLA-B27基因型,如 PCR-RFLP、PCR-SSP、PCR-SSO和PCR-LBT等,这些方法都需要在PCR后进行凝胶电泳,而且使用强诱变剂EB为染料,不仅费时费力,而且容易造成污染而出现假阳性结果,使这些PCR方法的应用受到一定的限制。实时荧光PCR是20世纪90年代发展起来的新型核酸检测技术,此法将先进的光学设备、温控技术、荧光素标记技术、核酸扩增技术以及计算机软件有机地结合起来,能够对PCR每一循环的荧光强度进行检测,故称为实时荧光PCR。本研究采用实时荧光PCR和流式细胞术检测HLA-B27,比较两种方法的优缺点。
1 材料与方法
1.1 材料
1.1.1 标本来源 2010年8月至2011年3月北京积水潭医院门诊或住院患者138例,其中男85例,女53例。对收集到的138例外周静脉血同时采用荧光PCR染料法和流式细胞术检测HLA-B27。
1.2 仪器和试剂
1.2.1 流式细胞仪(EPICS-XL)和样品制备仪(EPICS Immunology Workstation,Coulter Q-prep)购于美国贝克曼库尔特公司。流式细胞仪检测用试剂,异硫氰酸荧光素/藻红蛋白(FITC/PE)标 记 的 HLA-B27/HLA-B7 单 克 隆 抗 体、IgG1-FITC/IgG2a-PE 和 CD4-FITC/CD8-PE 荧 光抗 体购于法国Immunotech公司;荧光校准微球(Flow Check)及样品制备试剂(ImmunoPrep Reagent System)购于美国贝克曼库尔特公司。
1.2.2 PCR扩增仪(Roche LightCycler 480),微型高速离心机(Microfuge 22Rcentrifuge)购于美国贝克曼库尔特公司,恒温金属浴(HB-100)购于杭州博日科技有限公司,血液基因组DNA提取试剂盒购于天根公司,HLA-B27荧光PCR基因检测试剂盒购于博奥生物有限公司。
1.3 方法
1.3.1 流式细胞术检测人类白细胞抗原HLA-B27的步骤
(1)血样采集:空腹抽取静脉血2ml,EDTA-K3(乙二胺四乙酸三钾)抗凝。(2)细胞荧光染色:取3支流式细胞仪专用试管,分别标注对照管、补偿管和患者血样管。对照管加IgG1-FITC/IgG2a-PE荧光抗体10μl,补偿管加CD4-FITC/CD8-PE荧光抗体10μl,患者血样管加 HLA-B27-FITC/HLA-B7-PE荧光抗体10μl。然后分别在3支试管中加入患者EDTA抗凝全血各100μl,轻轻混匀。室温避光保存15-20min。(3)样品制备:使用样品制备仪进行溶血和固定。(4)洗涤和离心:将制备样品管放置离心机内,580×g离心5min;离心后弃上清液。向含沉淀细胞的试管中加入pH值为7.2的PBS液1 ml,混匀。580×g再次离心5min,弃上清液,再次向含沉淀细胞的试管中加入pH值为7.2的PBS液1ml,混匀备用。(5)流式细胞仪检测:上机检测前,用荧光校准微球校正流式细胞仪光路和流路,使变异系数值(CV)在2.0之内。建立并选定流式细胞仪检测HLA-B27的方案。将对照管插入仪器的进样口,找出3组细胞,选择1个细胞群,调节确定合适的放大电压。将补偿管插入仪器的进样口,调节荧光补偿。将患者血样管插入仪器进样口,当标本的淋巴细胞计数>5 000时,根据HLA-B27细胞数表达的百分比和平均荧光强度判断检测结果。(6)结果判断HLA-B27阳性结果判断方法为:B27表达的细胞数>90%和平均荧光强度>8。
1.3.2 实时荧光PCR法检测人类白细胞抗原HLA-B27步骤
(1)血样采集:空腹抽取静脉血2ml,乙二胺四乙酸三钾(EDTA-K3)抗凝。(2)提取基因组:取血液样本500μl,放入1.5ml离心管中,加入1ml的细胞裂解液,颠倒混匀,1 1500×g离心1min,弃去上清,留下细胞核沉淀。向离心收集到的细胞核沉淀中加入200μl缓冲液GS,再加入20μl蛋白酶K溶液和200μl缓冲液GB,充分颠倒混匀,56℃放置15分钟,直至溶液变清亮。加入200μl无水乙醇,充分颠倒混匀。将上述所得溶液加入到吸附柱中,13 400×g离心30s,弃去收集管中废液。向吸附柱中加入500μl缓冲液GD,13 400×g离心30s,弃去收集管中废液。向吸附柱中加入700μl漂洗液,13 400×g离心30s,弃去收集管中废液。向吸附柱中加入500μl漂洗液,13 400×g离心30s,弃去收集管中废液。将吸附柱放回收集管,13 400×g离心2min,倒掉废液。将吸附柱置于室温放置15 min,以彻底晾干吸附材料中残余的漂洗液。将吸附柱转入一个干净的离心管中,滴加50μl洗脱缓冲液TB,室温放置3min,13 400×g离心2min,将基因组收集到离心管中。(3)基因扩增:从试剂盒中取出PCR反应液,室温融化。分别向装有PCR反应液的管中加入1μl模板,盖紧管盖,置于PCR仪上按照以下程序进行扩增。基因扩增程序:37℃600s,1个循环;96℃ 900s,1个循环;96℃ 25s,62℃30s,72℃30s,40个循环。溶解曲线分析程序:95℃10s;72℃10s;95℃10s;50℃10s。(4)结果判读:当质控峰与B27峰在目标温度区间的荧光信号最大值的比值小于等于2.925,此样本为阳性标本。当质控峰与B27峰在目标温度区间的荧光信号最大值的比值大于2.925,此样本为阴性标本。
1.4 统计学分析
采用SPSS 10.0统计软件包进行统计学分析,2种检测方法检出阳性率比较采用配对χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 流式细胞术和实时荧光PCR法检测两种方法同时检测 检测结果见表1。共检测138例患者(男性85例,女性53例),流式细胞术检出阳性为36例,实时荧光PCR法检出阳性为39例,经配对χ2=1.33,两种方法的检出率差异无统计学意义(P>0.05)。2种方法符合率为97.8%(135/138),见表1。
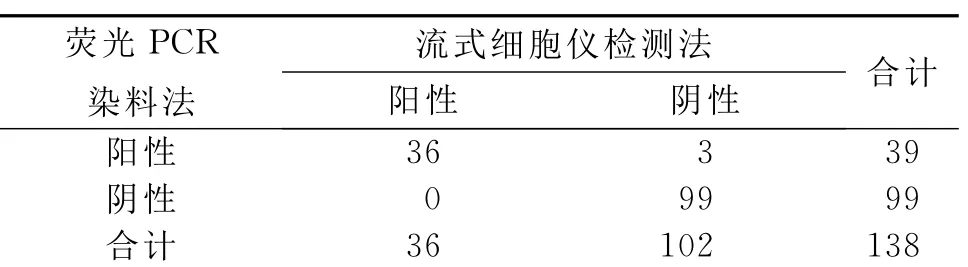
表1 两种方法同时检测结果比较
2.2 流式细胞术和实时荧光PCR法检测HLAB27同时检测出的阴性标本如图1所示,它们同时检测出的阳性标本如图2所示。
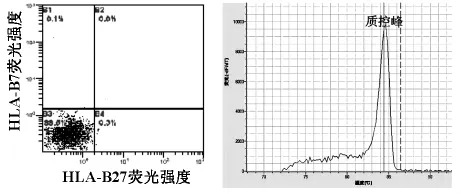
图1 阴性标本
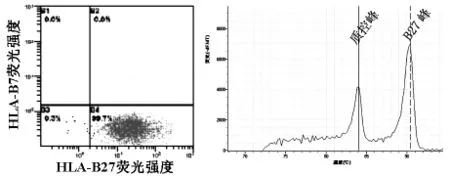
图2 阳性标本
2.3 在流式细胞术检测HLA-B27发现7例可疑标本,即所谓双阳性标本(HLA-B27和 HLA-B7均表现为阳性),他们的共同特点是荧光强度>8,但HLA-B27细胞表达百分比数不足90%,见表2。流式细胞术通常的报告的结果为阴性,但实时荧光PCR法并不都一致,见图3,A图两种检测方法结果不一致,B图两种方法检测结果均为阴性。

表2 可疑标本检测结果比较
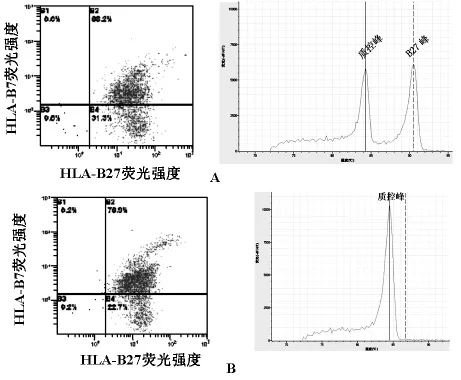
图3 可疑标本
3 讨论
Chou等[3]在家族性研究中发现 HLA-B27是一个有用的预测指标,因为HLA-B27阴性个体中,发展为AS的可能性几乎是零,而在HLA-B27阳性的个体中,发生AS的可能性是20%-30%。因此,HLA-B27对临床诊断提供关键的支持依据。经过采用流式细胞术和实时荧光PCR法同时检测138例患者血中HLA-B27表达,发现两种检测方法符合率为97.8%,其准确性、可靠性和自动化程度完全符合临床检测要求。但又各有其优缺点。
流式细胞术检测HLA-B27原理是采用荧光标记的单克隆抗体与细胞表面的HLA-B27抗原相结合,然后用流式细胞仪检测HLA-B27表达的细胞数和荧光强度,判断结果。这种方法操作简单,自动化程度高,一份样品40分钟内便可得出结果,而且重复率好。但流式细胞术也有不足之处。由于HLA-B27抗体除了能和HLA-B27抗原结合之外,与HLA-B7抗原也有一定的交叉反应。正是因为HLA-B7抗原和HLA-B27抗原竞争性的与HLAB27抗体结合,所以HLA-B27检测中可能出现假阳性的可能。Macardle等[4]报道流式细胞术检测HLA-B27误差率为5%,其中部分原因就是HLAB7抗原阳性的患者,可能会给HLA-B27的判断造成误差。本研究采用HIA-B27/HLA-B7双标记荧光探针检测HLA-B27,其优点在于避免了假阳性结果的报告,但对于假阴性的误判难以克服。
实时荧光PCR法检测 HLA-B27原理,是在PCR反应液加入荧光染料,该染料能与双链DNA特异性结合,通过实时检测反应体系荧光信号强度,达到检测PCR扩增产物的目的。实时荧光PCR法直接检测 HLA-B27抗原的编码基因,不必有与HLA-B7产生交叉反应之虞,故能准确地做出判断。两种方法的检测结果有3例标本不符,主要原因是本研究中流式细胞术检测HLA-B27和HLA-B7两种抗原,如果标本HLA-B27平均荧光强度>8而表达的细胞数<90%,我们高度怀疑是HLA-B7抗原引起的干扰,进而临床上我们倾向于报告HLA-B27抗原阴性,但是这就会造成两种抗原都是阳性标本的漏检。我们分析了类似的7例标本,这些标本的共同特点是平均荧光强度>8,而B27表达的细胞数<90%,其中3例标本两种方法检测结果不符,4例标本结果完全符合。实验结果说明平均荧光强度>8而B27表达的细胞数<90%的情况下,流式细胞术已无能为力,提示需要采用微量细胞毒[5]或PCR方法进行确认,而实时荧光PCR法确实能弥补这一不足。拟采用流式细胞术检测样品,需当天处理,而且不能冻存。而采用实时荧光PCR法检测的样品的可以在-80℃长期保存。这样就为我们提出一种可采纳的方法:将流式细胞术检测数的双阳性标本放入冰箱冻存,待积攒到一定数量之后,用实时荧光PCR法作进一步确认。如果本室的实验条件不允许,也可集中送到其他实验室检测。为临床提供可靠和准确的数据。本研究中实时荧光PCR法与流式细胞术两种方法检测人类白细胞抗原HLA-B27的符合率高,虽然实时荧光PCR法的操作较流式细胞术繁琐,但在解决双阳性标本时具有优越性,使临床的检测结果更加准确和可靠。
[1]López de Castro JA.HLA-B27and thepathogenesis of spondyloarthropathies[J].Immunol Lett,2007,108:27.
[2]Brown MA,Pile KD,Kennedy LG,et al.HLA class I associations of ankylosing spondylitis in the white population in the United Kingdom[J].Ann Rheum Dis,1996,55:268.
[3]Albrecht J,Müller HA.HLA-B27typing by use of flow cytofluorometry[J].Clin Chem,1987,33:1619.
[4]Macardle PJ,McEvoy R,Jovanovich S.HLA-B27expression by flow cytometry:an analysis of 7years quality assurance data[J].J Immunol Methods,2000,243:51.
[5]楮为靖,张会英,高新生,等.流式细胞仪检测人类白细胞抗原-B27与微量细胞毒法的比较[J].中华检验医学杂志,2008,31:520.

