超临界-CO2法萃取苦参中苦参碱的工艺优化△
刘修树,周晶,何晓丽,方丽波,汤洁
(1.合肥职业技术学院,安徽 合肥 238000;2.安徽省中医院,安徽 合肥 230031)
中药工业
安徽省教育厅质量工程省级特色专业(皖教高[2010]28号)
*
刘修树,Tel:(0565)2364330,E-mail:shuxliu@126.com
超临界-CO2法萃取苦参中苦参碱的工艺优化△
刘修树1*,周晶2,何晓丽1,方丽波1,汤洁1
(1.合肥职业技术学院,安徽 合肥 238000;2.安徽省中医院,安徽 合肥 230031)
目的探讨超临界-CO2法萃取苦参中苦参碱最佳工艺。方法采用HPLC测定含量,以萃重和苦参碱含量为考察指标,运用单因素和正交试验法优选萃取工艺。结果选择75%的乙醇作为夹带剂,按4倍量加入,CO2流量对苦参碱萃取量有显著的影响,其次是萃取压力和萃取时间。结论超临界-CO2法萃取苦参中苦参碱最佳工艺是萃取压力25 MPa、萃取温度60 ℃、萃取时间3 h、CO2流量40 kg·h-1。
超临界-CO2法;苦参;苦参碱;工艺优化
苦参碱(Matrine)是存在于苦参SophoraflavescensAit.、苦豆子SophoraalopecuroidesL.、山豆根SophoratonkinensisGapoep等多种豆科植物中有效成分生物碱的一种。现代研究表明苦参碱具有抗肿瘤、抗纤维化、抗炎、抗病毒及对中枢神经系统、心血管系统等多种药理作用[1-2]。目前苦参碱制剂在临床上主要联合用药治疗肝性疾病,尤其病毒性肝炎[3]。从苦参中提取分离苦参碱的方法有多种,以超临界-CO2法萃取分离苦参碱国内也有文献报道[4],但未对工艺进一步研究。本文以HPLC法测定苦参碱含量,萃重、苦参碱含量作为参考指标,分别采用单因素法对夹带剂乙醇的浓度、加入量进行考察,用正交设计法对影响超临界-CO2法萃取分离苦参碱的因素进行了考察,从而获得超临界-CO2法萃取分离苦参碱的最佳工艺。
1 仪器与试药
1.1 药品
苦参药材购自亳州北京同仁堂饮片有限责任公司,经鉴定为SophoraflavescensAit.的根,苦参碱对照品(西安中鑫生物技术有限公司,批号:060119,含量>99%)。
1.2 仪器与试剂
KQ-50DE型数控超声清洗器(昆山超声仪器有限公司),RE52CS旋转蒸发器(上海亚荣生化仪器厂),HH-2数显恒温水浴锅(江苏金坛市荣华仪器制造有限公司),SHZ-D(Ⅲ)型循环水式多用真空泵(河南巩义市英峪予华仪器厂),DZF-6020型真空干燥箱(上海博迅实业有限公司),HL-5L/50 MPa-ⅡCWQ型超临界流体(CO2)萃取装置(杭州华黎泵业有限公司),AG-285型十万分之一电子天平(瑞士梅特勒-托利多),岛津LC-10AT高效液相色谱仪;岛津SPD-10Avp紫外检测器;浙江N2010色谱工作站。
CO2购自合肥氧气站(纯度>99%),乙腈、无水乙醇为色谱纯,其他试剂均为分析纯。
2 方法与结果
2.1 超临界萃取方法
将苦参碱药材粉碎后过60目筛,称取药粉300 g 倒入2 000 mL的大烧杯中,加500 mL 0.5 mL·L-1氨水溶液浸润过夜,次日投入萃取釜中。超临界萃取采用一次加料、一级萃取、二级分离、超临界CO2连续流动,萃取过程按一定速率分3次注入夹带剂,萃取至1.5 h第一次收集萃取液,以后每隔30 min 收集一次,直至无萃取液产生,合并收集的萃取液,过滤,减压回收溶剂,60 ℃真空干燥得萃重。
2.2 含量测定
2.2.1 色谱条件 ZORBAX NH柱(250 mm×4.6 mm,5 μm),流动相:乙腈-无水乙醇-1%磷酸溶液(75∶10∶15),流速:0.8 mL·min-1,检测波长:(V/V)220 nm,进样量:20 μL;柱温为室温,理论塔板数不低于4 000。
2.2.2 对照品溶液的制备 精密称取经P2O5干燥至恒重的苦参碱对照品10 mg于10 mL棕色的容量瓶中,加甲醇溶解稀释至刻度,制成每毫升含1 mg苦参碱的溶液,即为对照品溶液。
2.2.3 供试品溶液的制备 分别称取苦参碱萃取物约0.25 g,精密称定,加入25 mL容量瓶中,用氨水调甲醇pH=10左右,用该碱性甲醇20 mL溶解萃取物,并超声搅拌30 min,碱性甲醇定容至刻度,0.45 μm微孔滤膜过滤,取续滤液即得供试品溶液。
2.2.4 标准曲线的制备 外标法测定含量。分别精密量取对照品溶液0.5,1.0,1.5,2.0,2.5,3.0 mL置于10 mL的棕色容量瓶中,加甲醇稀释至刻度,摇匀,按上述色谱条件进样20 μL,以苦参碱含量为横坐标,峰面积值为纵坐标,得标准曲线,并计算得回归方程Y=2 005.2X+120.8,r=0.999 9。苦参碱在50~300 μg·mL-1与其峰面积呈良好的线性关系。
2.2.5 精密度试验 取标准曲线项下对照品溶液,按上述色谱条件,重复进样5次,测定峰面积,求得苦参碱含量,计算RSD=0.58%。
2.2.6 稳定性试验 取同一样品溶液按样品测定的步骤进行操作,每1 h测定1次。结果分别为11.96,12.35,12.11,12.46,12.43,12.27,12.39 mg·g-1,平均含量为12.28 mg·g-1,RSD=1.47%(n=7)。表明供试品溶液至少在6 h内稳定。
2.2.7 加样回收率试验 精密量取3份已知含量的超临界样品溶液3 mL,置于10 mL棕色容量瓶中,加入对照品溶液适量,用甲醇定容至刻度,摇匀,0.45 μm微孔滤膜过滤,按样品分析方法进行测定。3份苦参碱回收率分别为98.1%,99.6%,98.5%,平均回收率为98.7%,RSD=0.79%。
2.2.8 重现性试验 精密称取超临界萃取物同一试样,按2.2.3项下方法制成供试液,依照色谱条件连续进样6次测定苦参碱含量,平均含量为12.25 mg·g-1,RSD=0.41%。
2.3 结果与分析
2.3.1 夹带剂的选择 由于苦参碱极性较大,不加入夹带剂时苦参碱萃取率较低,甚至不能萃取出,因而夹带剂选择显得非常重要。夹带剂种类较多,考虑夹带剂对萃取成分的溶解特性和毒性、以及对设备的腐蚀和环境的影响,在参阅相关文献[5]的基础上直接选择价格低廉、安全性好的乙醇作为夹带剂,考察了不同浓度的乙醇及其加入的量(与物料体积重量比)对萃取效果的影响。
2.3.2 乙醇浓度选择 为了进一步考察不同乙醇浓度对超临界萃取的影响,分别选择95%,85%,75%,65% 4种不同浓度的乙醇作为夹带剂,夹带剂与超临界CO2流体同步泵入萃取器内,加入量是物重的3倍,结果苦参碱含量分别为9.26,11.15,15.37,8.94 mg·g-1。可以看出乙醇的浓度对苦参碱的萃取率影响较大,乙醇浓度影响程度大小依次为:75%乙醇>85%乙醇>95%乙醇>65%乙醇,故选用75%乙醇作为夹带剂。
2.3.3 夹带剂75%乙醇不同加入量的试验研究 分别选择夹带剂75%乙醇2,3,4,5倍加入量(与物料体积重量比),超临界萃取苦参碱含量分别为12.36,14.07,16.92,14.19 mg·g-1。可以看出75%乙醇的加入量对苦参碱的萃取效果影响较显著,最佳加入量为4倍量。
2.3.4 正交试验设计 经过预试验,根据影响超临界CO2萃取的各种因素条件,选择4种主要因素萃取压力(A)、温度(B)、时间(C)、CO2流量(D),采用正交试验的方法来确定最佳萃取条件,因素水平表见表1。选用L9(34)正交表安排实验,以萃取物苦参碱含量为试验考察指标,萃重平均值作为参考,每号试验做3次。实验结果及方差分析见表2、3。
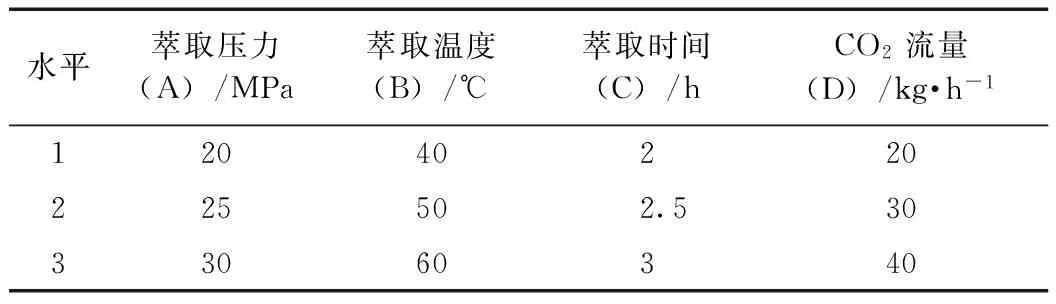
表1 苦参碱超临界CO2萃取正交试验因素水平表

表2 苦参碱超临界CO2萃取正交试验表

表3 方差分析表
注:(1)n=2,(2)F0.01(2,18)=6.01,F0.05(2,18)=3.55
表2极差值直观分析得出,D因素对试验结果影响最显著,其他影响因素大小依次为B>A>C。表3方差分析,D因素对试验结果影响最显著,其他因素依次为B>A>C,与直观分析一致,结合两者获得最佳萃取工艺为A2B3C3D3,即萃取压力25 MPa、萃取温度60 ℃、萃取时间3 h、CO2流量40 kg·h-1。
2.3.5 验证实验 根据试验结果,按最终确定的萃取苦参碱最佳工艺条件做3批验证实验,结果分别为22.97,24.06,24.23 mg·g-1,与正交试验结果较一致,说明此工艺稳定可行。
3 讨论
虽然药材的粉碎度越高,萃取率也越高,但粉碎度过高,在萃取过程中容易产生堵塞现象。选择20目、40目、60目、80目、100目5种不同苦参粉末预实验,80目、100目的粉末易堵塞,不利于超临界萃取,20目、40目、60目苦参粉末中60目粉末萃取苦参碱率较高,萃重与20目、40目的萃重相近,故选择60目苦参粉末。
夹带剂采用一次性连续加入,分两次和3次的方式加入(分次加入的时间间隔为0.5 h),以分3次的方式加入的苦参碱的萃取率较好,3次量按2∶1∶1的比例加入。
[1] 孟庆红,张玲,张喜云,等.苦参的药理研究进展[J].航空航天医药,2009,20(2):125-126.
[2] 王磊,李庆林.苦参碱抗肿瘤作用机制的研究进展[J].安徽医药,2009,13(4):360-362.
[3] 金丙雄.苦参碱联合用药治疗慢性乙型肝炎的新进展[J].医学理论与实践,2011,24(12):1409-1410.
[4] 葛发欢,黄星,谭晓华,等.非离子表面活性剂对超临界CO2从苦参中萃取苦参碱类的影响[J].中药材,2003,26(6):426-427.
[5] 高洪燕,张咏.心律宁片剂中氧化苦参碱的萃取及其含量测定的研究[J].中国医药科学,2011,1(13):50-51.
OptimizationofExtractingProcessofMatrineinSophoraeFlavescentisRadixbySupercriticalCO2
LIU Xiu-shu1, ZHOU Jing2,HE Xiao-li1,FANG Li-bo1,TANG jie1
(1.HefeiVcationalandTechnicalCollege,Hefei238000,China;2.TraditionalChineseMedicalHospitalinAnhui,Hefei230031,China)
Objective:Select a best process of Matrine in Sophorae Flavescentis Radix by supercritical CO2.MethodsHPLC is the method of content determination.Extraction technology was optimized by the extraction weight and the content of Matrine in single factor and orthogonal design.Results75% ethanol was elected as entraining agent. Addition capacity is 4 times of volume. Compared with the other three factors, the quantity of flow of CO2has more influence on extraction, The next influencing factors are pressure and time of extraction.ConclusionThe best extracting process by supercritical CO2was 25 MPa, 60 ℃, 3 h, quantity of flow of CO240 kg·h-1.
Supercritical CO2; Sophorae Flavescentis Radix; Matrine; Optimization of extracting process
2012-01-05)

