单剂CD25单克隆抗体联合小剂量抗胸腺淋巴细胞球蛋白在肾移植中的应用
陈正 张善斌 廖德怀 方佳丽 李光辉 杜杨春 徐璐 潘光辉
随着肾移植技术的发展以及新型免疫抑制剂的开发和应用,肾移植术得到广泛开展,但是急性排斥反应和感染仍然是影响着移植效果的重要因素,选择一种安全有效的免疫诱导方案降低急性排斥反应和感染的发生率具有重要意义。现对本中心应用单剂CD25单克隆抗体(舒莱/赛呢哌)联合小剂量抗胸腺淋巴细胞球蛋白(antihuman T-lymphocyte globuin,ATG)的免疫诱导方案的临床资料进行总结,旨在评估该方案的临床效果和安全性。
对象与方法
一、临床资料
回顾分析我院2000年1月至2006年12月间741例肾移植患者,年龄11~76岁,分为2组。
对照组293例,术前未用CD25单克隆抗体(舒莱/赛呢哌)+ATG免疫诱导,术后常规应用环孢素A(cyclosporin A,CsA)或他克莫司(FK506)+吗替麦考酚酯(mycophenolate mofeftl,MMF)+ 泼尼松(Pred)“三联”免疫抑制方案。
诱导组448例,围手术期应用单剂CD25单克隆抗体(舒莱/赛呢哌)联合ATG免疫诱导,其中141例属高危人群。本研究中高危人群的界定标准:(1)群体反应性抗体(penel reactive antibody,PRA)> 30﹪(34 例 );(2)年 龄 > 60岁或严重糖尿病(98例);(3)有严重心血管疾病,如冠脉搭桥和冠脉扩张术后或心房纤颤等(43例)。
2组病例性别、供肾冷热缺血时间并无统计学差异,受供者ABO血型及Rh血型相配。
二、免疫抑制方案
诱导组,CD25单克隆抗体(舒莱/赛呢哌)为单剂,术前2 h静脉滴注;ATG共500 mg,手术当天及术后2 d,100 mg/d,静脉滴注,术后第 3~6天,50 mg/d,静脉滴注;术后“三联”免疫抑制方案为MMF 1000~1500 mg/d,CsA 初始 剂量 3~5 mg·kg-1·d-1,FK506初始剂量 0.04~0.1 mg·kg-1·d-1;甲基泼尼松(MP)总剂量为1250~1500 mg,在手术当天至手术后3 d内应用(冠心病患者术中及术后1~3 d各250 mg),第4天起Pred 30 mg,在一个月内减至15 mg/d维持用药。
对照组,术后“三联”免疫抑制方案为MMF 1000~1500 mg/d;FK506初 始 剂 量 0.1 ~0.15 mg·kg-1·d-1或 CsA 4~6 mg·kg-1·d-1;MP总剂量为1500~2000 mg,在手术当天至手术后3 d内应用,第4天起Pred 30 mg,在一个月内减至15 mg/d维持用药。
术后据血药浓度、血清肌酐、谷丙转氨酶(alanine aminotransferase,ALT)、谷 草 转 氨 酶(aspartate aminotransferase,AST)及尿蛋白等实验室指标,结合尿量、有无腹泻及有无肢体麻木或震颤等临床症状,及时准确调整CsA/FK506的剂量。
三、观察指标
(1)急性排斥反应:根据临床症状及实验室检查指标,多普勒超声检查和移植肾穿刺活检结果来判断是否发生急性排斥反应(acute rejection,AR),观察术后12个月内的发生情况,病理分级采用Banff 97标准;(2)术后感染:主要观察术后12个月内感染并发症,分为细菌、真菌、病毒[尤其是巨细胞病毒(cytomegalovirus,CMV)]及混合感染,以CMV-Ag阳性确诊为CMV感染;(3)1年人(肾)存活率:回顾术后1年人(肾)存活率,分析用药方案与人(肾)存活的关系;(4)围手术期指标监测:分别于2组中随机抽取35例患者,记录手术当天(术前),手术后第3,7,10天肌酐、白细胞及淋巴细胞变化,分析药物与临床效果的内在关系。
四、统计学分析
应用SPSS 15.0统计软件对数据进行统计学分析。诱导组与对照组并发症发生率比较用卡方检验,两组肌酐及白细胞比较采用t检验,以P< 0.05为差异有统计学意义。
结 果
一、诱导组与对照组临床效果及并发症发生率的比较(表1)
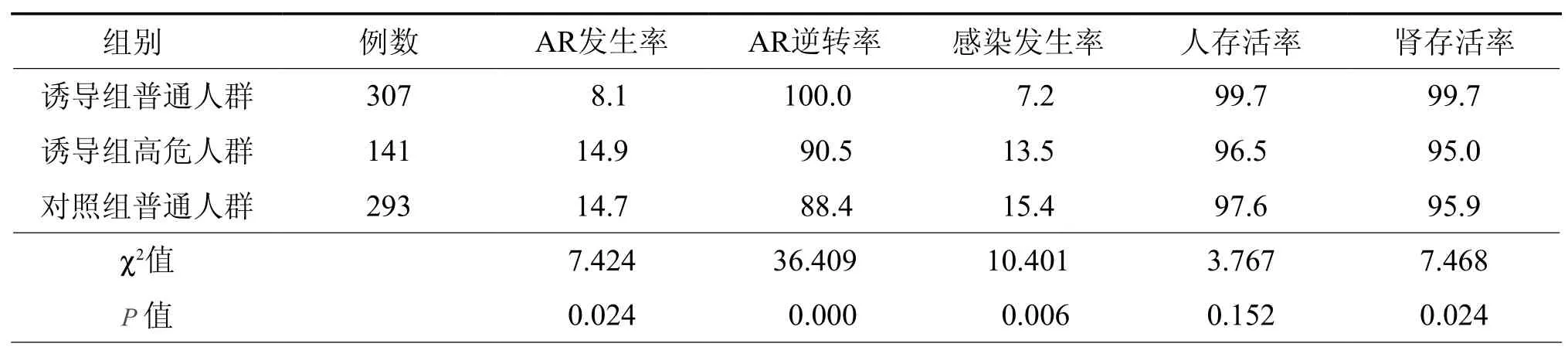
表1 诱导组与对照组临床效果及并发症发生率的比较(﹪)
二、血清肌酐及白细胞监测结果(表2)
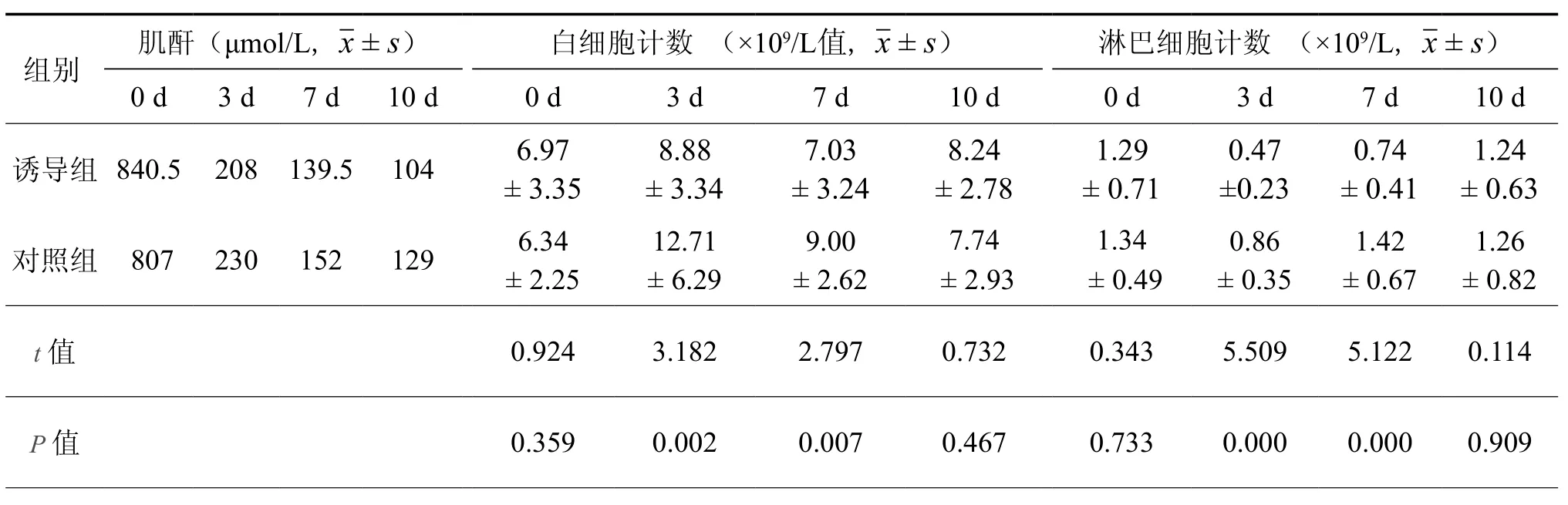
表2 术后不同时间血清肌酐及白细胞监测结果(n = 35)
讨 论
作为器官移植后的主要矛盾之一,抗排斥治疗强度越大,术后感染的可能性亦越高。Vikas等[1]在2004年报道术后6个月因AR住院的病人高达12﹪,排斥反应仍然是影响移植效果的主要原因,随着抗排斥治疗方案的日益完善,排斥反应发生率变得更低,感染上升为住院的首要原因。探讨更为有效的免疫诱导方案来解决这一矛盾,正是此研究的目的。
肾移植围手术期有效的免疫诱导能明显降低排斥反应发生率[2-3]。CD25单克隆抗体属抑制性抗体,术前使用单剂,半衰期长,维持CD25+ 细胞处于低水平状态,有效覆盖AR发生的危险期[4]。ATG是多克隆抗体,为清除性抗体,具直接对抗多种T细胞表面活性分子(CD2、CD3、CD4、CD8和HLA-DR)的特殊抗体,抑制T淋巴细胞增殖,从而有效的阻断排斥反应。对淋巴细胞进行监测,发现在术后第3及第7天,诱导组对淋巴细胞抑制比对照组明显,可见有效的免疫诱导能够迅速降低受者体内淋巴细胞水平、降低肾移植术后初期AR的发生率,同时可获得良好的免疫耐受[5]。有效的免疫诱导可减少肾毒性药物如钙调神经蛋白抑制剂(如 CsA、FK506 等)的用量[6]或延迟此类药物的使用[7],降低其对移植肾的毒性作用,而并不增加排斥反应的发生率;可减少糖皮质激素的用量,甚至可以撤除激素的使用[7-9]却并不增加排斥反应的发生率。但长期大剂量使用ATG,可增加感染机会及肿瘤发生率,同时容易产生抗ATG抗体,不利于AR的逆转[10],应用短疗程小剂量ATG效果良好,疗效与长疗程相当,且副作用明显减少[11]。国内有学者使用ATG方案[12]为术前静脉滴注200 mg,术后每天静滴ATG 100 mg,连续使用10~12 d,亦有使用更大剂量或更长疗程者[13-14]。本研究采用小剂量ATG联合单剂CD25单克隆抗体进行免疫诱导,受试者对ATG耐受良好,少数患者出现一过性血小板减少及血红蛋白下降,停药后很快得到恢复,获得较好的临床效果。术后10 d内2组血清肌酐均可降至正常水平,诱导组同对照组对比无统计学意义。对于普通人群的AR发生率及人(肾)存活率,诱导组均明显好于对照组。AR逆转率两组间无统计学差异,这与诱导组AR发生率低、样本量过小有关。
安全有效的免疫诱导方案在减少排斥反应发生率的同时,并不增加感染的机会[15],相反,本研究的结果表明其能够降低感染的发生率。由于ATG用量小,疗程短,避免了长期大剂量使用ATG增加感染发生率的缺点[10]。术前成功诱导,术后减少常规免疫抑制剂的用量,降低了其长期对机体免疫系统的全面抑制程度,感染率及患者死亡率明显下降。术后对白细胞计数进行监测,诱导组和对照组间白细胞绝对计数对比并无统计学差异,由此可见,同对照组相比,免疫诱导不会影响外周白细胞的绝对数量[16],不会增加感染的机会。同等条件(普通人群)下,诱导组和对照组的感染发生率分别为7.2﹪和15.4﹪,诱导组无CMV感染发生,降低了由此增加的死亡率,减少了CMV等诱发排斥的几率[17]。
对于高危人群而言,该免疫诱导方案更具临床应用价值。该方案能够明显减少糖皮质激素的用量,减少其带来的相关副作用:(1)降低心血管事件的发生率,诱导组冠脉搭桥和冠脉扩张术后43例中死亡2例,对照组并无高危患者,术后1年内有3例因心脏衰竭死亡;(2)减少胃肠道并发症的发生,对照组中有1例患者在术后出现顽固性消化道出血导致死亡,诱导组应用小剂量糖皮质激素,并无类似并发症发生。在PRA过高的病人,该免疫诱导方案覆盖整个AR发生的高峰时段,降低术后排斥反应的发生率。对于糖尿病或老年患者,应用免疫诱导后可减少术后各类常规免疫抑制剂用量,减少了由此带来的肾毒性及其他各种副作用,有利于糖尿病的控制[18]。统计表明,AR发生率、人(肾)存活率及感染发生率,高危人群经免疫诱导后同对照组相比没有统计学差异,由此可说明有效的免疫诱导,能够减少高危人群的排斥反应、感染发生的风险,提高高危人群人(肾)存活率。
单剂CD25单克隆抗体联合短疗程小剂量ATG早期诱导免疫耐受可以明显减少AR的发生,降低感染风险,提高近期人(肾)存活率,可以作为肾移植围手术期免疫诱导的适宜选择,Kaden等[19-20]曾报道用ATG联合CsA能够提高肾移植术后3年移植物存活率,此方案是否有相同效果,尚需进一步观察。该免疫诱导方案迅速抑制淋巴细胞,诱导免疫耐受,其在诱导免疫耐受方面前景乐观,至于其究竟如何影响CD4+CD25+Treg 细胞介导的免疫耐受[5,21-22],尚需进一步积累更多的资料。
1 Dharnidharka VR, Stablein DM, Hramon WE, et al. Posttranspant infections now exceed acute rejection as cause for hospitalization:a report of the NAPRTCS[J]. Am J Tranplant, 2004, 4(3):384-389.
2 Patlolla V, Zhong X, Reed GW, et al. Efficacy of Anti-IL-2 Receptor Antibodies Compared to no Induction and to Antilymphocyte Antibodies in Renal Transplantation[J].Am J Transplant, 2007, 7(7):1832-1842.
3 Ciancio G, Mattiazzi A, Roth D, et al. The use of daclizumab as induction therapy in combination with tacrolimus and mycophenolate mofetil in recipients with previous transplants[J]. Clin Transplant, 2003, 17(5):428-432.
4 Sommer BG, Henry ML, Ferguson RM, et al. Sequential antilymphoblast globulin and cyclosporine for renal transplantation[J]. Transplantation, 1987, 43(1):85-90.
5 徐芸, 陈国栋. 诱导移植肾免疫耐受的临床进展[J].国际移植与血液净化杂志, 2007, 5(5):24-27.
6 Kirk AD, Mannon RB, Swanson SJ, et al. Strategies for minimizing immunosuppression in kidney Transplantation[J]. Transpl Int, 2005, 18(1):2-14.
7 Vincenti F, de-Andre´s A, Becker T, et al.Interleukin-2 receptor antagonist induction in modern immunosuppression regimens for renal transplant recipients[J]. Transpl Int, 2006, 19(6):446-457.
8 Abramowicz D, Vanrenterghem Y, Squifflet JP, et al.Efficacy and cardiovascular safety of daclizumab,mycophenolate mofetil, tacrolimus, and early steroid withdrawal in renal transplant recipients: a multicenter,prospective, pilot trial[J]. Clin Transplant, 2005, 19(4):475-482.
9 ter-Meulen CG, van-Riemsdijk I, Hene RJ, et al. Steroid-Withdrawal at 3 Days After Renal Transplantation with Anti-IL-2 Receptor аTherapy: A Prospective,Randomized, Multicenter Study[J]. Am J Transplant,2004, 4(5):803-810.
10 Przepiorka D, Keman NA, Ipploiti C,et al. Daclizumab, a humanized anti-interleukin-2 receptor alpha chain antibody,for treatment of acute graft-versus-host disease [J]. Blood,2000, 95(1):83-89.
11 Olausson M, Mjomestedt L, Blohme I, et al. Three-day or ten-day ATG treatment for steroid-resistant rejection in kidney transplanted patients[J]. Transplant proc, 1995,27(6):3434-3435.
12 杨顺良, 谭建明, 吴卫真, 等. 致敏肾移植受者术前单次大剂量抗胸腺细胞球蛋白诱导治疗的价值[J].中华泌尿外科杂志, 2004, 25(11):746-749.
13 王平贤, 张艮甫, 严治林, 等. 抗胸腺球蛋白在肾移植中的应用[J].临床泌尿外科杂志, 1998, 13(3):100-102.
14 王平, 张清, 丁泓文, 等. 长疗程断疗程治疗移植肾难治性排斥反应的对比研究[J].广东医学,1998,19(7):497.
15 Sandrini S. Use of IL-2 receptor antagonists to reduce delayed graft function following renal transplantation: a review[J]. Clin Transplant, 2005, 19(6):705-710.
16 王长希, 邱江, 陈立中, 等. 赛尼哌在肾移植免疫诱导治疗中的作用[J]. 中山大学学报(医学科学版), 2004,25(3S):273-275.
17 Sagedal S,Hartmann A,Rollag H,et al. The impact of early cytomegalovirus infection and disease in renal transplant recipients[J]. Clin Microbiol Infect, 2005, 11(7):518-530.
18 宋文利, 刘俊铎, 付迎新, 等. ATG诱导对伴糖尿病患者肾移植术后的免疫抑制作用[J].天津医药, 2006,34(9):665.
19 Kaden J, May G, Mueller P, et al. Intraoperative high-dose anti-Tlymphocyte globulin bolus in addition to triple-drug therapy improves kidney graft survival[J]. Transplant Proc,1995, 27(1):1060-1061.
20 Kaden J, Strobelt V, May G, et al. Short and long-termResultsafter pretransplant high-dose single ATG-Fresenius bolus in cadaveric kidney transplantation[J].Transplant Proc, 1998, 30(8):4011-4014.
21 王弘珺, 赵勇. 调节性CD4+CD25+Foxp3+T细胞、免疫抑制剂与移植免疫耐受[J].现代免疫学, 2006,26(5):353-356.
22 李冬妹, 胡永秀. CD4+CD25+Treg细胞与移植免疫耐受[J].微生物学免疫学进展, 2007, 35(2):39-43.

