基因组改组快速提高谷氨酸棒杆菌L-鸟氨酸产量
张媛媛,李家洲
(1.广东轻工职业技术学院食品与生物工程系,广东 广州 510300;2.中山大学生命科学学院,广东 广州 510300)
基因组改组快速提高谷氨酸棒杆菌L-鸟氨酸产量
张媛媛1,2,李家洲1
(1.广东轻工职业技术学院食品与生物工程系,广东 广州 510300;2.中山大学生命科学学院,广东 广州 510300)
以谷氨酸棒杆菌ATCC13032为出发菌,应用基因组改组技术快速提高L-鸟氨酸产量。经过紫外线、亚硝基胍和甲基磺酸乙酯分别诱变处理,获得6株产量有所提高的突变株,以此构建用于基因组改组的候选菌库。考察培养基成分对原生质体再生率的影响。经过两轮的灭活原生质体递推式融合,以磺胺胍和氟化钠为双抗性筛选标记,共筛选出2株遗传性能稳定的改组菌株。其中改组菌株F2-6摇瓶发酵72h,积累L-鸟氨酸产量为2.99g/L,是出发菌株的13.6倍。结果表明基因组改组技术能够在短期内使谷氨酸棒杆菌的L-鸟氨酸产量得以提高。
基因组改组;谷氨酸棒杆菌;L-鸟氨酸;产量
L-鸟氨酸在生物体内主要参与尿素循环,对氨态氮的排出有重要作用[1]。近年来,L-鸟氨酸在医药和食品行业均有广泛用途[2]。在医药工业,L-鸟氨酸除了主要用于保肝、护肝及治疗高血氨症外[3],还可用于外伤和烧伤的恢复[4];在食品行业,L-鸟氨酸既有保健减肥的功效又能提高机体免疫力,是健美者和运动员的理想营养补剂。L-鸟氨酸的多功能保健作用不断引起人们的关注,其市场需求日益剧增。但L-鸟氨酸的生产较为困难,目前L-鸟氨酸的生产主要有酶法和发酵法。酶法是精氨酸在精氨酸酶的作用下,转化生成L-鸟氨酸。此法虽然产品纯度高,但精氨酸和精氨酸酶都难于获得,导致生产成本过高[5]。而发酵法则简单易行,特别适合于工业化生产。目前,应用于工业化生产的菌株大都是通过传统诱变育种获得,生产性能不稳定,给企业带来较大的困扰。最近,国际上开始了L-鸟氨酸代谢工程方面的研究[6-8](从分子水平上构建L-鸟氨酸工程菌)并取得了一定的进展,但菌株基因组信息和代谢网络信息的欠缺限制了研究者对L-鸟氨酸生产菌的进一步改造。
基因组改组技术是DNA改组技术在全基因组水平的延伸,可将多亲本的优良基因整合在一起。自Zhang Yingxin等[9]首次提出该技术以来,该技术已成功应用于诸多研究中以提高代谢产物产量[10],增强微生物对环境的耐受性[11-12]以及底物利用范围[13],甚至诱导微生物分泌新的代谢产物[14]等。基因组改组技术不仅具有筛选周期短、正突变率高、避免对诱变剂产生“钝化”等优点,而且还将为功能基因组学的研究及揭示基因型和表型的关系提供素材[15]。本实验以谷氨酸棒杆菌ATCC13032(其基因组序列已公布GI号为42602314)为出发菌,应用基因组改组技术快速提高其L-鸟氨酸产量,为探索谷氨酸棒杆菌产L-鸟氨酸的代谢机制及进一步构建L-鸟氨酸高产菌提供基础资料。
1 材料与方法
1.1 材料与试剂
1.1.1 菌种
谷氨酸棒杆菌(Corynebacterium glutamicumATCC 13032),为本实验室保存菌种。
1.1.2 试剂
L-鸟氨酸标准品(日本进口分装) 上海伯奥生物科技有限公司;亚硝基胍(NTG) 美国Fluka公司;磺胺胍(SG)、甲基磺酸乙酯(EMS) 美国Sigma公司;其他试剂均为国产分析纯。
1.1.3 培养基
完全培养基、种子培养基、发酵培养基和抗性筛选培养基参照文献[16]。
再生培养基(g/L):葡萄糖1、蛋白胨10、牛肉膏10、酵母粉5、NaC1 5、丁二酸钠135、MgCl22,pH 7.0,上层培养基琼脂粉质量浓度为8g/L,下层培养基琼脂粉质量浓度为18g/L。
1.2 方法
1.2.1 菌种诱变方法
利用紫外线(UV)及NTG诱变,参照文献[16]方法。
EMS诱变:取100μL EMS和9.9mL菌悬液于灭菌离心管中,200r/min作用30min,用等体积20g/L的硫代硫酸钠终止反应。洗涤后,转接入种子培养基中培养8h。梯度稀释后分别取样0.1mL均匀涂布于抗性筛选平板上,于32℃培养2~3d。
1.2.2 筛选方法
初筛:将抗性筛选培养基上生长良好的单菌落接入发酵培养基(250mL三角瓶装液量30mL)中,32℃、200r/min振荡培养72h,测发酵液中L-鸟氨酸产量。
复筛:将初筛产量较高的菌株,先接入种子培养基(250mL三角瓶装液量 30mL),32℃、200r/min振荡培养12h,再按体积分数10%的接种量接入发酵培养基中32℃,200r/min振荡培养72h,发酵结束后,测其发酵液中L-鸟氨酸产量。每次平行实验3次。
1.2.3 原生质体的制备
取1环新鲜活化的谷氨酸棒杆菌,接入种子培养基中,30℃、150r/min振荡培养24h;取1mL菌液于种子培养基中(250mL三角瓶装液量 30mL),培养3h,加入终浓度为0.6U/mL青霉素继续培养3h,取上述培养的菌液10mL于4℃、4000r/min离心15min,去上清液,洗涤2次,再加入终质量浓度为1mg/mL的溶菌酶,于32℃处理2 h,洗涤后备用。
1.2.4 原生质体的再生和融合
原生质体的再生、融合及再生率的计算,参照文献[17]方法进行。
1.2.5 基因组改组
将候选菌库中的菌株都制备成原生质体,混合后分成两等份,分别进行紫外灭活和55℃热灭活。取灭活后的原生质体悬浮液各2.5mL于无菌试管中融合。融合后的菌液进行梯度稀释,取0.2mL用夹层法培养于再生平板上,32℃培养至长出菌落。经初筛和复筛,所得L-鸟氨酸产量提高的几株菌株,作为下一轮基因组改组的亲本。
1.2.6 菌株遗传稳定性的检验
将F2代菌株分别用新鲜的抗性筛选斜面培养基连续传代6次,1~6代菌株一同进行摇瓶发酵,每代菌株平行发酵3次,于发酵72h测定L-鸟氨酸产量,比较每一代菌株的发酵结果,考察其遗传稳定性。
1.2.7L-鸟氨酸产量及生物量的测定
参照文献[8]方法。
2 结果与分析
2.1 候选菌库的构建
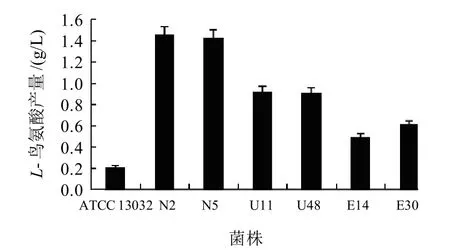
图1 候选菌库中菌株的L-鸟氨酸产量Fig.1 L-Ornithine yield of the starting ATCC13032 strain and some mutants
选用SG和氟化钠(NaF)为抗性筛选标记。在含0.5g/L SG和0.8g/L NaF抗性平板上,随机挑选240株菌株进行初筛,再复筛,共获得63株L-鸟氨酸产量有所提高的突变菌株。选取每种诱变剂诱变结果最好的2株菌株,共6株(N2、N5、U11、U48、E14和E30)构成候选菌库。由图1可知,此6株菌株的L-鸟氨酸平均产量为0.97g/L,约为出发菌株ATCC 13032产量(0.22g/L)的4.4倍。
2.2 再生培养基的优化
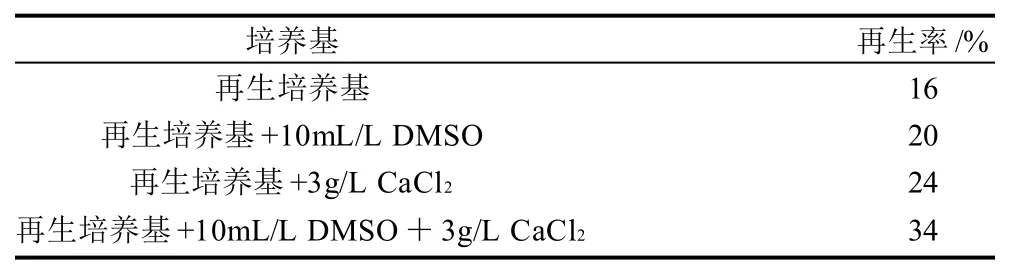
表1 DMSO和CaCl2的添加对谷氨酸棒杆菌ATCC 13032 原生质体再生率的影响Table 1 Effects of DMSO and CaCl2 in the medium on the regeneration rate of Corynebacterium glutamicum ATCC 13032 protoplasts
向再生培养基添加不同量的DMSO和CaCl2,考察其对ATCC 13032 原生质体再生率的影响。由表1可知,DMSO和CaCl2的添加均可显著提高原生质体再生率,当再生培养基中同时添加3g/L的CaCl2和10mL/L的DMSO时,原生质体再生率最高可达34%,较未添加时提高了1.125倍。
2.3 融合子的筛选
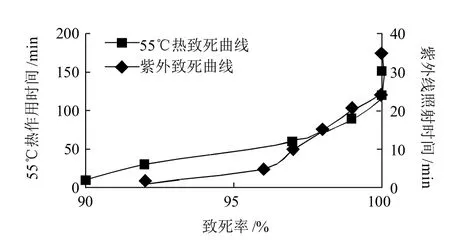
图2 紫外线照射时间及55℃热作用时间对谷氨酸棒杆菌原生质体致死率的影响Fig.2 Effects of UV irradiation and heating at 55 ℃ on the survival of Corynebacterium glutamicum protoplasts
将融合子的再生与抗性筛选分步操作(即原生质体融合后先再生,待长出菌落后再转接于抗性平板上),并同时采用多亲本灭活法进一步提高筛选效率。由图2可知,候选菌库中菌株的原生质体致死率达100%时,需紫外线照射25min或55℃热处理120min。多亲本灭活法与原生质体再生、抗性筛选分步操作相结合,筛选产量提高的融合子的速度大为提高。
2.4 两轮基因组改组菌株产L-鸟氨酸的比较
以候选菌库中的6株菌株为出发菌株,进行第一轮改组。经诱变后的菌株获得了新的遗传性状,耐受SG和 NaF的能力也发生了变化,因此抗性平板中这两种物质的质量浓度也要随之调整。第一轮改组后所用抗性平板中的SG和 NaF质量浓度分别提高至0.7g/L及1.0g/L(候选菌库中的菌株在此质量浓度条件下均不能生长)。在此抗性平板上长出的菌落中随机挑选80株菌株进行初筛,再复筛,得到L-鸟氨酸产量进一步提高的第一代改组菌株:F1-3、F1-8、F1-12、F1-23、F1-56、F1-77,其平均L-鸟氨酸产量达1.92g/L,比候选菌库中菌株的平均产量提高96%,如图3所示。以此为F1代6株菌株再次进行基因组改组,结果获得4株产量有所提高的第二代改组菌株:F2-6、F2-21、F2-23、F2-29,其L-鸟氨酸产量(2.85g/L)比第一代改组菌株平均产量提高50%,其中F2-6产量最高达2.99g/L,是原始菌谷氨酸棒杆菌ATCC 13032L-鸟氨酸产量的13.6倍。
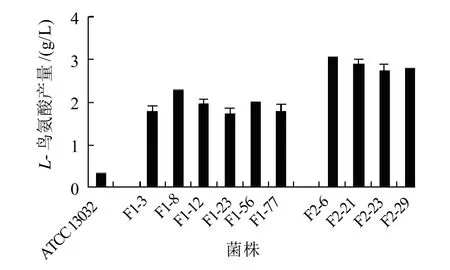
图3 基因组改组菌与原始菌发酵产L-鸟氨酸的比较Fig.3 Comparison of L-ornithine yield between the starting wide-type strain and genome shuffled mutants
2.5 F2代改组菌的遗传稳定性
为保证菌株在传代过程中不受培养基的影响,本实验以抗性筛选培养基为斜面培养基,将F2代4株菌株分别传代至第6代,再同时进行L-鸟氨酸摇瓶发酵。由表2可知,F2-21和F2-23分别在传至第3代及第4代出现突变,产量下降明显。F2-6和F2-29产酸较稳定,其中F2-6产量最高,传6代,平均产L-鸟氨酸为2.93g/L。可见,改组菌也有遗传不稳定的可能。F2-6和F2-29遗传稳定性好,可用于后续研究。
表2 F2代改组菌株的遗传稳定性(±s,n=3)Table 2 Results of genetic stability tests obtained for strains(± s,n = 3)
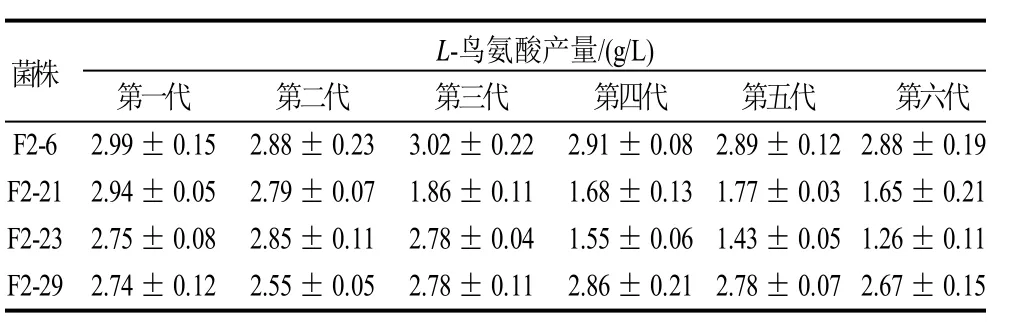
表2 F2代改组菌株的遗传稳定性(±s,n=3)Table 2 Results of genetic stability tests obtained for strains(± s,n = 3)
菌株 L-鸟氨酸产量/(g/L)第一代 第二代 第三代 第四代 第五代 第六代F2-6 2.99±0.15 2.88±0.23 3.02±0.22 2.91±0.082.89±0.12 2.88±0.19 F2-21 2.94±0.05 2.79±0.07 1.86±0.11 1.68±0.131.77±0.03 1.65±0.21 F2-23 2.75±0.08 2.85±0.11 2.78±0.04 1.55±0.061.43±0.05 1.26±0.11 F2-29 2.74±0.12 2.55±0.05 2.78±0.11 2.86±0.212.78±0.07 2.67±0.15
2.6 原始菌ATCC 13032与改组菌株F2-6、F2-29摇瓶发酵比较
将原始菌ATCC 13032、改组菌F2-6、F2-29的种子液分别接入发酵培养基中,测定摇瓶发酵72h过程中菌株生长及L-鸟氨酸生产情况。由图4可知,发酵前期L-鸟氨酸的积累较慢,发酵24h后,3株菌株产酸速率加快,发酵72h时产酸量达到最高峰,且F2-6、F2-29,分别是其产量的13.6倍和12.5倍;改组菌F2-6与原始菌的生长曲线相似,均在发酵12h达到稳定期,F2-29则于发酵24h达到稳定期,其最终菌体浓度也大于前两者,是原始菌的菌体浓度的115%。
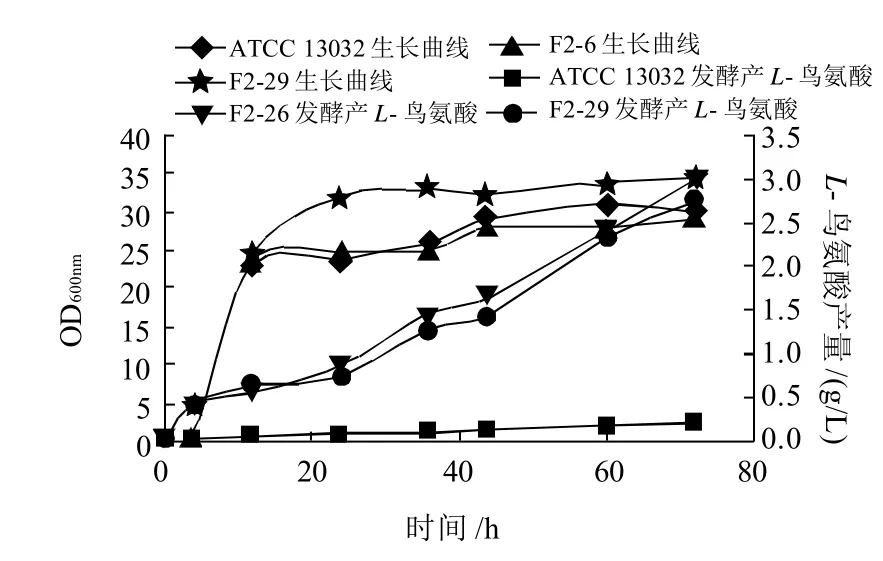
图4 原始菌ATCC 13032与改组菌F2-6、F2-29的摇瓶发酵曲线Fig.4 Growth curves and L-ornithine accumulation curves of strains ATCC 13032, F2-6 and F2-29 in shake-flask culture
3 讨 论
谷氨酸棒杆菌ATCC 13032基因组序列的公布为探索L-鸟氨酸代谢机制提供了契机。基因组改组技术,不仅可快速改进细胞表型,而且还将在代谢工程及基因组学研究中发挥重要作用。本实验以谷氨酸棒杆菌ATCC 13032为出发菌,通过两轮基因组改组获得2株性能稳定的L-鸟氨酸高产菌,其中F2-6产量最高为2.99g/L,是出发菌株的13.6倍,为本课题组探索谷氨酸棒杆菌的L-鸟氨酸代谢机制及后续研究奠定了基础。目前,L-鸟氨酸代谢工程菌最高产量为3.295g/L[7](该生产菌株也是以ATCC 13032为出发菌,经改造而得)。通过两轮基因组改组获得的F2-6产量与之接近。
进行基因组改组首先需要构建一个候选菌库,该菌库中各正突变株的基因组之间差别越大,基因组改组后获得表型有较大改进的杂交菌种的可能性就越大[18]。为扩大候选菌库中菌株的遗传背景的差异,采用3种高效诱变剂(NTG、UV、EMS)分别对谷氨酸棒杆菌ATCC 13032进行诱变。但如何高效筛选目的表型的突变株一直是诱变育种中的难点。拟选用合适的抗性标记,以加快菌种筛选进程。据报道具有SG抗性的突变株,L-鸟氨酸产量会有较大提高[19];具有NaF抗性的菌株,L-谷氨酸(合成L-鸟氨酸的前体)产量也有望增加。因此,选用SG和NaF为抗性筛选标记。
研究过程中发现,采用常见的谷氨酸棒杆菌再生培养基[17]来再生ATCC 13032的原生质体,结果仅获得了16%的再生率,导致获得高产量融合子的概率偏低。DMSO能保护细胞膜的稳定性,增加细胞对营养物质的吸收;而钙离子则能与细胞膜磷酯中一些负电荷相结合,增加细胞膜的稳定性和完整性[20]。DMSO和CaCl2的添加可提高谷氨酸棒杆菌原生质体的再生率,以保证高产改组菌能够再生。
而对于融合子的筛选,先尝试了将多亲本的原生质体融合后直接用含有SG及NaF的再生培养基再生,但培养一周后仍未发现有菌落长出。这可能是原生质体再生和抗性标记的双重压力抑制了菌株的生长。因此,本实验采用将融合子的再生与抗性筛选分步操作。
总之,构建遗传背景差异较大的正突变菌库,选用SG和NaF为双抗性筛选标记,提高原生质体的再生率,采用多亲本原生质体灭活法,是本研究在短时间内筛选出高产菌的关键。另外,谷氨酸棒杆菌是多种氨基酸的生产菌,本研究还将为其他氨基酸高产菌的选育及其代谢机制的探讨提供借鉴。
[1] MORRIS S M. Regulation of enzymes of the urea cycle and arginine metabolism[J]. Annu Rev Nutr, 2002, 22: 87-105.
[2] 汪江波, 邹玉玲, 薛海燕.L-鸟氨酸的生物功能及生产研究[J]. 食品研究与开发, 2007, 28(3): 166-169.
[3] JALAN R, WRIGHT G, DAVIES N A, et al.L-Ornithine phenylacetate(OP): a novel treatment for hyperammonemia and hepatic encephalopathy[J]. Med Hypotheses, 2007, 69: 1064-1069.
[4] SHI H P, FISHEL R S, EFRON D T, et al. Effect of supplemental ornithine on wound healing[J]. J Surg Res, 2002, 106: 299-302.
[5] GOTOH T, KIKUCHI K I, KAGAYA A. Direct production ofL-ornithine from casein by commercial digestive enzymes and in situ activated arginase[J]. Bioprocess Biosyst Eng, 2010, 33: 773-777.
[6] HWANG J H, HWANG G H, CHO J Y. Effect of increased glutamate availability onL-ornithine production inCorynebacterium glutamicum[J]. J Microbiol Biotechnol, 2008, 18(4): 704-710.
[7] LEE S Y, CHO J Y, LEE H J, et al. Enhancement of ornithine production in proline-supplementedCorynebacterium glutamicumby ornithine cyclodeaminase[J]. J Microbiol Biotechnol, 2010, 20(1): 127-131.
[8] LEE Y J, CHO J Y. Genetic manipulation of a primary metabolic pathway forL-ornithine production inEscherichia coli[J]. Biotechnol Lett, 2006, 28: 1849-1856.
[9] ZHANG Yingxin, PERRY K, VINCI V A, et al. Genome shuffling leads to rapid phenotypic improvement in bacteria[J]. Nature, 2002, 415: 644-646.
[10] KANG J X, CHEN X J, CHEN W R, et al. Enhanced production of pullulan inAureobasidium pullulansby a new process of genome shuffling[J]. Process Biochem, 2011, 46: 792-795.
[11] 于雷, 雷霆, 裴晓林, 等. 应用基因组改组选育耐糖L-乳酸高产菌[J]. 食品科学, 2007, 28(9): 369-373.
[12] 王立梅, 齐斌. 基因组改组技术对L-乳酸产生菌耐热性的影响[J]. 食品科学, 2008, 29(10): 395-378.
[13] JOHN R P, GANGADHARAN D, NAMPOOTHIRI K M. Genome shuffling ofLactobacillus delbrueckiimutant andBacillus amyloliquefaciensthrough protoplasmic fusion forL-lactic acid production from starchy wastes[J]. Bioresource Technol, 2008, 99(17): 8008-8015.
[14] WANG Mingzi, LIU Shaosong, LI Yaoyao, et al. Protoplast mutation and genome shuffling induce the endophytic fungusTuberculariasp.TF5 to produce new compounds[J]. Curr Microbiol, 2010, 61: 254-260.
[15] ZHANG Ying, LIU Jianzhong, HUANG Junsheng, et al. Genome shuffling ofPropionibacterium shermaniifor improving vitamin B12 production and comparative proteome analysis[J]. J Biotechnol, 2010, 148:139-143.
[16] 张媛媛, 刘建忠, 江文明. 定向诱变谷氨酸棒杆菌13032产L-鸟氨酸的研究[J]. 现代食品科技, 2010, 26(12): 1330-1334.
[17] 张克旭, 陈宁, 张永志, 等. 用原生质体融合技术选育谷氨酸高产菌[J]. 微生物学报, 1991, 31(2): 108-114.
[18] 陈涛, 陈洵, 王靖宇, 等. DNA及基因组改组在代谢工程中的应用[J]. 化工学报, 2004, 55(11): 1753-1758.
[19] 邹玉玲, 薛海燕, 汪江波, 等. 钴60与紫外线复合诱变选育L-鸟氨酸高产菌株[J]. 华西药学杂志, 2007, 22(3): 263-265.
[20] 王春平, 韦强, 鲍国连, 等. 微生物原生质体融合技术研究进展[J].动物医学进展, 2008, 29(5): 64-67.
Genome Shuffling for Rapid Improvement ofL-Ornithine Production byCorynebacterium glutamicum
ZHANG Yuan-yuan1,2,LI Jia-zhou1
(1. Department of Food and Bioengineering, Guangdong Industry Technical College, Guangzhou 510300, China;2. School of Life Sciences, Sun Yat-sen University, Guangzhou 510300, China)
Genome shuffling was applied toCorynebacterium glutamicumATCC13032 to achieve rapid improvement ofL-ornithine production. Six mutant strains with subtle improvements inL-ornithine production were obtained by treatment with UV light, nitrosoguanidine or ethyl methane sulfonate and subjected to recursive protoplast fusion. The effects of medium components on the protoplast regeneration rate were investigated. High-yield strains were screened using plates containing different concentrations of sulfaguanidine and NaF. After two rounds of genome shuffling, two shuffled strains producingL-ornithine at high level with good genetic stability were selected and named as F2-6 and F2-29. After 72h of shake-flask fermentation, theL-ornithine yield of strain F2-6 reached 2.99 g/L, which was 13.6 times higher than that of the original strain.
genome shuffling;Corynebacterium glutamicum;L-ornithine;production
Q939.97
A
1002-6630(2012)15-0206-04
2011-08-22
国家自然科学基金面上项目(20876181)
张媛媛(1979—),女,讲师,博士研究生,研究方向为代谢工程。E-mail:merryyuan8044@sina.com

