桃种皮组织结构和超微结构观察
张宏平,张晋元,吴国良
(1.山西晋城职业技术学院,山西 晋城048026;2.河南农业大学 园艺学院,河南 郑州450002)
桃(Amy gdal us persia L.)原产于我国黄河上游海拔1200~2000 m的高原地带,是深受广大人民喜爱的水果之一。它不仅外观艳丽,肉质细腻,而且营养丰富[1,2]。在桃研究方面,资料较多,从品种选育到栽培生理、从外观的器官组织到微观的细胞超微结构[3~5],但关于不同时期桃种皮组织结构和超微结构发育情况、韧皮超微结构及维管束结构研究未见报道。本研究对桃种皮各个时期微观结构进行了观察,以期为丰富干果类种皮微观结构和韧皮部糖卸载方式的研究作出贡献。
1 材料与方法
1.1 试验材料
材料采自山西省万荣县汉薛镇南坡村董谋为果园。在桃各自的盛花期后每隔15天取一次材料,直到9月份果实成熟。电镜观察试验分别在南京农业大学电镜室和中国农业大学电镜室进行。
1.2 试验方法
1.2.1 透射电镜样品制备
组织包埋块的制备参考张大鹏等[6]的方法,略有一些改动。用双面刀片将桃果实维管束组织切成2~3 mm3的小块,用3%的戊二醛(用2 mol·L-1的磷酸缓冲液配制,p H 7.2)在4℃下前固定6 h,同时抽气直到切块下沉为止。1 mol·L-1磷酸缓冲液冲洗后,用1%锇酸在4℃后固定过夜,用1 mol·L-1磷酸缓冲液冲洗后,4℃下系列乙醇脱水,纯丙酮过渡,Spurr(Dow Chemical co,USA )包埋,在68℃下聚合8 h。修块后用LKB-8800型切片机切片(厚度为60~90 n m),醋酸双氧铀和柠檬酸铅双染法染色,在透射电镜(日立 H-7650和JEOL-1230)下观察。
1.2.2 半薄切片样品制备
在透射电镜做好包埋块的基础上用KLB-V超薄切片机上半薄切片,厚0.3~0.5μm。将薄片挑入沾水滴的载玻片上,于60℃温台上烘干或将玻片背面谨慎地温火烘干,使切片粘贴于玻片上.采用亚甲蓝/天青 A(p H 6.9)/番红(p H 9.1)快速染色法[7],水洗干净,中性胶封片,用Oly mpus显微镜观察并拍照。
2 观察结果
2.1 桃种皮不同时期组织结构
在桃果实发育成型时,桃种皮明显的可以分为外、中、内3层细胞,从早期到晚期,其细胞学上的变化相当明显。
在桃种皮发育早期,外种皮面积占到整个种皮横截面的1/2还多,外种皮为11~13层,从外到内细胞由大到小,由不规则到比较规则的椭圆形或圆形(图1,A)。这层细胞的绝大部分为种皮薄壁细胞组成,其中贮存有滋养种胚发育的大量营养物质。外种皮最内的两层细胞,细胞体积较小,细胞内含物较多(图1,A、B)。外种皮之内为一层过渡层,过渡层细胞壁不均匀,靠近外种皮细胞壁比较厚,靠近中种皮细胞壁较薄,且过渡层细胞内有黑色圆形颗粒状物质(图1,A、B)。中种皮细胞为17~20层,细胞大小一致和排列相对整齐;在低倍光学显微镜下可观察到,维管束分布于中种皮靠近内种皮一侧,并有规律的间隔一定数目的薄壁细胞出现一团维管束。维管束在中种皮呈长条状并排分布,筛管靠内,导管靠外,属于并列维管束(图1,A、B)。在筛管附近的薄壁胞质较浓,细胞排列紧密和胚更容易吸收营养物质有关(图1,B)。桃内种皮由2层细胞组成,有两类型的细胞,一种是细胞内的细胞质相对较少,细胞比较小,细胞之内有黑色颗粒状物质,此种细胞组成了内种皮的内层;另一种细胞体积较大,细胞质比较浓,有的甚至充满了整个细胞,另外,部分细胞呈透明状,内种皮最内一层由这两种细胞间隔分布(图1,A、B)。
桃种皮发育到中期,外种皮细胞形成“三明治”状的细胞层,外种皮中间细胞层石细胞化,外种皮两边细胞层解体并木质化,此时外种皮占整个种皮横截面约1/6左右。过渡层细胞空洞化,细胞壁全部木质化。中种皮细胞生长旺盛,大部分薄壁细胞都被细胞质充满,细胞间隙变小,并在中种皮零星的出现鞋状的酚类细胞;维管束进一步发育,在分布有维管束的中种皮部分,体积膨大呈现凸型(图1,C、D)。内种皮细胞的最内层出现大的空泡,占据了细胞大部分体积,细胞质被挤向边缘,并出现一定数量的细胞壁被染成蓝色的特殊细胞,其体积增大,细胞壁次生加厚很明显,另外1~2层的细胞充满黑色颗粒状的物质,逐渐转变成大量的实心细胞(图1,D)。
在桃种皮的末期,最明显的特点有:各层细胞迅速解体,导致整个种皮的横截面面积大幅度减小,细胞木质化程度加重。外种皮的中间层进一步高度木质化,成为一石细胞层镶嵌在外种皮中,外种皮各层细胞木栓化进一步加深,相对整个种皮,其面积比例又增大了,占1/2左右(图1,E、F)。过渡层细胞的空洞被木质素类物质充满,形成完全木质化的细胞层。中种皮靠近过渡层的细胞解体相当明显,其他薄壁细胞变长,有进一步老化的趋势;维管束形状变化比较明显,导管和筛管融为一体,不易区分,但整个种皮维管束及其周围的薄壁细胞变化不大(图1,E、F)。内种皮细胞没有解体迹象,细胞体积继续增大,细胞空泡化进一步明显,两层细胞大小悬殊,细胞间形成很大的胞间隙,推测可能参与形成了种皮和胚之间的自由空间(图1,F)。
2.2 桃种皮超微结构观察
2.2.1 桃种皮薄壁细胞超微结构
桃种皮早期时,薄壁细胞最典型的特征是细胞质很丰富,大量的线粒体,典型的内质网,质体,丰富的细胞质,相当发达的胞间连丝,显示了细胞旺盛的生命活动(图2,A)。发育至中期,细胞体积增大,细胞间隙变大,大的液胞占据了细胞大量的空间,大量的淀粉粒、线粒体、大量致密的细胞质被挤向细胞边缘,细胞之间存在胞间连丝(图2,B)。在末期,最明显的是细胞间隙进一步增大,大量细胞器降解,线粒体上的嗜锇颗粒比较明显,各种细胞器絮状化并趋向模糊,出现大量囊泡,但还存在有较多的线粒体(图2,C)。在末期外种皮细胞壁木质化,细胞扭曲变形占据了细胞间隙(图2,D)。

图1 桃种皮组织结构Fig.1 The tissue structure of seed pericarp about peach and almond
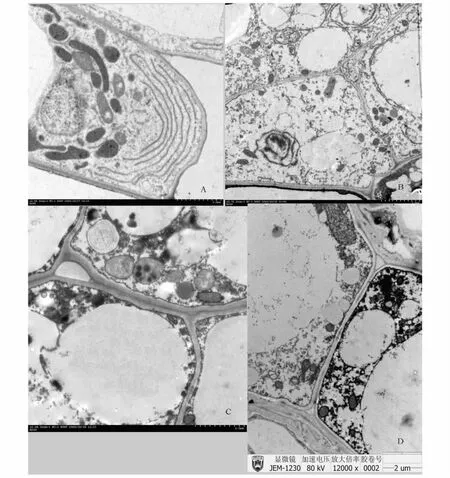
图2 桃种皮超微结构Fig.2 The ultrastructure of seed and fruit pericarp about peach
2.2.2 桃种皮SE/CC复合体的结构及与周围韧皮薄壁细胞之间的细胞学联系
桃果皮维管束韧皮部的SE/CC复合体中,CC细胞质相当浓,存在着大量的线粒体、质体、囊泡和大量电子染色较深的细胞质,细胞核比较大;SE细胞质较少,细胞内含物较少,只有散落在细胞中的部分细胞质和囊泡,在细胞内周缘也见少量的线粒体。SE/CC之间的胞间连丝在SE一侧为单通道,而在CC一侧为多通道分叉状,整体来说SE比CC体积大或者相差不大。(图3,B、D、E)。
在桃种皮维管束与其周围薄壁细胞的超微结构观察可知,韧皮部薄壁细胞和SE、CC,韧皮部薄壁细胞之间,SE/CC复合体相互之间存在大量的胞间连丝(图3,A、C、E),SE/CC复合体之间的胞间连丝在结构上与已有报告的资料相同,即SE一侧是单通道,CC一侧是多通道;CC与普通韧皮薄壁细胞是单通道的胞间连丝(图3,B、D)。

图3 桃种皮维管束结构Fig.3 The vascular bundle ultrastructure of seed pericarp about peach
3 结论与讨论
3.1 桃种皮组织结构
桃种皮分为内、中、外3层,外层11~13层细胞,中层17~20层,内层2层。内种皮由两类细胞组成,一类是细胞质相对较少,细胞内有颗粒状黑色物质,一类细胞较大,细胞壁内嵴突出成为特殊细胞。根据有关资料,这两类细胞很可能是传递细胞,它们的功能均与物质的转运有密切关系,因为在维管束附近出现传递细胞研究报道的较多[8],但其在发育过程的功能及作用有待于进一步研究。第二类细胞在植物的根、茎、叶和生殖器官都有报道[8],特别是生殖器官中的胚乳部位多有报道[8~10],桃内种皮的中后期是否作为种皮和胚的营养物质和信息交流的桥梁、同时其在内种皮出现的时间、不同时期的作用和功能结构变化也有待于进一步研究。
3.2 桃种皮薄壁细胞超微结构
桃种皮薄壁细胞像大多数果实一样[10~14],早期细胞质丰富,分布大量线粒体和质体、典型内质网和发达的胞间连丝。中期细胞体积增大,胞间隙变大,有大量淀粉粒、较多线粒体。末期胞间隙进一步增大,大量细胞器降解,质体上嗜锇颗粒明显,但存在较多线粒体,外种皮胞壁木质化,细胞扭曲变形。这种现象与孙芳娟[15]观察到的油桃在贮藏50 d后,细胞壁弯曲或皱缩,质壁分离严重;细胞器变形或降解等现象相似。
3.3 桃种皮卸载方式
桃种皮SE与CC之间存在胞间连丝,SE/CC复合体与韧皮部周围薄壁细胞间胞之间也存在发达胞间连丝,由此初步推测从桃种皮韧皮部经共质体方式卸载,再被转移至胚用作种子的营养。这种卸载方式与核桃种皮和苹果果实的卸载方式一致[11,16],而与枣的卸载方式在早期是共质体和末期是质外体不一致[17]。另外,韧皮部卸载方式通过超微结构观察是其中的一部分工作,还需通过活体组织荧光示踪和酸性转化酶胶体金定位等实验方法来验证结果。
[1]汪祖华,庄恩及.中国果树志·桃卷[M].北京:中国林业出版社,2001:74-76.
[2]俞德浚.中国果树分类学[M].北京:农业出版社,1979:25-41.
[3]王富荣,赵剑波,佟兆国,等.桃种质资源亲缘关系的研究进展[J].植物遗传资源学报,2006,7(1):118-122.
[4]林斌,张晓峰,余亚白,等.国内外短低温桃的研究进展[J].中国农学通报,2006,22(2):280-284.
[5]牛良,王志强,刘淑娥,等.桃树不同生长型及其研究进展[J].果树学报,2004,21(4):354-359.
[6]张大鹏,王毅.葡萄果实发育过程中果肉细胞超微结构的观察[J].植物学报,1997,38:388-39.
[7]徐是雄.植物材料的薄切片超薄切片技术[M].北京:北京大学出版社,1981:6-32.
[8]初敬华.传递细胞[J].生物教学,1994(11):3-4.
[9]高荣岐.长豇豆胚和旺乳的发育及营养物质积累[J].植物学报,1992,34(4):271-277.
[10]胡适宜,朱澂,徐是雄,等.豇豆胚胎发育早期的胚柄及胚乳中的传递细胞[J].植物学报,1983,25:1-7.
[11]吴国良.核桃果实韧皮部卸载的细胞学路径[D].北京:中国农业大学博士学位论文,2004.
[12]张凌云.苹果果实韧皮部质外体卸载的证据[D].北京:中国农业大学博士学位论文,2003.
[13]Peng Y B,Zhang D P.Ultrastructure of epider mis and flesh of the developing apple fruit[J].Journal of Integrative Plant Biology,2000,42:749-802.
[14]李治梅,张玉星,许建锋,等.鸭梨、黄金梨果实结构与耐贮性的关系[J].果树学报,2006,23(1):108-110.
[15]孙芳娟,韩明玉,赵彩萍,等.不同采收成熟度油桃贮藏效果及果肉细胞超微结构观察[J].果树学报,2009,26(4):450-455.
[16]Zhang L Y,Peng Y B,Sandrine P T,etal.Evidence for apoplasmic phloem unloading in developing apple fruit[J].Plant Physiology,2004,135:574-586.
[17]聂佩显,关秋竹,张振贤,等.冬枣果实韧皮部及其周围薄壁细胞的超微结构观察和功能分析[J].电子显微学报,2009,28(4):389-395.

