GATA-4在不同能量水平下绵羊睾丸中的表达与定位分析
杨慧妮,武晓英,2,张春香,任有蛇,岳文斌
(1.山西农业大学 动物科技学院,山西 太谷030801;2.太原师范学院 生物系,山西 太原030006)
转录因子GATA-4是具有锌指结构的GATA家族中的第四个成员。该家族转录因子具有与特定DNA结合的锌指结构域,在进化过程中高度保守[1]。1996年 Huang等[2]应用原位杂交技术将人的GATA-4定位于8p23.1→p22,c DNA 全长3372 bp,有6个外显子,编码442个氨基酸。GATA-4在中胚层和内胚层起源的组织中广泛表达(如心脏、睾丸和卵巢等)。最初发现GATA-4可以调控心脏发育,随后证明它是成年心脏肥大的一个重要调控因子。GATA-4调控多种基因的表达,其调控作用在心脏、生殖系统、消化系统、呼吸系统和癌症中均占有重要地位。因此GATA-4的正反调控是其生物功能的重要组分[3]。
在过去十年中,大量研究了转录因子GATA在人类疾病中的作用[4]。目前GATA-4已成为研究的焦点,表明其在雄性性别决定、类固醇激素合成和细胞存活上有重要作用。尤其是在哺乳动物的繁殖有多个途径的调控上,可能有着决定性作用[5]。国外研究表明,GATA-4转录因子表达于Sertoli细胞,类固醇合成的睾丸Leydig细胞和其他睾丸体细胞[6],这说明GATA-4转录因子在睾丸中有表达,但在睾丸各类细胞中的表达情况如何,则报道很少[7]。本研究从分子水平探讨不同能量水平下睾丸中GATA-4 mRNA表达规律,并用免疫组化技术对睾丸中GATA-4进行定位研究,希望能够为探讨GATA-4在睾丸分化以及通过调控激素进而调控动物繁殖性能方面提供理论依据。
1 材料与方法
1.1 试验材料
1.1.1 主要试剂
DEPC:Sig ma公司
RNAiso Plus(Code:D9108A):Ta Ka Ra生物工程公司
Pri meScript®RT Master(Code:DRR036A):Ta Ka Ra生物工程公司
SYBR®Premix Ex TaqTMII (Code:DRR820 A):Ta Ka Ra生物工程公司
兔抗性GATA-4一抗:北京博奥森生物技术有限公司生物素标记的鼠抗兔二抗:武汉博士德生物公司即用型SABC免疫组化试剂盒:武汉博士德生物公司
DAB显色试剂盒:武汉博士德生物公司
1.1.2 试验动物
选用18只健康的、体重相近的杜泊羊×小尾寒羊未去势杂种公羔。在10天的适应期后,将18只羔羊随机分配到饲喂能量蛋白水平不同的3组中:自 由采食组 (Voluntary feed intake,VFI)、35%VFI组和65%VFI组。其中35%VFI组能量摄入为自由采食组的35%,65%VFI组能量摄入为自由采食组的65%。当自由采食组体重达35 kg时各组分别屠宰取样。
1.2 试验方法
1.2.1 取材及组织处理
通过颈静脉放血致死,取睾丸组织,用预冷的生理盐水冲洗表面的脂肪及血渍,DEPC水处理过的刀片分割成小块,经RNA酶灭活处理的锡箔纸包好快速装入预冷的冻存管中。每只另取相同部位睾丸组织,切成0.3 c m×0.5 c m×0.5 c m左右,用4%多聚甲醛在4℃固定24 h,0.01 mol·L-1PBS(p H 7.4)洗3次,进行脱水、包埋、5μm厚石蜡切片。
1.2.2 绵羊睾丸组织总RNA的提取
参照Ta Ka Ra公司RNAiso Plus实验操作说明进行睾丸组织总RNA的提取。
1.2.3 总RNA浓度的测定
通过Nanodr op-1000核酸蛋白测定仪检测纯度、浓度及 A260/A280。
1.2.4 c DNA第一链的合成
使用Pri meScriptTMRT Master中的反转录反应试剂进行反转录试验,反应体系(10μL)如下:5×Pri meScriptTMBuff er 2μL,Total RNA 1μL,RNase-Free d H2O 7μL。反转录程序为:37℃15 min,85℃ 5 s。所得c DNA 用 Nanodr op-1000核酸蛋白测定仪检测后可于-20℃保存3个月。
1.2.5 Real-time PCR检测不同能量水平下睾丸组织中GATA-4的表达
1.2.5.1 引物的设计及合成
本研究Real-time PCR以18S r RNA为内参基因,参考Gen Bank上已登录的牛的GATA-4(NM_001192877)的 mRNA 序列,利用 Pri mer Premier 5.0软件设计合成两对特异性引物,由北京六合华大基因科技股份有限公司合成,引物序列信息见表1。
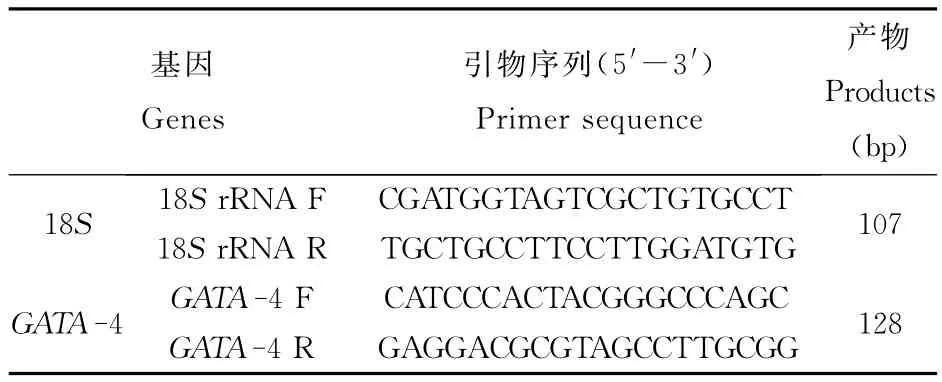
表1 荧光定量PCR所用引物序列Table 1 Pri mer sequences of quantitative PCR
1.2.5.2 标准曲线的绘制及定量分析
将c DNA 5×稀释8个梯度后进行荧光定量反应,软件自动得出目的基因GATA-4与内参基因18S r RNA的标准曲线方程、扩增效率R2及线性方程系数。根据标准曲线自动计算出每个样本中每微升18S r RNA和GATA-4的拷贝数。以内参基因18S r RNA的表达量将所测定的所有组织样品的GATA-4 mRNA的表达量进行标准化,得出对应的各个能量水平下的相对表达量。
1.2.5.3 Real-time PCR反应
根据SYBR®Premix Ex TaqTMII试剂盒(表1)建议的反应体系及优化确定的反应条件,进行内参基因和目的基因的相对定量分析。不同组织重复试验6只公羊,每种组织另设技术重复3次,根据标准曲线以及熔解曲线CT值计算定量结果。反应体系(10μL)如下:SYBR Premix Ex Taq II(2×)5μL、上下游引物各0.25μL,c DNA溶液1 μL,dd H2O 3.3μL,ROX Reference Dye II 0.2 μL。扩增条件为:95℃30 s,(95℃30 s,63℃35 s)60 Cycles,95℃15 s、63℃1 min、95℃15 s。
1.2.6 睾丸组织免疫组化染色
切片经二甲苯及梯度酒精脱蜡;3%H2O2封闭内源性过氧化物酶活性,室温10 min;水洗3 min×2次;加复合消化液抗原修复37℃,30 min;PBS洗3 min×3次;5%BSA封闭液室温封闭30 min;去除多余液体,滴加1∶300稀释Rabbit Anti-GATA-4多克隆一抗,湿盒内4℃过夜;PBS洗5 min×3次;加生物素标记二抗37℃,30 min;PBS洗5 min×3次;DAB显色10 min,蒸馏水冲洗2~3次终止显色;苏木精复染1 min,0.5%HCl酒精洗1 min;自来水冲洗2 min,脱水,二甲苯透明,中性树胶封片。同时设置阴性对照,用PBS代替一抗,其余步骤同上,确定免疫反应的特异性。
1.2.7 统计学分析
采用SPSS13.0软件进行完全随机设计资料单因素方差分析和显著性检验。
2 结果与分析
2.1 总RNA质量控制及RT-PCR检测
所提取睾丸总RNA纯度 A260/A280均介于1.8~2.0,表明所提取的RNA质量可靠,符合反转录要求。并且以RT-PCR反应的产物c DNA为模板进行内参基因和目的基因的PCR反应,通过琼脂糖凝胶电泳均可检测到扩增结果,表明反转录产物可用于后续目的基因的定量PCR。
2.2 定量标准曲线的建立
图1A、B分别为相对浓度57、56、55、54、53和52拷贝的18S r RNA和GATA-4 Real-time PCR扩增动力学曲线。目的基因和内参基因基线平稳,拐点清楚,平行性较好;图1 C显示扩增产物的熔解曲线只有单一的峰,无非特异性产物和引物二聚体;图1 D为软件自动绘制的标准曲线,在6个浓度梯度上呈良好的线性关系,扩增效率在100%~110%,回归系数分别为0.997和0.998,说明本研究建立的GATA-4和18S r RNA定量检测方法有效。
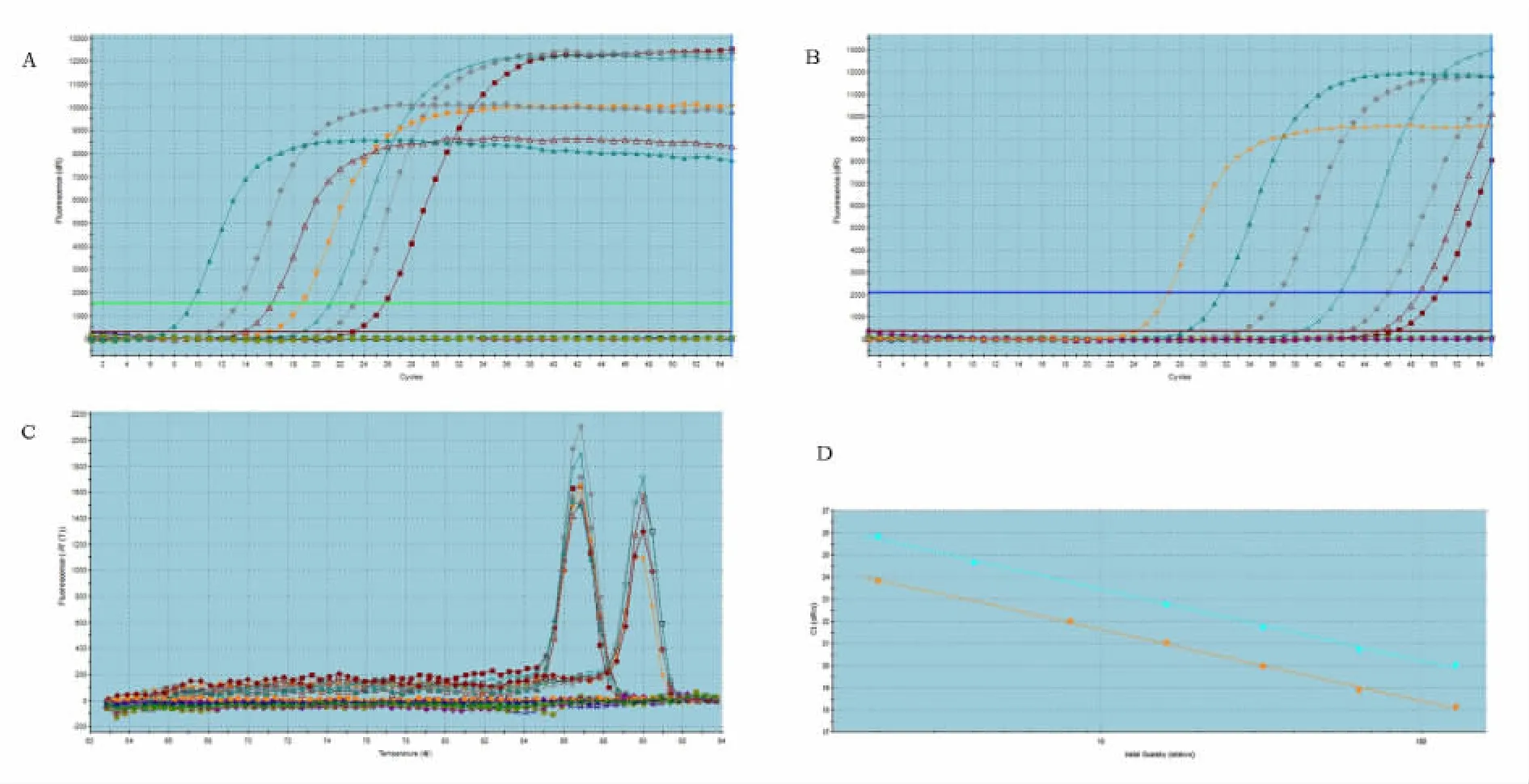
图1 GATA-4与18S r RNA基因扩增动力学曲线、标准曲线及样品熔解曲线Fig.1 PCR amplification plots,standard curves and dissociation curves for GATA-4 and 18Sr RNA
2.3 不同能量水平下GATA-4 mRNA的表达差异
由图2可以看出,经过内参18Sr RNA对绵羊睾丸GATA-4表达量的校正,GATA-4在自由采食组的表达量最多,其他能量水平与其相比差异极显著(P<0.01),顺序依次为:35%VFI组<65%VFI组<自由采食组(VFI)。
2.4 GATA-4在不同能量水平下睾丸中的表达特点
鉴于GATA-4 mRNA在不同能量水平下睾丸中表达水平不同,采用免疫组化技术对GATA-4进行定位研究。结果显示,GATA-4免疫反应产物在35%VFI、65%VFI、自由采食3个能量水平绵羊睾丸组织中均有分布,且在各级生精细胞、Sertoli细胞和Leydig细胞均有表达,而阴性对照DAB染色结果则无明显表达产物(图3)。

图2 不同能量水平下绵羊睾丸中GATA-4 mRNA相对表达量Fig.2 Relative GATA-4 mRNA expression in the testes of sheep at different energy levels

图3 绵羊睾丸组织GATA-4表达结果(免疫组化×400)Fig.3 Expressions of GATA-4 in the testis of different groups of sheep(immunoh is tochemistry×400)
从图3可看出,在35%VFI能量水平下,GATA-4主要表达于Sertoli细胞中,在Leydig细胞和生精细胞中有少量表达,且精子的形成量明显少于65%VFI和自由采食能量水平。GATA-4在自由采食组个体的Leydig细胞和Sertoli细胞中表达较多,但更多地表达于生精细胞。自由采食组中,GATA-4表达阳性的生精细胞率以及精子量也明显高于65%VFI能量水平(表2)。
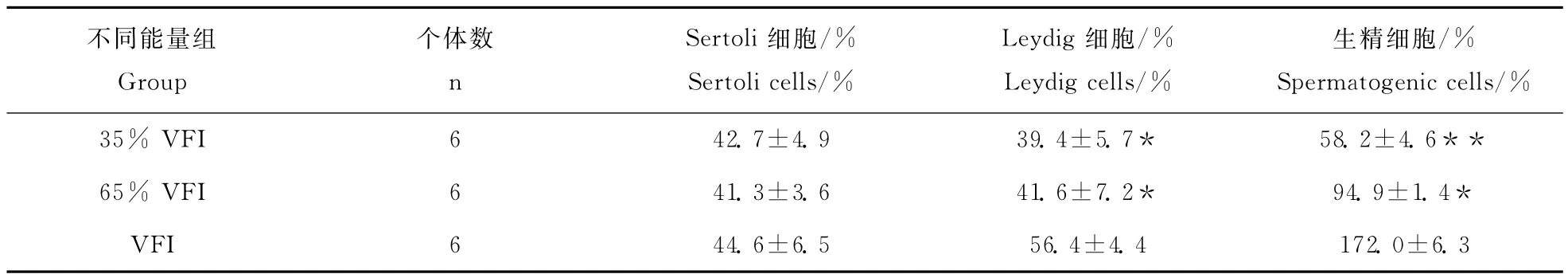
表2 不同能量水平下小鼠睾丸组织中GATA-4的阳性细胞率Table 2 Percentage of positive cells for GATA-4 expression in the testes of sheep at different energy levels
3 结论与讨论
GATA家族在哺乳动物卵巢和睾丸的多种细胞中均有表达,对生殖系统的发育具有重要意义,可调控动物的性别决定和生殖功能。GATA-4在猪的性别分化到性成熟的各个时期均有表达,从睾丸分化到成熟阶段,也检测到Sertoli细胞和Leydig细胞存在GATA-4 mRNA。研究结果表明,GATA-4转录因子能通过与SF-I转录因子的相互作用转录激活缪勒氏抑制素,从而导致缪勒氏导管的单向退化和中肾导管系统的发育增强,进而影响性别分化[8,9]。进一步的研究证明,转录因子GATA-4和GATA-6在哺乳动物性腺细胞系的分化和生殖过程中各激素的调节上都有着不可或缺的作用[10]。
动物的营养状况与其生产、繁殖密切相关。能量是哺乳动物营养的基础,也是生殖细胞生长发育和合成生殖激素的物质基础[11]。不同能量水平下GATA-4 mRNA在绵羊睾丸组织中均有表达,但表达量存在差异,这与能量摄入量是密切相关的,说明能量水平影响GATA-4 mRNA的表达量。能量水平同样会影响哺乳动物促性腺激素释放激素(Gn RH)的脉冲产生系统及性腺素的释放。景彩霞等认为,促性腺激素可以上调GATA-4的表达[12],在睾丸Sertoli细胞和Leydig细胞的增殖旺盛时期表达增强。GATA-4因子可正向调控性腺轴激素的表达量,其大量结合会提高Gn RH的分泌量,进而直接影响FSH和L H等激素的分泌,且GATA-4参与FSH到Gn RH的反馈调节路径。这说明GATA-4的表达与性腺轴激素的分泌和表达存在着相互调控的关系,但是其调控机制有待于进一步研究。
精子的成熟离不开GATA-4对Sertoli细胞和Leydig细胞的调控[13]。GATA-4通过调控Sertoli细胞及Leydig细胞来促进精子成熟,还可直接作用于生精细胞来促进精子的形成。通过免疫组化技术定位GATA-4在睾丸组织中的表达,发现GATA-4在35%VFI组睾丸组织生精细胞的表达量明显少于65%VFI组和自由采食组,且精子的形成量也明显少于65%VFI组和自由采食组,顺序由小到大依次为:35%VFI组<65%VFI组<自由采食组,可见GATA-4的表达量与生精细胞的增殖和精子的形成有着密切联系。直观验证了GATA-4 mRNA在睾丸中表达存在差异的结果,故推测睾丸组织中GATA-4 mRNA表达差异是由能量摄入量不同造成的,其调控机制有待于进一步探索。
[1]El-Hachem N,Nemer G.Identification of new GATA4-small molecule inhibitors by structure-based virtual screening[J].Bioorganic and Medicinal Chemistry,2011,19:1734-1742.
[2]Huang W Y,Heng H H,Liew C C.Assign ment of the hu man GATA4 gene to 8p23.1→p22 using fl uorescence in situ hybridization analysis[J].Cytogenet Cell Genet,1996,72(2-3):217-218.
[3]宫立国,邱广蓉,徐小延,等.心脏特异转录因子NK X2-5、TBX5、GATA4与先天性心脏病的研究进展[J].国际遗传学杂志,2006,29(2):133-136.
[4]Yuichir o J,Suzuki.Cell signaling pat h ways for the regulation of GATA-4 transcription factor:Implications for cell growt h and apoptosis[J].Cell ular Signalling,2011,23:1094-1099.
[5]何远清,储明星,刘荣志,等.GATA 家族与哺乳动物繁殖[J].中国畜牧兽医,2007,34(11):42-45.
[6]Bielinska M,Seehra A,Toppari J,etal.GATA-4 is required for sex ster oidogenic cell develop ment in the fetal mouse[J].Develop mental Dyna mics,2007,236:203-213.
[7]杨加周,赵豫凤,王艳梅,等.GATA-4在小鼠睾丸中的表达定位研究[J].中华男科学杂志,2010,16(10):901-904.
[8]Ketola I,Rah man N,Toppari J,etal.Expression and regulation of transcription factors GATA-4 and GATA-6 in developing mouse testis[J].Endocrinology,1999,140(3):1470-1480.
[9]Tremblay J J,Robert N M,Viger R S.Modulation of endogenous GATA-4 activity reveals its dual contribution to Mulleran inhibiting substance gene transcription in Sertoli cells[J].Molecular Endocrinology,2001,15(9):1636-1650.
[10]La Voie HA.The role of GATA in ma mmalian repr oduction[J].Experi mental biology and medicine(May wood,N.J.),2003,228(11):1282-1290.
[11]巫亮.滩羊母羊日粮中能量和蛋白质水平对其繁殖性能影响的研究[D].宁夏大学硕士学位论文,2010.
[12]景彩霞,杨加周,艾庆燕,等.GATA 家族与生殖[J].中华男科学杂志,2009,15(10):932-936.
[13]Bielinska M,Seehra A,Toppari J,etal.GATA-4 is required for sex steroidogenic cell develop ment in the fetal mouse[J].Developmental Dynamics,2007,236(1):203-213.

