PLIN基因多态性及其与绵羊尾形和屠宰性状的关联研究
高中元,林婄婄,袁亚男,周沙沙,刘宝凤,刘建华,梁 琛,乔利英,刘文忠
(山西农业大学 动物科技学院,山西 太谷030801)
脂滴包被蛋白(perilipin)是一种可磷酸化的脂滴相关磷蛋白[1],由PLIN基因编码,在蛋白激酶A调控的脂肪代谢中具有重要作用[2,3]。在人和小鼠上的研究表明,PLIN基因主要在脂肪组织中表达[4,5],对脂肪组织中甘油三酯的储存和分解具有重要的双重调控作用[6,7],在类固醇生成细胞中有少量表达,主要调控胆固醇酯、类固醇激素合成前体的分解[8]。PLIN基因敲除的小鼠瘦体重(lean body mass)较大,脂肪细胞较小,表明它能增加瘦素(leptin)的表达,并且能够抵抗饮食诱导的肥胖[9]。对人类的研究发现,PLIN基因在肥胖个体的脂肪组织中过量表达[10],且该基因的单核苷酸多态性(SNP)与体脂重、低体重指数、肥胖风险以及总胆固醇水平关联[11~13]。对猪PLIN基因的研究表明,PLIN基因多态性与猪的平均日增重、瘦肉率和背膘厚关联[14]。对秦川牛的研究表明,PLIN基因多态性对脂肪沉积有一定影响,可作为改善牛肉品质和肉牛品种改良的候选基因[15]。
然而,PLIN基因在绵羊上的研究还未见报道。尾部是绵羊脂肪沉积和能量存储的重要部位,尾形的差异可能反映脂肪代谢水平的不同。鉴于该基因对机体脂肪代谢的重要作用,本研究以PLIN基因为目的基因,采用PCR-SSCP方法,检测两个具有明显尾形差异的绵羊品种的PLIN基因多态性,并分析这些多态与尾形和屠宰性状可能存在的关联,为肉用绵羊品种改良提供理论依据。
1 材料和方法
1.1 试验材料
广灵大尾羊(Guangling Large Tailed sheep,GLT)和小尾寒羊(Small Tailed Han sheep,STH)都起源于蒙古羊,同属于脂尾型绵羊,但尾型差异显著。广灵大尾羊属长脂尾型绵羊,尾大蓄脂力强,肉用性能好,但繁殖力低;小尾寒羊属短脂尾型绵羊,尾小蓄脂力弱,肉用性能一般,但繁殖力高[16,17]。
血样采自2、4、6、8、10和12月龄健康状况良好的广灵大尾羊和小尾寒羊。每品种每阶段8只,公母各半,共计96只。宰前称空腹重,测量尾长和尾宽,每个个体颈静脉采血10 mL,加入2 mL ACD抗凝剂,-70℃保存备用。宰后称胴体重和尾脂重,计算屠宰率和相对尾脂重(尾脂重/胴体重)。
1.2 基因组DNA的提取
采用常规的酚-氯仿抽提法提取绵羊血样基因组DNA,提取的DNA用TE缓冲液溶解稀释,然后用1%琼脂糖凝胶进行电泳检测,并用核酸浓度测定仪测定DNA浓度,-20℃保存备用。
1.3 PLIN基因引物设计和PCR扩增
引物设计,根据Gen Bank提供的绵羊PLIN基因 mRNA序列(NM_001113773.1)及牛PLIN基因序列(NC_007319),利用 Pri mer 3 Plus(http://www.bioinfor matics.nl/cgi-bin/pri mer3plus/pri mer3plus.cgi)在线设计引物,每个外显子设计1对引物,共设计9对引物,包含整个编码区序列(表1)。

表1 引物序列、产物大小及退火温度Table 1 Primer sequence,product sizes and annealing temperature
PCR扩增反应体系为15μL:模板DNA 1 μL,上下游引物各0.6μL,10×Buffer缓冲液1.5 μL,d NTP 1.2μL,Taq DNA 聚合酶0.3μL,灭菌dd H2O 9.8μL。PCR反应程序为:94℃4 min;94℃30 s、退火30 s、72℃30 s,35个循环;72℃延伸7 min;4℃保存。PCR产物用1%琼脂糖凝胶电泳检测。
1.4 PCR产物的SSCP分析
将1μL PCR产物和9μL缓冲液混合,98℃变性10 min,冰浴20 min,使产物保持变性状态,在1×TBE电泳缓冲液中用12%的非变性聚丙烯酰胺凝胶进行电泳,先300 V高电压电泳15 min,再130 V电压电泳过夜,电泳结束后银染显色并照相、分析。
1.5 统计分析
1.5.1 基因频率和基因型频率
等位基因频率、基因型频率、杂合度、纯合度以及有效等位基因数用Arlequin软件[18]计算,用POPGENE软件[19]进行哈代-温伯格平衡(Hardy-Weinberg equilibriu m,H WE)检验。用SPSS 17.0软件(SPSS Science,Chicago,IL,USA)进行PLIN基因型在两个群体间分布差异的显著性检验。
1.5.2 多态信息含量
用多态信息含量(Pol y mor phis m Infor mation Content,PIC)估计PLIN基因的多态性,表示该基因的变异程度。PIC>0.5为高度多态,0.25<PIC<0.5为中度多态,PIC<0.25为低度多态,利用Botstein等[20]的公式计算。
1.5.3 关联分析模型
PLIN基因多态位点遗传效应用SPSS 17.0软件(SPSS Science,Chicago,IL,USA)中的一般线性模型(GL M)进行统计分析,GL M为:
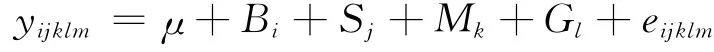
式中:yijklm为性状表型值,μ为总体均值,Bi为第i个品种效应(i=1,2),Sj为第j个性别效应(j=1,2),Mk为第k个月龄(k=2,4,…,12),Gl为第l种基因型效应,eijklm为残差效应。
2 结果
2.1 PLIN 基因PCR-SSCP结果
对PLIN基因9个外显子扩增产物进行SSCP检测发现,外显子3~6和8存在多态性(图1),其中外显子3、4、6检测出了A、B两个等位基因,三种基因型;外显子5检测出了A、B两个等位基因,AA、AB两种基因型;外显子8检测出了A、B、C三个等位基因,AA、AB、AC三种基因型。

图1 PLIN 基因外显子3、4、5、6、8扩增产物PCR-SSCP电泳结果Fig.1 The PCR-SSCP of amplified products of PLIN gene
2.2 基因型频率和等位基因频率
两个绵羊品种PLIN基因不同外显子的基因型频率和等位基因频率见表2。在广灵大尾羊和小尾寒羊两个品种中,外显子3、4、6中AA基因型频率和A等位基因频率都明显高于BB基因型频率和B等位基因频率;外显子5和8中A等位基因频率显著高于B等位基因频率,未检测出BB基因型;外显子8中检测出了AC基因型,未检测出BB基因型,且C等位基因频率显著低于A等位基因频率。
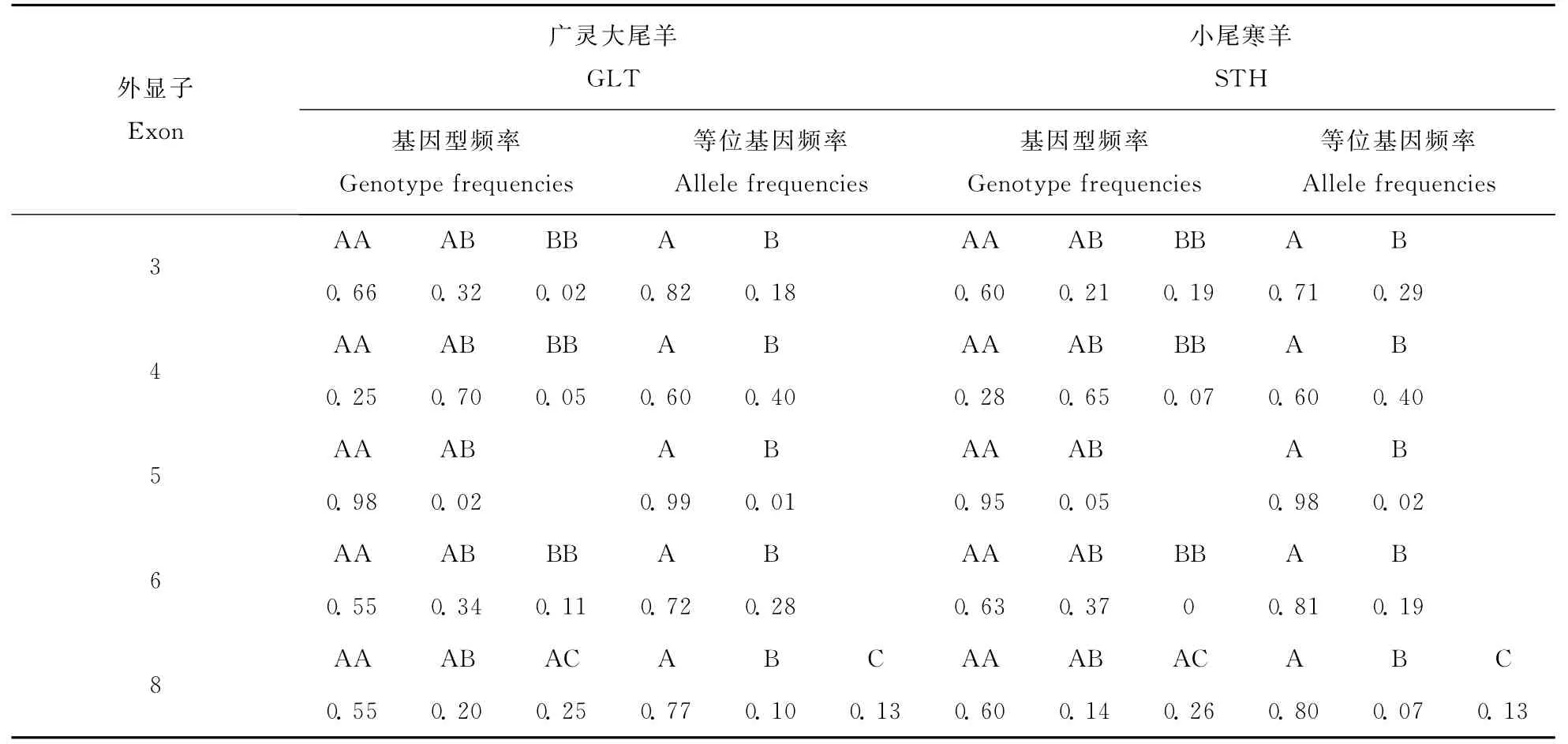
表2 两个绵羊品种PLIN基因各外显子的基因型频率和等位基因频率Table 2 Genotype and allele frequencies of exons in PLIN gene in two sheep breeds
PLIN基因不同多态位点的纯合度(Homozygosity,Ho)、杂合度(Heter ozygosity,He)、有效等位基因数(Effective number of allele,Ne)以及H WE检验、卡方独立性检验结果见表3。广灵大尾羊和小尾寒羊都是第5外显子多态位点纯合度最高;H WE检验结果表明外显子4多态位点在两个品种中都不平衡,外显子3多态位点在小尾寒羊群体中不平衡,而其他位点处于H WE。
卡方独立性检验表明,外显子3的基因型频率在广灵大尾羊和小尾寒羊品种间存在显著差异(P<0.05),而其他外显子的基因型频率无品种差异。
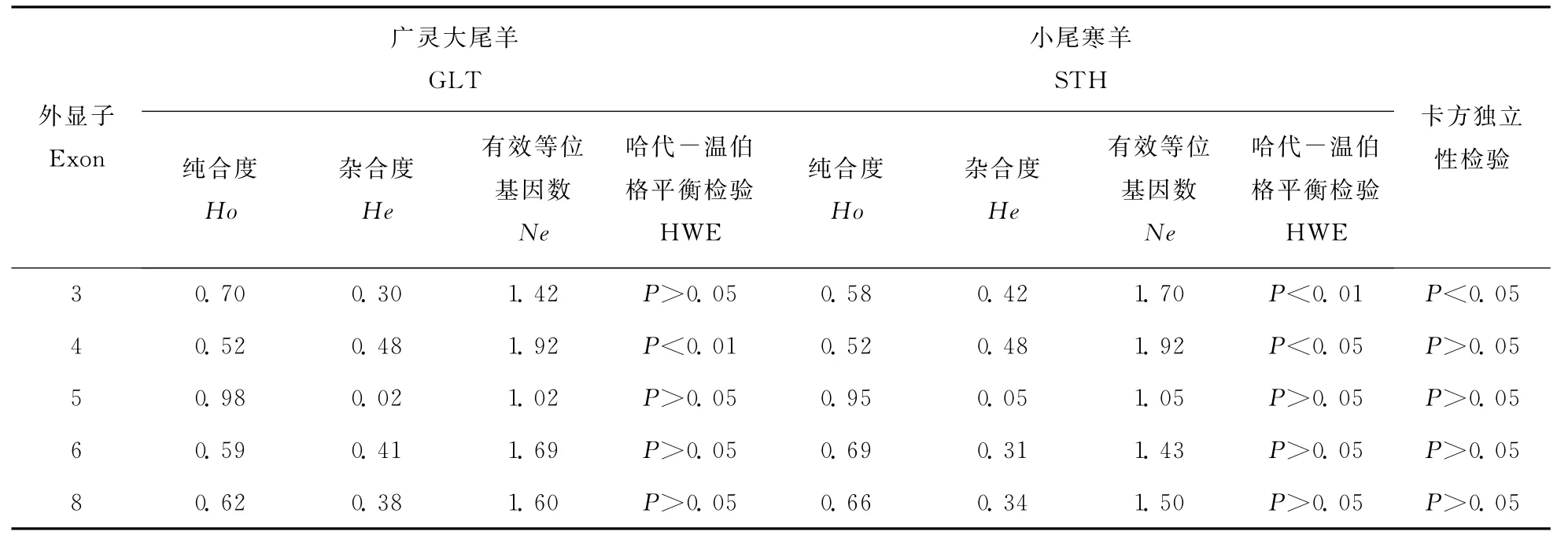
表3 PLIN基因各外显子的遗传多样性指数和哈代-温伯格平衡检验Table 3 The genetic diversity indices and Hardy-Weinberg equilibrium test of PLIN gene
2.3 PLIN基因各外显子的多态信息含量
除外显子5外,其余4个外显子的PIC介于0.25~0.5间,反映了以往并未对该基因进行过高度选育,在两个品种均呈中度遗传多态;外显子5的多态信息含量极低,遗传一致性较高。
2.4 PLIN基因多态性对尾形和屠宰性状的影响
不同品种、性别、月龄各因素各水平下尾形和屠宰性状的均值和标准误见表4。因未测小尾寒羊的尾脂重,难以确切地说明品种间的差异。但除屠宰率外,所有其他性状均是广灵大尾羊显著地(P<0.05)大于小尾寒羊,公羊大于母羊。这些结果也进一步佐证了广灵大尾羊的肉用性能优于小尾寒羊。所有性状月龄间差异显著,且基本随月龄的增大而增加。
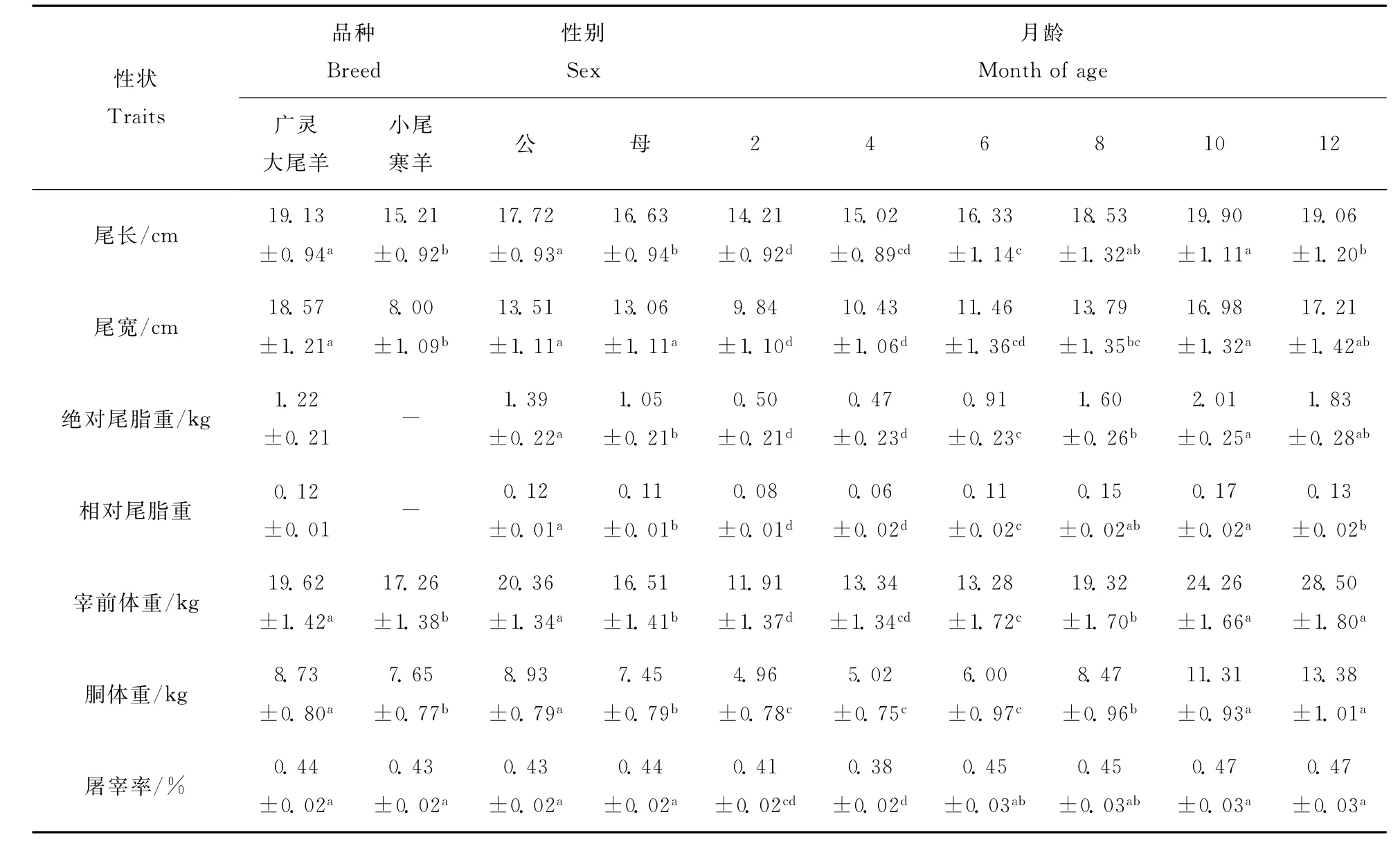
表4 品种、性别和月龄对尾形和屠宰性状的影响Table 4 Effects of breed,sex and month of age on tail and slaughter traits
在考虑上述各因素的同时,对PLIN基因的多态性与有关性状进行关联分析,结果(表5)表明,外显子4和6的多态性显著影响相对尾脂重(P<0.05),其中外显子4的BB型个体(0.14)的相对尾脂重显著大于 AA(0.11)和 AB型(0.09)个体;而外显子6的AA型个体(0.13)的相对尾脂重显著大于 AB(0.11)和 BB型(0.10)个体;外显子5的多态性对尾宽的影响极显著(P<0.01),其中AA型个体(15.71 c m)显著大于 AB型个体(10.86 c m)。
3 结论与讨论
3.1 PLIN基因多态性
PLIN基因编码的perilipin是一种脂滴相关磷蛋白,研究表明,perilipin磷酸化是激素敏感脂酶(HSL)从胞浆转位至脂滴表面发挥脂解作用的必要条件之一[21],在脂肪代谢中具有重要作用[6,7]。
Vykoukaloval等[14]对猪PLIN 基因多态性进行了研究,在外显子2、3、5、6和7中发现了8个突变、3种基因型,而本研究在外显子3、4、6、8中都检测出了3种基因型,在外显子5中检测出两种基因型,且除外显子5多态信息含量极低,其他外显子在两个品种均呈中度遗传多态。比较而言,绵羊PLIN基因多态比较丰富,为绵羊良种的选育提供了一定的选择空间。樊月圆等[15]检测了秦川牛PLIN基因第3、4外显子多态性,每个外显子都发现了3种基因型,与本研究结果相近。这是否说明牛羊亲缘关系相近,PLIN基因在该二畜种中的遗传变异相似,尚待进一步研究。
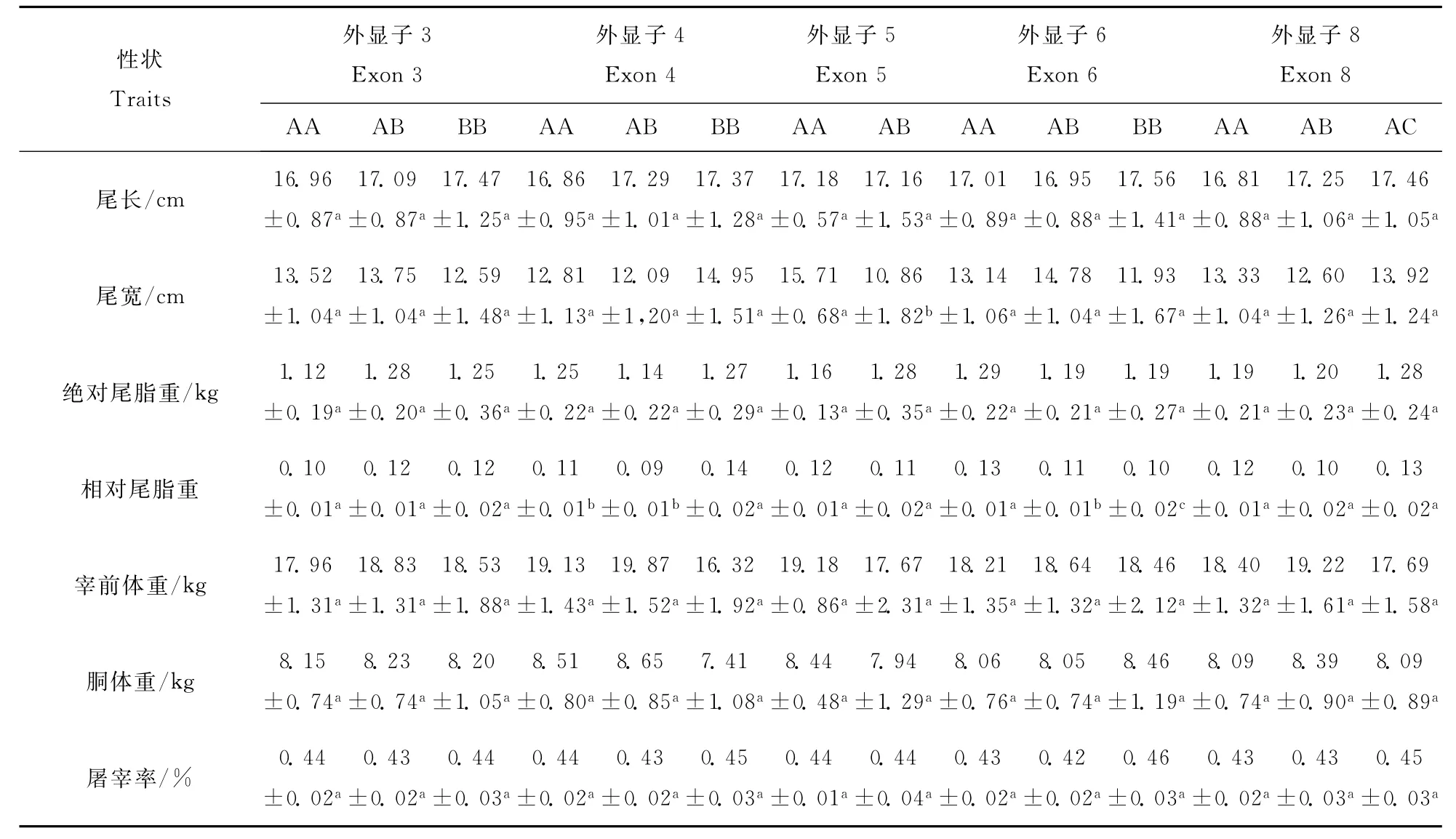
表5 PLIN基因多态性和尾形和屠宰性状的关联分析Table 5 Associations bet ween the poly morphism of PLl N gene and tail and slaughter traits
3.2 两个绵羊品种的遗传差异
广灵大尾羊主要分布在山西省的雁北地区,以产肉为主,肉用性能好,是蒙古羊进入农区后经过长期选择、闭锁繁育而形成的[16];小尾寒羊主要分布于山东省的西南地区,主要特点是繁殖力高,但肉用性能一般,是蒙古羊进入自然环境较好的中原地区,经过长期的自然和人工选择而成[17],因此品种间性状和遗传差异较大。本研究中,除屠宰率外,所有其他性状均是广灵大尾羊显著地大于小尾寒羊,进一步揭示了两品种间的性能差异。
外显子3在小尾寒羊中处于遗传不平衡状态,而在广灵大尾羊中则平衡,并且PLIN基因外显子3的基因型频率品种间差异显著(P<0.05),这也进一步证明了品种间遗传差异的存在。广灵大尾羊和小尾寒羊都是外显子5的纯合度最高,各外显子的有效等位基因数品种间差异不显著,且除外显子3外,其他外显子的基因型频率无品种差异。这一方面表明起源相同的两个绵羊品种在遗传上具有一致性,另一方面也说明了基因的保守性。
3.3 PLIN基因多态性对绵羊尾形和屠宰性状的遗传效应
动物脂肪的沉积主要取决于脂肪细胞的体积与数量[22],而PLIN基因编码的perilipin对脂肪代谢具有重要的调控作用[2,3],可以作为改善脂肪沉积的候选基因。人类以及畜禽上都发现了多个SNP位点,对人的11482G>A位点研究较多,且该位点主要与肥胖和血脂指标相关[23]。赵小玲研究发现的3个SNP位点分别对肌内脂肪含量、胸肌重和胴体重有显著地遗传效应[24]。本研究中PLIN基因外显子4和6的多态性对绵羊相对尾脂重影响显著,外显子5的AA型个体的尾宽极显著地大于AB型个体(P<0.01),进一步说明了PLIN基因在绵羊脂肪沉积中的功能。与樊月圆等[15]研究结果一致,该基因可以作为影响胴体和肉质的候选基因,指导肉用绵羊的育种工作。
另外,本研究发现外显子5和6中等位基因A都为群体中的优势等位基因,且含有A等位基因的个体,其相对尾脂重和尾宽显著大于其他个体,表明这样的个体脂肪沉积能力显著优于其他个体。由此,我们推测等位基因A可能影响绵羊的胴体和肉质性状,其结果还需进一步研究验证。
综上所述,PLIN基因多态性对小尾寒羊和广灵大尾羊的尾宽和相对尾脂重有显著影响,具有沉积脂肪的功能,可以作为改善绵羊脂肪沉积能力、提高肉质性状的候选基因。有关结果可以指导肉用绵羊的遗传改良,加快良种培育。
[1]Greenberg A S,Egan J J,Wek S A,etal.Perilipin,a major hor monally regulated adipocyte-specific phosphoprotein associated with the periphery of lipid storage droplets[J].J Biol Chem,1991,266:11341-11346.
[2]Zhang H H,Souza S C,Muliro K V,etal.Lipase-selective f unctional domains of perilipin A differentially regulate constitutive and protein kinase A-sti mulated lipolysis[J].J Biol Chem,2003,278:51535-51542.
[3]Miyoshi H,Perfield J W,Souza S C,etal.Contr ol of adipose triglyceride lipase action by serine 517 of perilipin A globally regulates protein kinase A-sti mulated lipolysis in adipocytes[J].J Biol Chem,2007,282:996-1002.
[4]Nishiu J,Tanaka T,Nakamura Y.Isolation and chr o moso mal mapping of the hu man ho molog of perilipin(PLIN),a rat adipose tissuespecific gene,by differential display met hod[J].Geno mics,1998,48:254-257.
[5]Lu X,Gr uia-Gray J,Copeland N G,etal.The murine perilipin gene:the lipid dr oplet-associated perilipins derive fr o m tissue-specific,mRNA splice variants and define a gene fa mily of ancient origin[J].Mamm Geno me,2001,12:741-749.
[6]Souza S C,Vargas L M,Ya ma moto M T,etal.Overexpression of perilipin A and B blocks the ability of tu mor necrosis factorαto increase lipolysis in 3 T3-L1 adipocytes[J].J Biol Chem,1998,273:24665-24669.
[7]Brasaemle D L,Rubin B,Harten I A,etal.Perilipin A increases triacylglycer ol st orage by decreasing the rate of triacylglycerol hydr olysis[J].J Biol Che m,2000,275:38486-38493.
[8]Ser vet nick D A,Brasaemle D L,Gr uia-Gray J,etal.Perilipins are associated wit h cholesteryl ester dr oplets in steroidogenic adrenal cortical and Leydig cells[J].J Biol Chem,1995,270:16970-16973.
[9]Tansey J T,Sztalryd C,Gr uia-Gray J,etal.Perilipin ablation results in a lean mouse wit h aberrant adipocyte lipolysis,enhanced leptin production,and resistance t o diet-inducedobesity[J].Proc Natl Acad Sci USA,2001,98:6494-6499.
[10]Ker n P A,Di Gregorio G,Lu T,etal.Perilipin expression in hu man adipose tissue is elevated wit h obesity[J].J Clin Endocrinol Metab,2004,89:1352-1358.
[11]Qi L,Corella D,SorlíJ V,etal.Genetic variation at the perilipin(PLIN)locus is associated wit h obesit y-related phenot ypes in White women[J].Clin Genet,2004,66:299-310.
[12]Qi L,Haiqing S,Larson I,etal.Gender-specific association of a perilipin gene haplotype wit h obesity risk in a White population[J].Obes Res,2004,12:1758-1765.
[13]Yan W,Chen S,Huang J,etal.Poly mor phisms in PLIN and hypertension combined wit h obesity and lipid profiles in Han Chinese[J].Obes Res,2004,12:1733-1737.
[14]Vykoukalová1 Z,Knoll A,ˇCepica S.Porcine perilipin(PLIN)gene:structure,poly mor phis m and association st udy in Large White pigs[J].J Ani m Sci,2009,54:359-364.
[15]樊月圆,昝林森,王洪宝,等.PLIN基因多态性与秦川牛胴体、肉质性状的相关性研究[J].畜牧兽医学报,2010,41:268-273.
[16]吕效吾.山西省家畜家禽品种志 [M].上海:华东师范大学出版社,1984.
[17]王建民,秦孜娟,曲绪仙,等.山东小尾寒羊种质特性及利用途径的研究进展(上)[J].草食家畜,1997,(3):6-10.
[18]Excoffier L,Lischer HE.Arlequin suite ver 3.5:A new series of progra ms to perfor m population genetics analyses under Linux and Windows[J].Mol Ecol Resour,2010,10:564-567.
[19]Yeh FC,Boyle T,Yang R.POPGENE version 1.31 Microsoft windo w based freeware for population genetic analysis[M].Univesity of Al berta,Ed mont on,1999.
[20]Botstein D,White R L,Skol nick M,etal.Constr uction of a genetic linkage map in man using restriction frag ment lengt h poly morphis ms[J].Am J Hu m Genet,1980,32:314-331.
[21]Sztalr yd C,Xu G,Dor ward H,etal.Perilipin A is essential for the translocation of hor mone-sensitive lipase during lipolytic activation[J].J Cell Biol,2003,161:1093-1103.
[22]Nishi mura T,Hattori A,Takahashi K.Str uct ural changes in intra muscular connective tissue during the fattening of Japanese black cattle:effect of mar bling on beef tenderization[J].J Ani m Sci,1999,77:93-104.
[23]Mottagui-Tabar S,Rydén M,Löf gren P,etal.Evidence for an important r ole of perilipin in the regulation of hu man adipocyte lipolysis[J].Diabet ologia,2003,46:789-797.
[24]赵小玲.鸡ADFP和PLIN基因与脂肪组织生长发育关系的遗传学研究 [D].雅安:四川农业大学,2008.

