槲皮素对小鼠1-细胞胚胎体外发育能力的影响
贾秀芬
(聊城职业技术学院医学院,山东 聊城 252000)
槲皮素对小鼠1-细胞胚胎体外发育能力的影响
贾秀芬
(聊城职业技术学院医学院,山东 聊城 252000)
目的 为完善小鼠早期胚胎体外培养体系,了解槲皮素对小鼠1-细胞胚胎体外发育的影响。方法 以CZB为基础培养液,添加不同浓度(500、50、5、1、0.5、0.2、0.1 μm)的槲皮素作为试验组,添加等量二甲基亚砜(DMSO)作为对照组,观察不同浓度槲皮素对胚胎发育到囊胚各阶段的影响。结果 当槲皮素浓度超过50 μm时,对胚胎发育有毒性效应;0.1~1 μm浓度槲皮素对胚胎发育有促进作用,特别是0.5 μm槲皮素能明显提高胚胎的囊胚形成率。结论 0.5 μm槲皮素能促进小鼠早期胚胎的体外发育。
槲皮素;细胞胚胎;体外发育
在体内,胚胎发育过程中会通过各种酶促反应和代谢途径产生内源性的活性氧簇(ROS),即在有氧代谢过程中会产生ROS。不同阶段产生不同量的ROS,而且胚胎发育的各阶段对ROS的敏感性也不同,如果不能迅速、有效地去除,ROS能破坏一系列的大分子物质,甚至导致胚胎的死亡。但体内存在着有效去除ROS的酶促机制和非酶促机制。包括ROS清除酶像超氧化物歧化酶、过氧化氢酶、过氧化物酶,以及一些小分子量物质如谷胱甘肽、维生素E、维生素C、尿酸等。而在体外不存在这样的保护机制,因此,笔者在体外胚胎培养液中加入抗氧化剂——槲皮素,观察它对胚胎发育的影响。
槲皮素(quercetin)属类黄酮物质中的黄酮醇,它是人类膳食中常见的类黄酮物质,也是一些中草药的有效成分。据文献报道,槲皮素在体外可通过直接清除活性氧自由基、螯合金属离子、抑制LDL及DNA氧化损伤,发挥其抗氧化作用[1]。在体内,槲皮素、维生素C灌胃后大鼠外周血总抗氧化能力明显上升且程度相近,而维生素E灌胃前后外周血总抗氧化能力无明显变化。在体外,槲皮素被细胞胚胎吸收后抗氧化能力强于传统的抗氧化剂维生素C、维生素E[2]。同样是抗氧化剂,考虑到维生素E和维生素C对胚胎发育的影响不大,故寻找槲皮素促进胚胎发育的最佳浓度,以提高胚胎体外发育能力。
1 材料和方法
1.1 实验动物
为昆明系性成熟小鼠,购自哈尔滨医科大学第三临床医学院实验动物中心(动物质量合格证号:医动字第09-2-1号)。小鼠饲养采用自由取食和饮水方式,人工控温22~24℃,光照周期为12 h光照、12 h黑暗。
1.2 主要试剂
所用试剂除孕马血清促性腺激素(PMSG)和人绒毛膜促性腺激素(HCG)购自宁波第二激素厂外,其余均购自Sigma公司,CZB培养液本实验室自配。
1.3 实验方法
1.3.1 超排和胚胎的收集 雌性小鼠腹腔注射PMSG7.5 IU/只,48 h后腹腔注射HCG7.5 IU/只,进行超数排卵[3],并与雄鼠1∶1合笼,注射HCG 21~24 h后将见栓鼠采用脱颈法处死,体视显微镜在Hepes-CZB操作液中划开输卵管壶腹部,收集受精卵。被颗粒细胞包围的受精卵,用0.1%的透明质酸酶处理,再用Hepes-CZB洗3次后进行培养。
1.3.2 实验分组 因槲皮素为不溶于水的抗氧化剂,故将其溶于二甲基亚砜中,使二甲基亚砜浓度保持在1/1 000,再加入CZB 培养液中,使槲皮素浓度分别达到 500、50、5、1、0.5、0.2、0.1 μm作为试验组,对照组则以加入等量二甲基亚砜作对照,基础培养液CZB则为空白组。
1.3.3 胚胎培养 将20 μl微滴覆以石蜡油,在5%CO2、95%空气、37℃饱和湿度的CO2培养箱中平衡4~5 h,每滴最多培养10枚胚胎。每隔24 h观察一次,记录胚胎发育情况,直至144 h结束。
1.3.4 统计学处理 采用SPSS 13.0软件对实验数据进行χ2检验,P<0.05为有显著性差异。
2 结果与分析(见表1)
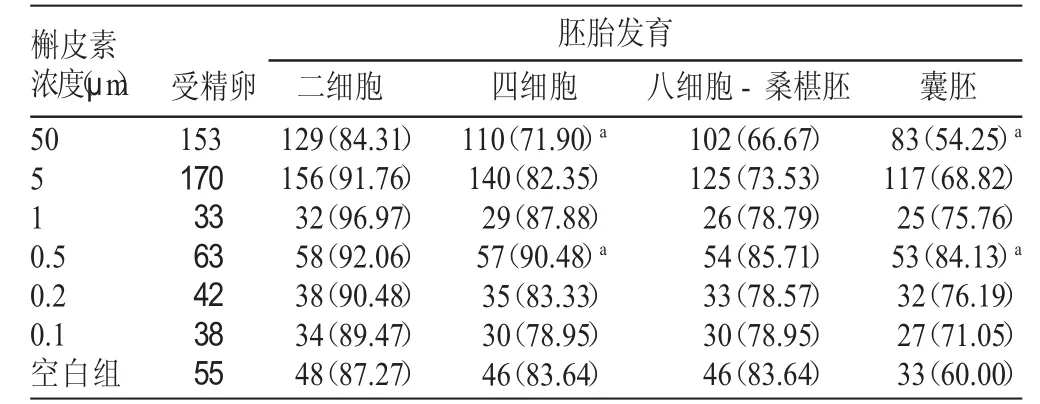
表1 不同浓度槲皮素对1-细胞胚胎体外发育的影响[n(%)]
由表1可知,在发育到二细胞时,除槲皮素浓度为50 μm的发育率低于空白组外,其余试验组各浓度胚胎发育率均高于空白组,以槲皮素浓度为1 μm发育率最高,然而无显著性差异。四细胞发育率以1 μm和0.5 μm浓度发良率较高,然而无显著性差异。50 μm和0.5μm浓度的四细胞发育率比较有显著性差异。八细胞-桑椹胚发育率以0.5 μm浓度最高,但无显著性差异。囊胚发育率除50 μm浓度低于空白组外,其余各浓度胚胎发育率均高于空白组,以0.5 μm浓度最高,同空白组和试验组50 μm浓度比较有显著性差异。500 μm浓度的槲皮素处理的受精卵,停止在1-细胞不发育,而且细胞膜出现许多小泡(见图1),显示了该药的毒性效应。空白组包括正常受精卵,二细胞胚胎,四细胞胚胎(×100),八细胞胚胎-桑葚胚及囊胚(正在孵出的及已经孵出的,×400)胚胎发育的各个时期见图2。
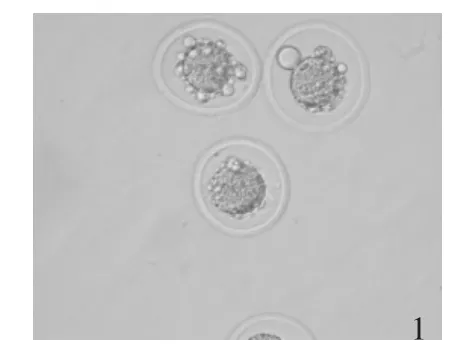
图1 500 μm浓度的槲皮素处理的受精卵细胞膜(×300)
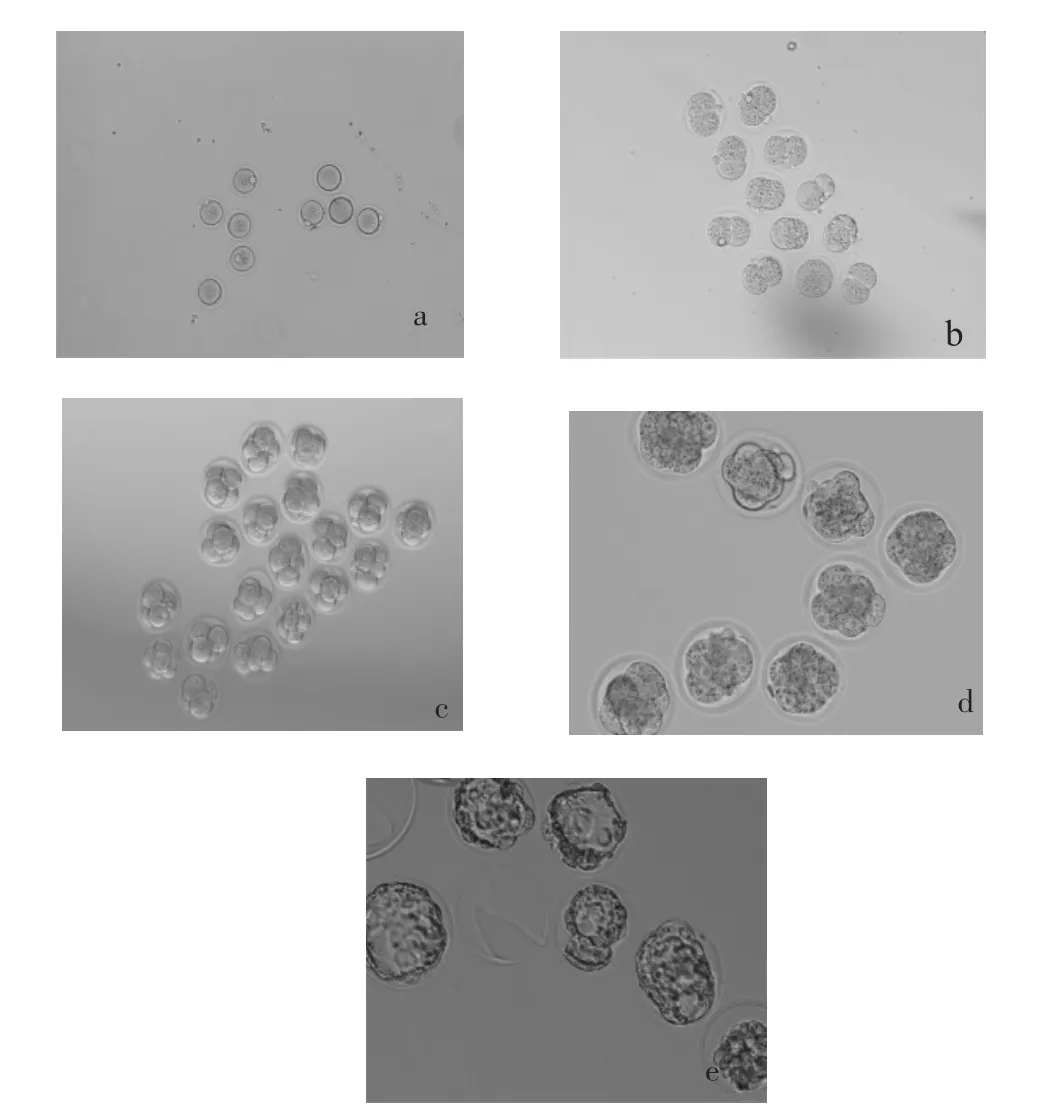
图2 空白组胚胎发育的不同阶段
3 讨论
通过研究体内发育的小鼠卵母细胞及早期胚胎中H2O2含量发现:未受精的卵母细胞中H2O2水平较低,胚胎发育各阶段的早期胚胎细胞中H2O2水平高于以后发育的任何时期的水平,离体培养的二细胞中期小鼠胚胎H2O2水平上升,以后高居不下[4]。本实验在CZB培养液中添加不同浓度的槲皮素观察对受精卵体外发育的影响。浓度选择在50 μm以下,是因为有研究[5]表明,该浓度以上对细胞有毒性效应。通过本试验结果发现槲皮素在0.1~1 μm浓度段对胚胎发育有明显促进作用,特别是0.5 μm浓度,囊胚发育率较高,表明抗氧化能力最佳。这一实验结果与许多实验结果一致。同时试验组四细胞发育率同空白组相比有显著性差异,说明槲皮素的抗氧化作用主要在早期胚胎发育中起作用,特别是对二细胞、四细胞发育的影响,这可能与二细胞的发育阻滞相关联。在八细胞-桑椹胚发育率上,仅0.5 μm浓度表现为促进作用,其余试验组浓度均低于空白组,到囊胚发育率上试验组各浓度(50 μm浓度除外)却又高于空白组,这一现象有待进一步研究。尽管高浓度槲皮素不利于胚胎发育,本实验还是选择了500 μm浓度观察对胚胎的毒性效应。在500 μm时,发现受精卵停止在1-细胞期,且细胞膜起泡。如Yuling[6]等报道,以2,4-D作为活性氧的来源,精子细胞数目及其活力明显降低,精子细胞的形态也发生改变。当同时加入槲皮素时,结果发生明显改变:精子细胞数目明显增加,较多细胞保持了质膜的完整。说明槲皮素通过减少细胞内活性氧水平及质膜过氧化作用发挥其抗氧化能力。据报道[7],槲皮素能抑制H2O2诱导胰岛细胞凋亡,保持细胞形态正常,其原理是槲皮素主要清除胞内异常增多的自由基。周蕾等[8]报道,槲皮素对柔红霉素致大鼠心肌细胞损伤的保护作用其机理可能与抗氧化作用有关。陈中华等[9]报道,槲皮素对紫外线损伤NIH3T3细胞的保护作用是通过清除细胞内的活性氧自由基,维持细胞的线粒体膜电位,抑制细胞凋亡。曹文军等[10]证实,槲皮素可显著提高体内一种重要的清除自由基的酶GSH-Px活性,从而保护缺血再灌注对心肌损伤。所有这些文献,都充分证明了槲皮素对细胞的保护作用与其抗氧化特性相关,与本实验结果一致,从而为槲皮素应用于胚胎体外培养提供了依据。目前,胚胎体外培养体系虽有所改善,但至今仍不是最好的培养条件,不能代替生殖管道内的有利条件。尽管哺乳动物的胚胎有明显的可塑性,能在很大范围的培养条件下形成囊胚,然而亚培养条件可能不仅会破坏植入前胚胎的基因表达模式,而且会影响出生后的发育,甚至后代的生长和生理。自然界中天然的槲皮素为胚胎培养体系的完善提供了广阔前景,故需将槲皮素对胚胎发育的促进机制进行详尽的探讨。
[1]苏俊锋,郭长江.食物黄酮槲皮素的抗氧化作用[J].解放军预防医学杂志,2001,19(3):229~231.
[2]苏俊锋,郭长江,李云峰,等.槲皮素体内外抗氧化作用的比较研究[J].Chin J Appl Physiol,2002,18(4):382~386.
[3]A纳吉,M格斯膝斯坦,K文特斯腾,等.小鼠胚胎操作实验手册[M].北京:科学出版社,2004.
[4]Nasr-Esfahani M H,Johnson M H,Aitken J R,et al.Hydrogen peroxide levels in mouse oocytes and early cleavage stage embryos developed in vitro or in vivo[J].Development,2000,109(2):501~507.
[5]单智焱,刘慧雯.Quercetin对HepG2细胞的抑制作用及PDGFR-β的表达[J].哈尔滨医科大学学报,2005,39(1):38~40.
[6]Yuling M I,Caiqiao ,Kazuyoshi.Quercetin protects spermatogonial cells from 2,4-D-Induced oxidative damage in embryonic chickens[J].Journal of Reproduction and Development,2007,53(4):749~754.
[7]金永亮,叶春玲,任省华,等.槲皮素对 H2O2诱导的胰岛RIN-mβ细胞凋亡的影响[J].中成药,2008,30(5):767~769.
[8]周蕾,赖永洪.槲皮素对柔红霉素致大鼠心肌细胞损伤的保护作用[J].实用儿科临床杂志,2006,21(13):855~871.
[9]陈中华,张秀珍.槲皮素对紫外线损伤NIH3T3细胞的保护作用研究[J].生命科学仪器,2008,6(5):27~29.
[10]曹文军,陈瑞芬,刘国贞.槲皮素对缺血再灌注大鼠心肌损伤的保护作用[J].首都医科大学学报,2004,25(3):311~313.
R965.2
B
1671-1246(2012)07-0114-02

