油菜素内酯对干旱胁迫下辣椒叶片活性氧代谢的影响
胡文海,闫小红,詹秀花,曾志锋,曾守鑫
油菜素内酯对干旱胁迫下辣椒叶片活性氧代谢的影响
*胡文海1,2,闫小红1,2,詹秀花3,曾志锋1,曾守鑫1
(1. 井冈山大学生命科学学院,江西,吉安 343009;2. 江西省生物多样性与生态工程重点实验室,江西,吉安 343009;3. 江西省茶叶学校,江西,婺源 333200)
以辣椒品种湘研6号为材料,研究了干旱胁迫下0.05 mg/L的油菜素内酯(BR)对辣椒叶片活性氧代谢的影响。研究表明,干旱胁迫显著抑制了辣椒叶片净光合速率(Pn)、PSII光合电子传递量子效率(ΦPSII)和光化学猝灭系数(qP),虽然干旱胁迫诱导了非光化学猝灭系数(NPQ)以及超氧化物歧化酶(SOD)、抗坏血酸过氧化物酶(APX)、过氧化氢酶(CAT)和过氧化物酶(POD)的酶活性,但仍导致叶片PSII最大光化学效率(Fv/Fm)的下降和过氧化氢(H2O2)和丙二醛(MDA)含量的大幅上升;油菜素内酯有效地促进了干旱胁迫下辣椒叶片Pn、ΦPSII、qP和NPQ的增强,也显著增强了SOD、APX、CAT和POD的酶活性,从而减轻了干旱胁迫所导致的Fv/Fm的下降和H2O2和MDA含量的增加。结果表明,油菜素内酯可通过增强碳同化和热耗散能力,并诱导抗氧化酶活性的增加,以促进作物的抗旱性。
辣椒;油菜素内酯;抗旱性;活性氧代谢
干旱胁迫是影响作物产量与品质的主要逆境因子。干旱胁迫常引起光合作用的下降,并导致细胞内活性氧(ROS)的大量产生[1]。然而植物在长期进化过程中也形成系统的活性氧防御与清除机制,以减少活性氧的产生与积累[2-3]。叶绿体是植物细胞中活性氧产生的主要源头之一,研究表明逆境胁迫下光合电子传递中的热耗散作用和光合碳同化可有效地减少叶绿体内活性氧的产生[4]。同时,植物也进化出了一整套活性氧清除酶系统,植物细胞中主要的抗氧化酶有超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、抗坏血酸过氧化物酶(APX)和过氧化物酶(POD)[5-6]。油菜素内酯(BR)作为一种新型的植物激素,其增强作物抗性的研究已受到广泛关注。研究表明油菜素内酯可显著增强作物的耐冷性[7]、抗盐性[8]和抗旱性[9-10]等,同时油菜素内酯也能促进植物光合作用的进行[11]。然而对于干旱胁迫下油菜素内酯对于辣椒叶片光合作用和光合电子传递的影响,及其与活性氧代谢之间的关系方面的研究较少,为此我们以夏季常见蔬菜作物辣椒为材料,研究油菜素内酯对干旱胁迫下辣椒光合作用及活性氧代谢的影响,以期探索油菜素内酯增强辣椒抗旱性的作用机制。
1 材料与方法
供试辣椒品种为湘研6号。试验于井冈山大学生命科学学院生物园内进行。挑选籽粒饱满的种子播种于草炭土:河沙(1:1,V:V)的基质中,保持土壤湿润,待70%以上种子出苗后进行正常水肥管理,营养液为1/2日本园试营养液,幼苗3-4片真叶时移栽到高度为30 cm×30 cm的塑料花盆中,基质同播种基质,每盆1株,土壤含水量为80%以上,保持充足的水分和养料供应。当幼苗7-8片真叶时,选择长势好且无病虫害的幼苗进行以下四处理:(1)对照(CK):保持土壤相对含水量80%以上,喷施含有与配制BR相同浓度酒精的蒸馏水;(2)BR处理(CK+BR):保持土壤相对含水量80%,处理前在叶面均匀喷施0.05 mg/L BR溶液;(3)干旱处理(D):保持土壤相对含水量40%~50%;(4)BR与干旱共同处理(D+BR):保持土壤相对含水量40%~50%,处理前在叶面均匀喷施0.05 mg/L BR溶液。于处理第5 d选择植株上部成熟叶片测定其净光合速率和叶绿素荧光参数,并取样测定其过氧化氢和丙二醛含量和抗氧化酶活性。实验5次重复。
用Ciras-1型光合仪在600 µmol·m-2·s-1光强下测定叶片的净光合速率(Pn)。用FMS2型叶绿素荧光仪测定叶绿素荧光参数,叶片暗适应30 min后,测定暗适应下的初始荧光Fo和最大荧光Fm,随后打开光化光(600 µmol·m-2·s-1)照射10 min后测定光适应下的稳态荧光Fs和光下最大荧光Fm’,并计算暗适应下PSII最大光化学效率Fv/Fm=(Fm-Fo)/Fm,PSII光合电子传递量子效率ΦPSII=(Fm’-Fs)/Fm’,光化学猝灭系数qP=(Fm’-Fs)/(Fm’-Fo’),非光化学猝灭系数NPQ=1-Fm’/Fm。
H2O2含量的测定按Zhou等的方法[12]进行测定。MDA含量依据Hu等的方法[13]测定。SOD活性按Giannopolitis和Ries的方法[14]测定,酶活性采用抑制NBT光化学反应50%为一个酶活性单位表示。采用Nakano和Asada的方法[15]测定APX的活性。采取Cakmak的方法[16]测定POD和CAT活性。
数据统计采用SPSS 11.5软件进行方差分析,差异显著性采用最小显著性差异(LSD)检验在< 0.05水平上进行分析。图与表中不同字母表示在5%水平上处理间具有显著性差异。
2 结果与分析
2.1 油菜素内酯对干旱胁迫下辣椒叶片净光合速率和叶绿素荧光参数的影响
表1显示,干旱胁迫5d导致辣椒叶片净光合速率的显著下降,BR处理可显著促进正常条件下辣椒叶片净光合速率的上升,也可有效缓解干旱胁迫导致的净光合速率下降。正常水分条件下,油菜素内酯并未引辣椒叶片Fv/Fm和NPQ的变化,但对ΦPSII和qP有促进作用;干旱胁迫导致Fv/Fm、ΦPSII和qP的显著下降,但诱导了NPQ的明显上升;BR处理则可减缓干旱胁迫下辣椒叶片Fv/Fm、ΦPSII和qP的下降,并显著促进了NPQ的增加。

表1 油菜素内酯对干旱胁迫下辣椒叶片净光合速率和叶绿素荧光参数的影响
2.2 油菜素内酯对干旱胁迫下辣椒叶片膜质过氧化的影响
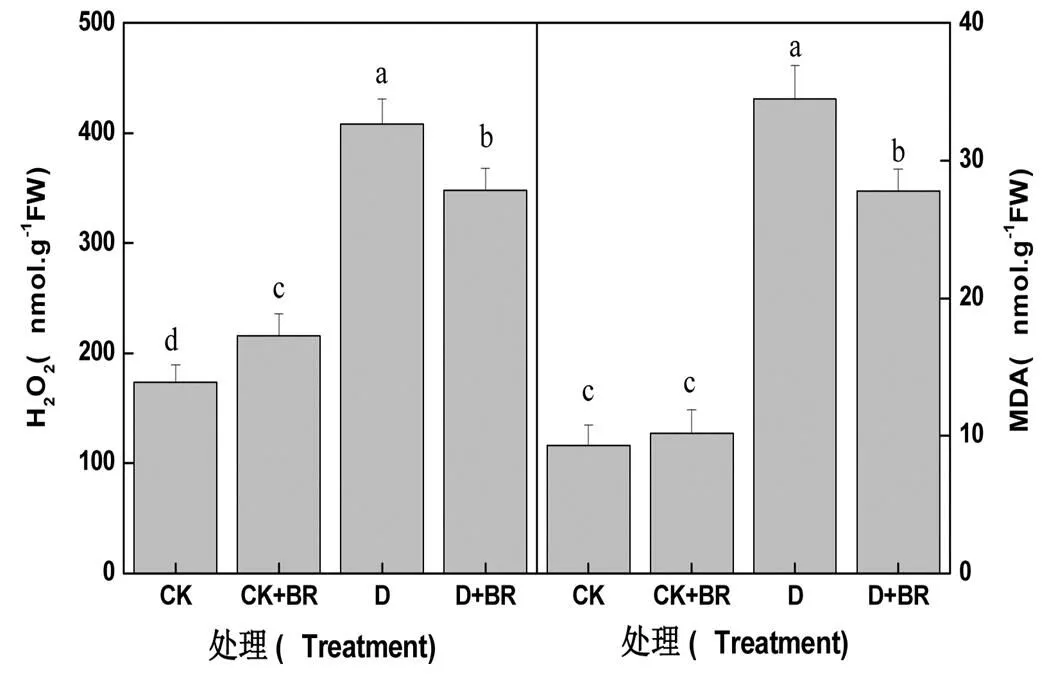
图1 油菜素内酯对干旱胁迫下辣椒叶片H2O2和MDA含量的影响
油菜素内酯对干旱胁迫下辣椒叶片膜质过氧化的影响如图1所示。在正常水分条件下,油菜素内酯并未引起辣椒叶片MDA含量的增加,但叶片中H2O2含量则稍有上升;干旱胁迫导致辣椒叶片H2O2和MDA含量的显著增加,而油菜素内酯则可减轻干旱胁迫下辣椒叶片的H2O2和MDA含量。
2.3 BRs预处理对干旱胁迫下辣椒叶片中抗氧化酶活性的影响
由图2可知,正常水分条件下,油菜素内酯并未引起辣椒叶片中SOD活性的增加,但APX、CAT和POD的活性则稍有增加。干旱胁迫诱导了SOD、APX、POD和CAT活性的显著上升。与干旱胁迫植株相比,虽然BR处理后的辣椒叶片在干旱胁迫下其SOD、APX和POD活性没有差异,但CAT的活性高于干旱胁迫下辣椒叶片中相应酶的活性。

图2 油菜素内酯对干旱胁迫下辣椒叶片SOD,APX,CAT和POD活性的影响
3 讨论
植物在需氧代谢过程中不可避免地会产生活性氧,但只有当植物遭受逆境胁迫时,活性氧的产生与清除动态平衡才会遭到破坏,并导致氧化胁迫的发生[2-3]。叶绿体是植物体内活性氧产生的主要源头之一,在正常情况下植物叶绿体吸收光能所产生的能量(NADPH)与Calvin循环中碳同化所需的能量(NADPH)之间形成动态平衡,这种能量吸收与利用之间的平衡不会对植物产生伤害。然而作物在干旱胁迫下由于光合碳同化能力的下降,最终导致对ATP和NADPH需求的减少,使得叶绿体内吸收光能利用下降,引起叶绿体内活性氧产率的上升[4]。研究表明,干旱胁迫显著降低了辣椒叶片Pn、ΦPSII和qP,虽然干旱胁迫诱导了NPQ的上升和SOD、APX、CAT和POD四种抗氧化酶活性的增强(表1、图2),最终导致了叶片Fv/Fm的下降和H2O2和MDA含量的大幅上升(表1、图1)。这说明干旱胁迫导致光合碳同化作用的下降,使得叶片吸收光能的利用能力下降,虽然干旱胁迫诱导了辣椒叶片热耗散能力和抗氧化酶活性的增强,但仍导致了叶片光抑制程度的增加,并促进了叶片中活性氧产率的上升和细胞膜质过氧化程度的加剧。
油菜素内酯具有增强作物对逆境的抗性作用[17]。研究表明油菜素内酯可促进干旱胁迫下大豆和文冠果叶片抗氧化酶活性,以增强作物的抗旱性[18-19],吴晓丽等的研究[20]也表明油菜素内酯可增强干旱胁迫下花椰菜幼苗叶片的光合作用和抗氧化能力,但相关研究较少考虑活性氧产生与清除平衡机制之间的关系。我们的研究表明油菜素内酯处理显著地减缓了干旱胁迫所导致的叶片Fv/Fm的下降和H2O2及MDA含量的上升(表1、图1),与此同时油菜素内酯有效地促进干旱胁迫下辣椒叶片Pn、ΦPSII和qP的进行和NPQ的增强(表1),也显著增强了SOD、APX、CAT和POD四种抗氧化酶活性(图2)。这表明油菜素内酯可通过增强干旱胁迫下辣椒光合碳同化能力,以促进叶片吸收光能的利用,同时还能通过增强热耗散能力,从两方面减少光合电子传递过程中过剩电子的产生,同时还能通过诱导叶片中抗氧化酶活性的增强,最终减少了活性氧的产生与积累。我们在研究中还发现在正常水分条件下,BR处理可诱导叶片中H2O2含量的微量上升和APX、CAT和POD三种H2O2清除酶的活性的增强,这表明油菜素内酯可能是通过诱导信号H2O2的最终诱导细胞内抗氧化酶活性的增强[21]。
综上所述,干旱胁迫抑制了辣椒叶片光合碳同化能力,引起光合电子传递受阻,促进了叶片中活性氧的产生与积累;但干旱胁迫也可诱导作物叶片热耗散能力和抗氧化酶活性的增强,以减轻胁迫对作物的伤害;BR具有增强作物耐旱性的作用,其可能的作用机制为BR可通过增强碳同化和热耗散能力,以减少光合电子传递过程中过剩电子的产生,BR也可通过诱导活性氧清除酶活性的增强,以减少活性氧的积累,增强作物对干旱胁迫的耐性。并且BR诱导抗氧化酶活性的增强可能是基于信号分子H2O2对抗氧化酶的诱导作用。
[1] Hu W H, Xiao Y A, Zeng J J, et al. Photosynthesis, respiration and antioxidant enzymes in pepper leaves under drought and heat stresses [J]. Biologia Plantarum, 2010, 54:761-765.
[2] Asada K. Ascorbate peroxidase: a hydrogen peroxide- scavenging enzyme in plants [J]. Physiologia Plantarm, 1992, 85:235-241.
[3] Neill S J, Desikan R, Clarke A, et al. Hydrogen peroxide and nitric oxide as signaling molecules in plants [J]. Journal of Experimental Botany, 2002, 53: 237-247.
[4] Ort D R, Baker N R. A photoprotective role for O2as an alternative electron sink in photosynthesis [J]. Current Opinion in Plant Biology, 2002, 5: 193-198.
[5] Alscher R G, Donahue J L, Cramer C L. Reactive oxygen species and antioxidants: relationships in green cells [J]. Physiologia Plantarum, 1997, 100: 224-233.
[6] Mittler R. Oxidative stress, antioxidants and stress tolerance [J]. Trends in Plant Science, 2002, 7: 405-410.
[7] 白洁,蒋卫杰,余宏军,等.外源ABA、Put和BR对亚适温条件下番茄幼苗叶片保护酶活性的影响[J].中国农学通报,2007,23(6):317-320.
[8] 尚庆茂,宋士清,张志刚,等.外源BR诱导黄瓜幼苗的抗盐性[J].中国农业科学,2006,39(9):1872-1877.
[9] 李凯荣,李会科,王健.天然油菜素内酯对红富士苹果抗旱增产效应的研究[J].园艺学报,2006,33(5):1059-1062.
[10] 胡文海,闫小红,陈金德,等.油菜素内酯对干旱胁迫下辣椒开花结果的影响[J].井冈山大学学报,2011,32(5): 46-50.
[11] Yu J Q, Huang L F, Hu W H, et al. A role of brassinosteroids in the regulation of photosynthesis in Cucumis sativus [J]. Journal of Experimental Botany, 2004, 55:1135-1143.
[12] Zhou Y H, Yu J Q, Huang L F, et al. The relationship between CO2assimilation, photosynthetic electron transport and water-water cycle in chill-exposed cucumber leaves under low light and subsequent recovery [J]. Plant, Cell and Environment, 2004, 27: 1503-1514.
[13] Hu W H, Shi K, Song X S, et al. Different effects of chilling on respiration in leaves and roots of cucumber (Cucumis sativus) [J]. Plant Physiology and Biochemistry, 2006, 44: 837-843.
[14] Giannopolitis C N, Ries S K. Superoxide dismutases occurrence in higher plant [J]. Plant Physiology, 1997, 59: 309-314.
[15] Nakano Y, Asada K. Hydrogen peroxide is scavenged by ascorbate-specific peroxidase in spinach chloroplasts [J]. Plant and Cell Physiology, 1981, 22: 867-880.
[16] Cakmak I, Horst W J. Effect of aluminium on lipid peroxidation, uperoxide dismutase, atalase, nd peroxidase activities in root tips of soybean (Glycine max)[J]. Physiologia Plantarum, 1991, 83: 463-468.
[17] Krishna P. Brassinosteroid-mediated stress responses [J]. Journal of Plant Growth Regulation, 2003, 22:289-297.
[18] 阮英慧,董守坤,刘丽群,等.干旱胁迫下油菜素内酯对大豆花期生理特性的影响[J].作物杂志,2011(6):33-37.
[19] 冯朝红,李凯荣,张鹏文,等.干旱胁迫下油菜素内酯对文冠果苗木抗氧化酶活性和抗氧化剂含量的影响[J].干旱地区农业研究,2011,26(4):152-155.
[20] 吴晓丽,罗立津,黄丽岚,等.水杨酸和油菜素内酯对花椰菜幼苗生长及抗旱性的影响[J].干旱地区农业研究,2011,29(2):168-172.
[21] Xia X J. Zhou Y H, Ding J, et al. Induction of systemic stress tolerance by brassinosteroid in Cucumis sativus [J]. New Phytologist, 2011, 191:706-720.
EFFECTS OF BRASSINOLIDE ON ACTIVE OXYGEN METABOLISM IN PEPPER LEAVES UNDER DROUGHT STRESS
*HU Wen-hai1,2, YAN Xiao-hong1,2, ZAN Xiu-hua3, ZENG Zi-feng1, ZENG Sou-xin1
(1. School of Life Sciences, Jinggangshan University, Ji’an, Jiangxi, 343009, China; 2. Key Laboratory for Biodiversity Science and Ecological Engineering, Ji’an, Jiangxi , 343009, China; 3. Jiangxi Tea School, Wuyuan, Jiangxi 333200, China)
In order to investigate the effects of brassinosteroid (BR) on active oxygen metabolism in pepper leave under drought stress, the pepper cultivar, Xiangyan No. 6 was used as the material. In this study, drought significantly inhibited Pn, ΦPSII, qP, however, induced the increase of NPQ and activities of antioxidant enzymes (SOD, APX, CAT and POD). Then drought deceased Fv/Fm and increased the contents of H2O2and MDA. 0.05 mg/L BR can markedly increased Fv/Fm and decreased the content of H2O2and MDA. BR significantly alleviated drought-inhibition of Pn, ΦPSII, qP and NPQ. BR also increased the activities of SOD, APX, CAT and POD. Taken together, the results suggested that BR treatment can enhance the drought-tolerance of pepper by improved CO2assimilation, dissipation of excitation energy as heat from the light harvesting complex in PSII and antioxidant enzymes activities.
L; brassinosteroid; drought tolerance; active oxygen metabolism
Q945.78
A
10.3969/j.issn.1674-8085.2012.06.009
1674-8085(2012)06-0036-04
2012-06-27;
2012-07-20
国家自然科学基金项目(30860175);教育部新世纪优秀人才支持计划项目(NCET-08-0703)
*胡文海(1973-),男,江西吉安人,教授,博士,主要从事植物生理学方面的研究(Email:huwenhai@jgsu.edu.cn);
闫小红(1977-),女,内蒙古赤峰人,实验师,硕士,主要从事植物生理学方面的研究(Email:yanxiaohong325@126.com );
詹秀花(1976-),女,江西婺源人,讲师,主要从事植物生理学方面的研究(Email:523871664@qq.com);
曾志锋(1990-),男,江西上饶人,井冈山大学生命科学学院本科生(Email:zengzhifeng@163.com);
曾守鑫(1991-),男,江西吉安人,井冈山大学生命科学学院本科生(Email:245151995@qq.com).

