旱生植物内生细菌的分离及耐旱菌株的筛选鉴定
张彦涛,生吉萍,2,葛 佳,矫玉翠,王正荣,程凡升,申 琳,*
(1.中国农业大学食品科学与营养工程学院,北京 100083;2.中国人民大学农业与农村发展学院,北京 100872)
旱生植物内生细菌的分离及耐旱菌株的筛选鉴定
张彦涛1,生吉萍1,2,葛 佳1,矫玉翠1,王正荣1,程凡升1,申 琳1,*
(1.中国农业大学食品科学与营养工程学院,北京 100083;2.中国人民大学农业与农村发展学院,北京 100872)
为筛选耐旱内生细菌,并对其进行鉴定,以典型耐旱植物为材料,分离纯化出142株内生细菌。采用液体培养基中添加聚乙二醇6000降低渗透势的方法分析内生细菌的耐旱情况。从中筛选出1株能够耐受质量浓度为60g/100mL聚乙二醇6000的内生细菌PB14。对该菌株进行形态学观察,生理生化和16S rDNA序列鉴定,判定菌株PB14为蜡样芽孢杆菌(Bacillus cereus)。
耐旱;内生细菌;鉴定;蜡样芽孢杆菌
植物内生菌(endophyte)是指在其生活史的一部分或其整个生活史,生活于健康植物组织内部、不引发植物产生明显病症的微生物,包括内生真菌、内生细菌和内生放线菌等[1]。植物内生细菌几乎存在于所有植物体内,而且同一植物体内往往含有多种内生细菌,其多样性极其广泛。到目前为止,已经分离鉴定的内生细菌已达50多个属[2],植物内生菌成为我国当前微生物研究领域的热点[3]。植物内生细菌长期生活在植物体内并与植物协同进化。一方面,植物体为其提供生长必需的能量和营养;另一方面,内生细菌又可通过自身的代谢产物或借助于信号传导作用对植物体产生影响。植物内生细菌作为植物微生态系统中的天然组成成分,其存在对加强植物对环境的适应性具有重要的意义[4-5]。
“民以食为天”,随着全球性的气候异常和生态平衡的破坏,土地日趋沙漠化,水资源短缺成为全人类面临的严重生态问题,干旱已成为制约农业生产发展的关键因素。因此,作物耐旱性的研究显得尤为重要。近年来,对于耐旱作物的研究已经取得一定的成效,主要包括杂交育种[6]、基因工程[7]等手段。由于杂交育种所需时间长,基因工程的安全性等问题,利用优良耐旱微生物来提高植物的抗旱能力越来越受到人们的关注。动植物是食品加工的基本原料,植物耐旱性能的提高可扩大植物的应用范围,实现原料新品种的开发与增产,既丰富了食品原料的多样性,又改善和提高了食品资源的品质特性等[8]。本研究从典型耐旱植物中筛选能够耐受质量浓度为60g/100mL聚乙二醇6000 (PEG6000)的内生细菌,并通过常规方法和分子生物学的方法对菌株进行鉴定,以丰富耐旱微生物资源,提高作物耐旱性能,为食品资源的改造提供一定的科学基础。
1 材料与方法
1.1 材料、试剂与培养基
白蜡、茅草、射干、罗布麻、蓼草、胡杨、怪柳采自山东省东营市永安机场;大芸、梭梭、沙果、红柳、核桃采自新疆和田;莲子采自山东青岛。
75%乙醇消毒液 德州安捷高科消毒制品有限公司;次氯酸钠溶液(有效氯含量≥8%)、聚乙二醇6000 (PEG6000) 西陇化工股份有限公司;细菌基因组DNA提取试剂盒 北京全式金生物技术有限公司;API50CHB碳水化合物鉴定试剂条 法国生物梅里埃公司。
分离培养基:营养琼脂(NA)配方为:牛肉膏3g、蛋白胨10g、NaCl 5g、琼脂粉15~20g,蒸馏水1000mL,pH7.2~7.4;筛选培养基:营养肉汤(NB)配方为:牛肉膏3g、蛋白胨10g、NaCl 5g,蒸馏水1000mL,pH7.2~7.4,PEG6000根据需要添加;API50CHB培养基 法国生物梅里埃公司。
1.2 仪器与设备
高压蒸汽灭菌锅 上海申安医疗器械厂;DYY-6C琼脂糖核酸电泳 北京六一仪器厂;GL212全自动凝胶成像系统 美国Kodak公司;PB-10酸度计 德国Sartorius公司;UV-1800紫外-可见光分光光度计 日本岛津制作所。
1.3 方法
1.3.1 内生细菌的分离纯化和保藏
采用组织研磨法对典型旱生植物内生细菌进行分离[9]。取采集的新鲜样品,用蒸馏水将植物表面洗净,稍干后分别取其根、茎、叶,在75%乙醇消毒液中浸泡3~5min,3%次氯酸钠浸泡5min,75%乙醇浸泡5min。最后用无菌水冲洗3~4次,最后一次冲洗的无菌水涂布平板做空白对照。将样品在灭菌的研钵中研磨,加适量无菌生理盐水研磨至匀浆状。取1mL液体分别按照10-1、10-2、10-3、10-4、10-5、10-6、10-7依次梯度稀释,并分别涂布平板,37℃恒温培养2d。若对照处理的分离培养基平板上无菌落出现,表明植物材料表面消毒彻底,分离到的是内生细菌。挑取单菌落转移至新的培养基平板上,划线法纯化,纯化好的菌株于-80℃冰箱保藏。
1.3.2 耐旱内生菌株的筛选
利用PEG6000人工模拟干旱条件[10],将初筛得到的菌株接种于含有不同质量浓度PEG6000的营养肉汤培养基中,37℃、170r/min摇床培养1~4d,检测培养液的光密度值(OD600nm)。分析菌株在不同质量浓度PEG6000中的生长情况。
1.3.3 菌株生理生化特性
1.3.3.1 菌株形态
将实验菌株在NA培养基平板上划线分离,37℃培养48h,观察菌落形态;用接种环挑取单个菌落涂片,进行革兰氏染色和芽孢染色,用显微镜观察菌体形态[10]。
1.3.3.2 菌株最适培养条件
将筛选所得菌株以2%的接种量接种于NB培养基中,分别置于25、28、32、35、37、40℃条件下,170r/min摇床培养2d。定期测定培养液的 OD600nm,确定最适培养温度。
配制一系列pH3、4、5、6、7、8、9的NB培养基,按2%的接种量于最适温度条件下,170r/min摇床培养2d。定期测定培养液的OD600nm确定最适pH值。
1.3.3.3 菌株生理生化特性鉴定
采用API50CH试剂条和API50CHB培养基进行49种碳水化合物的发酵实验。纯化的菌株按要求配成一定浊度的悬浮液,按试剂盒说明加入到API50CHB培养液中,混匀后加入到0~49号反应凹槽内,35℃培养。0号为阴性对照。
1.3.4 菌株的16S rDNA 分子生物学鉴定及系统发育树构建
用细菌基因组DNA提取试剂盒提取菌株基因组,采用16S rDNA通用引物27F(5'-AGAGTTTGATCCTGGCTCAG- 3')和1492R(5'-GGCTACCTTGTTACGACTT-3')进行PCR扩增。PCR反应体系:DNA模板2μL,dNTP Mixture 25μL,引物27F与引物1492R各1μL,ddH2O 21μL。反应条件:94℃预热5min;94℃变性30s,56℃退火30s,72℃延伸90s,33个循环;72℃终延伸10min。PCR产物5μL用1%琼脂糖凝胶电泳检测。PCR产物由北京六合华大基因科技股份有限公司完成测序。
登陆GeneBank数据库,将同源性相近的序列通过ClustalW软件进行聚类分析,使用MEGA 4.0软件以Neighbor-Joining计算方式生成系统发育进化树。
2 结果与分析
2.1 内生细菌的分离和纯化
为了研究植物体内内生细菌的耐旱情况,对13种植物体内的内生细菌进行分离和纯化,根据NA培养基上的菌落颜色和形态差异,得到142株内生细菌(表1)。结果表明,在干旱环境下的植物体内共存着不同种类的内生细菌。
2.2 内生细菌耐旱情况分析

图1 内生细菌耐旱性分析Fig.1 Drought-tolerant analysis of endophytic bacteria
根据菌株在不同质量浓度PEG6000的NB培养基中OD600nm的大小进行耐旱性分析,结果如图1所示,筛选得到的142株内生细菌均有一定的耐旱性。所有菌株均能够耐受20g/100mL的PEG6000;其中,136株能够耐受30g/100mL的PEG6000,占所有菌数的95.8%;67株能够耐受40g/100mL的PEG6000,占所有菌数的47.2%;7株能够耐受50g/100mL的PEG6000,占所有菌数的4.9%;2株能够耐受60g/100mL的PEG6000,占所有菌数的1.4%,选择其中一株PB14菌株进行进一步研究。

图2 不同质量浓度的PEG6000对菌株PB14生长的影响Fig.2 Effect of PEG6000 on the growth of PB14
菌株PB14分离于白蜡叶片,其在含有不同质量浓度PEG6000的NB培养基中的生长情况如图2所示。菌株在质量浓度为10~30g/100mL的PEG6000培养基中都能很好地生长。当质量浓度为40g/100mL时,菌株生长受到一定的影响,当质量浓度在50~60g/100mL范围内时菌株生长受到较大抑制。
2.3 菌株生理生化特性
2.3.1 菌株形态
菌株PB14在NA培养基上生长良好,37℃培养20h后,即可以形成明显的菌落,菌落直径约为2mm。菌落呈圆形,不透明,边缘整齐,表面光滑,湿润,长时间培养可以产生黄褐色色素。革兰氏染色后在10×100显微镜下观察细胞呈短直杆状,革兰氏阳性菌,芽孢染色后呈椭圆形,见图3。

图3 菌株PB14菌落形态、革兰氏染色及芽孢染色结果Fig.3 Morphological characteristics of strain PB14
2.3.2 菌株最适培养条件

图4 菌株PB14在不同温度条件下的生长情况Fig.4 Growth of PB14 strain at different temperatures
如图4所示,菌株PB14在25~40℃均能良好生长,最适温度为35℃;如图5所示,菌株PB14在pH5~8范围内生长良好,最适pH值为6。
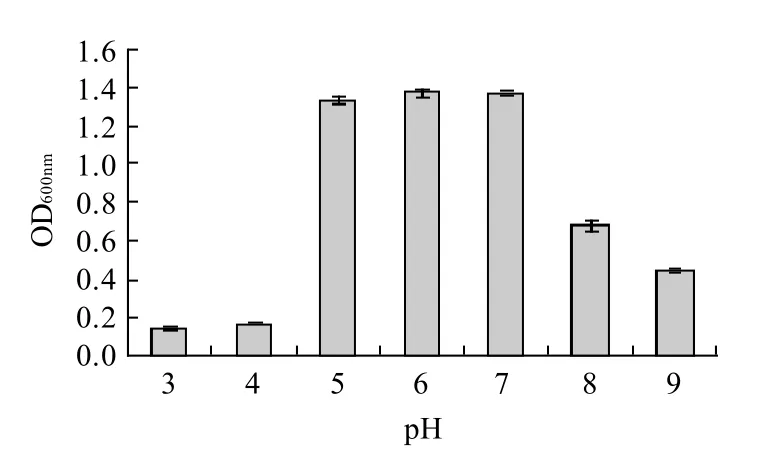
图5 菌株PB14在不同pH值培养基中的生长情况Fig.5 Growth of PB14 strain at different pH
2.3.3 菌株生理生化特性鉴定结果

表2 菌株PB14部分生理生化特性鉴定结果Table 2 Physiological and biochemical identification of strain PB14
菌株PB14生理生化实验结果见表2,结合API50CHB试剂条结果(表3)与《常见细菌鉴定手册》[11]初步确定该菌为蜡样芽孢杆菌(Bacillus cereus)。

表 3 菌株PB14的API50CHB试剂条结果Table 3 API50CHB fermentation results of strain PB14
2.3.4 基于16S rDNA的分子生物学鉴定
将菌株PB14的16S rDNA的PCR扩增产物送样测序后,得到其序列长度14472bp。使用Blastn在GeneBank基因库中进行同源性搜索,并通过相似性比对,发现菌株PB14与蜡样芽孢杆菌的相似度达到99% 以上,进一步确定该菌为蜡样芽孢杆菌。从GeneBank中选择11株菌的16S rDNA 基因序列,使用MEGA 4.0软件进行多重比较,构建的系统发育树见图6。

图6 基于16S rDNA基因序列的系统发育树Fig.6 Phylogenetic tree based on 16S rDNA sequence of the isolate and sequences of relating species
3 结 论
本实验从典型耐旱植物各器官中分离纯化出内生细菌142株,利用NA液体培养基中添加PEG6000来降低渗透势的方法对其耐旱性进行分析,最终筛选得到两株能够耐受60g/100mL PEG6000的内生细菌。对其中一株PB14进行分子生物学16S rDNA鉴定,并结合生理生化实验结果,鉴定该菌株是一株蜡样芽孢杆菌(Bacillus cereus)。
本结果表明,典型耐旱植物宿主中分离出的内生细菌都具有一定的耐旱能力。黄明勇等[12]在摸拟干旱条件下,对分离自金沙江干热河谷区45株土著花生根瘤菌进行耐旱性鉴定分析,结果显示供试菌株耐旱能力呈现多样性特征。根瘤菌的这种对干旱环境表现出的不同反应,不仅与其本身对干旱条件的耐受力有关,与生长的环境也有很大的相关性,同内生菌一样也是一种协同进化的反应[13]。Forchetti等[14-15]研究发现利用从干旱土壤的向日葵根际分离出的细菌处理向日葵种子能够增加向日葵幼苗的耐旱性。在我国用丛枝菌根真菌提高柑橘的耐旱性已有报道[16],然而对于利用内生细菌提高植物耐旱性的报道较少。本实验从典型干旱植物体内分离筛选出耐旱内生细菌,拓宽了内生细菌资源的应用范围和利用价值,可为增强植物耐旱性、扩大植物应用范围、丰富食品资源及改善其品质特性等提供新的思路。
[1] LEUCHTMANN A I. Systematics, distribution, and host specificity of grass endophytes[J]. Natural Toxins, 1992, 1(3): 150-162.
[2] 姜怡, 杨颖, 陈华红, 等. 植物内生菌资源[J]. 微生物学通报, 2005, 32(6): 146-147.
[3] 赫荣乔. 植物内生菌成为我国当前微生物研究领域的热点[J]. 微生物学通报, 2009, 36(1): 1.
[4] 文才艺, 吴元华, 田秀玲. 植物内生菌研究进展及其存在的问题[J].生态学杂志, 2004, 23(2): 86-91.
[5] PRESTON G M, HAUBOLD B, RAINEY P B. Bacterial genomics and adaptation to life on plants: implications for the evolution of pathogenicity and symbiosis[J]. Current Opinion in Microbiology, 1998, 1(5): 589-597.
[6] 邱德有, 朱澄. 植物抗渗透胁迫的基因调控及基因工程[J]. 生命科学, 1993, 5(4): 16-17.
[7] 罗守进. 稻类旱作研究[J]. 安徽农业科学, 1997, 25(4): 333-337.
[8] 周卫东. 现代生物技术在食品工业中的应用[J]. 生物学通报, 2010, 45(6): 13-15.
[9] 李强, 刘军, 周东坡, 等. 植物内生菌的开发与研究进展[J]. 生物技术通报, 2006(3): 33-37.
[10] MARULANDA A, BAREA J, AZCON R. Stimulation of plant growth and drought tolerance by native microorganisms (AM fungi and bacteria) from dry environments: mechanisms related to bacterial effectiveness[J]. Journal of Plant Growth Regulation, 2009, 28(2): 115-124.
[11] 东秀珠, 蔡妙瑛. 常见细菌鉴定手册[M]. 北京: 科学出版社, 2001.
[12] 黄明勇, 张小平, 李登煜, 等. 金沙江干热河谷区土著花生根瘤菌耐旱性初步研究[J]. 应用与环境生物学报, 2000, 6(3): 263-266.
[13] 周利平, 刘文杰, 马焕成, 等. 根瘤菌菌株和接种根瘤菌植株的耐旱性研究进展[J]. 安徽农业科学, 2010, 38(22): 11978-11980.
[14] FORCHETTI G, MASCIARELLI O, IZAGUIRRE M, et al. Endophytic bacteria improve seedling growth of sunflower under water stress, produce salicylic acid, and inhibit growth of pathogenic fungi[J]. Current Microbiology, 2010, 61(6): 485-493.
[15] FORCHETTI G, MASCIARELLI O, ALEMANO S, et al. Endophytic bacteria in sunflower(Helianthus annuusL.): isolation, characterization, and production of jasmonates and abscisic acid in culture medium[J]. Applied Microbiology and Biotechnology, 2007, 76(5): 1145-1152.
[16] 吴强盛. 丛枝菌根真菌对柑橘抗旱性的作用及其机理研究[D]. 武汉:华中农业大学, 2006.
Isolation and Identification of Drought-tolerant Bacteria from Xerophtes
ZHANG Yan-tao1,SHENG Ji-ping1,2,GE Jia1,JIAO Yu-cui1,WANG Zheng-rong1,CHENG Fan-sheng1,SHEN Lin1,*
(1. College of Food Science and Nutritional Engineering, China Agricultural University, Beijing 100083, China;2. School of Agricultural Economics and Rural Development, Renmin University of China, Beijing 100872, China)
Drought-tolerant bacteria were isolated and identified in this paper. One hundred and forty two bacterial strains were isolated from the typical drought-tolerant plants. Through adding polyglycol 6000 (PEG6000) to the fluid nutrient medium for decreasing osmotic potential, the drought tolerance of endophytic bacteria were analyzed. One of these strains, PB14, has the capability of drought resistance up to 60 g/100 mL PEG6000. This strain was identified asBacillus cereusbased on morphological and biochemical experiments as well as 16S rDNA sequence analysis.
drought tolerance;endophytic bacteria;identification;Bacillus cereus
TS201.3
A
1002-6630(2012)05-0124-05
2011-03-30
国家公益性行业(农业)科研专项(200803033)
张彦涛(1985—),男,硕士研究生,研究方向为食品生物技术。E-mail:zyt_ly008@126.com
*通信作者:申琳(1964—),男,副教授,博士,研究方向为农副产品综合利用。E-mail:shen5000@gmail.com

