有机溶剂对多聚半乳糖醛酸酶催化动力学的影响
刘小林,李晓婷,龚国勇,黄 磊,黄卓烈,伍志权,黎春怡
(1.宜春学院生命科学学院,江西 宜春 336000;2.华南农业大学生命科学学院,广东 广州 510642;3.江西宜春中学,江西 宜春 336000)
有机溶剂对多聚半乳糖醛酸酶催化动力学的影响
刘小林1,2,李晓婷1,龚国勇1,黄 磊3,黄卓烈2,伍志权2,黎春怡2
(1.宜春学院生命科学学院,江西 宜春 336000;2.华南农业大学生命科学学院,广东 广州 510642;3.江西宜春中学,江西 宜春 336000)
以水溶性低分子质量壳寡糖作为修饰剂对已纯化的多聚半乳糖醛酸酶进行化学修饰,得到化学修饰酶。再以有机溶剂甲醇、乙醇、丙酮、四氢呋喃为效应物,果胶为反应底物,研究其在缓冲液和不同有机溶剂中多聚半乳糖醛酸酶(PG)及其化学修饰酶(COS-PG)的动力学性质。结果表明:修饰后,在缓冲液中COS-PG的Km值有所下降,Vmax上升。在2%的甲醇、乙醇处理后,PG和COS-PG的Km和Vmax均下降。在2%四氢呋喃处理后,PG和COS-PG的Km和Vmax均上升。在2%丙酮处理后,PG和COS-PG的Km上升,而Vmax下降。
多聚半乳糖醛酸酶;有机溶剂;动力学
多聚半乳糖醛酸酶(polygalacturonase,EC3.2.1.15,PG)是降解植物果胶骨架结构的主要酶之一[1],能随机地从多聚半乳糖醛酸内部打开α-1,4-糖苷键,产生聚合度为10~14的寡聚半乳糖醛酸[2],与植物果实的软化,脱落和种子成熟,植物组织的抗病性有关[3-6]。此外,PG在食品工业、农业、化妆品业、造纸业等领域也有广泛的应用,是当今国际研究领域的热点。
酶促反应动力学是研究酶促反应速度的规律及某些因素对酶促反应速度影响的科学。这对于了解酶的作用机制、确定有效的酶促反应环境有着十分重要的作用。Km值是酶的特征性常数,测定Km值是研究酶促反应动力学的一种重要方法。有机相中酶促反应的过程、机制与水相中是相同的,符合米氏方程、乒乓反应机制[7-8]。研究表明,影响有机介质中酶促反应动力学变化的因素涉及底物和溶剂的性质[7-9]。酶和溶剂竞争底物,如果底物与溶剂的亲和性高,则底物与酶的亲和力低,Km值就大;如果底物与溶剂的亲和力低,酶和底物的亲和力高,Km值就小。
近10几年来,多聚半乳糖醛酸酶的分子生物学研究进展很快,主要集中在多聚半乳糖醛酸酶及其序列特征、多聚半乳糖醛酸酶基因及其序列特征、多聚半乳糖醛酸酶的表达调控以及与病原真菌致病力之间的关系等方面[10-13]。孙沈鲁等[14]探讨了高压脉冲电场(pulsed electric fields,PEF)对多聚半乳糖醛酸酶活性及构象影响,研究表明,PEF处理可以有效地抑制PG的活性,随着电场强度和脉冲个数的增加,酶活下降幅度增大。同时,PEF作用使酶的三级结构发生了明显的变化。程桂平等[15]研究了pH值、温度和金属离子对内切多聚半乳糖醛酸酶(endo-PG)降解香蕉果胶多糖的影响。刘小林等[16]研究了EDTA和金属离子对多聚半乳糖醛酸酶酶活力及其动力学的影响。但至今少见有报道有机溶剂对PG及其化学修饰酶动力学的影响研究。
本实验主要研究PG和PG用水溶性低分子质量壳寡糖(chitosan oligosaccharide,COS)进行化学修饰后得到的化学修饰酶COS-PG在水溶性有机溶剂中的动力学参数变化,旨在为了解PG和COS-PG在水溶性有机溶剂中酶促催化反应变化的机理提供依据。
1 材料与方法
1.1 试剂与仪器
多聚半乳糖醛酸酶(PG)、考马斯亮蓝G-250 美国Fluka公司;橘子果胶(纯度99%) 美国Sigma公司;其他试剂是国产分析纯。
HWS24型电热恒温水浴涡 上海益恒实验仪器有限公司;LRH-150生化培养箱 上海一恒科学仪器有限公司;UV2000紫外-可见分光光度计 上海Unico公司。
1.2 方法
1.2.1 蛋白质含量测定
参照Bradford[17]的方法,以牛血清白蛋白为标准。
1.2.2 酶活力测定
参照王小敏等[18]的方法进行改进:酶促反应体系为pH4.0,反应温度55℃,反应时间30min,采用DNS法测定生成的半乳糖醛酸量,在上述反应条件下,每分钟产生1μg半乳糖醛酸的酶量定义为1个单位多聚半乳糖醛酸酶酶活力(U)。
1.2.3 多聚半乳糖醛酸酶(COS-PG)的活化及制备
参照Gomez等[19]的方法,采用高碘酸钠氧化法对酶进行活化。称取80mg多聚半乳糖醛酸酶溶于磷酸氢二钠-柠檬酸缓冲液(pH4.0)中,将一定量的高碘酸钠溶于5mL蒸馏水中。上述活化体系置于一定温度培养箱内避光反应30min后,加入400μL乙二醇,迅速混匀后静置2h,用3.0L缓冲液(pH4.0)透析过夜,得到活化的PG。
将活化后的多聚半乳糖醛酸酶中加入150mg壳寡糖,置于活化温度下避光搅拌反应12h,不断搅拌,缓慢加入20mg NaBH4终止反应,静置2h后,用3.0L缓冲液(pH4.0)透析过夜。得到壳寡糖修饰的COS-PG。
1.2.4 动力学参数测定
参照林建成等[20]的方法,将PG置于含有磷酸氢二钠-柠檬酸的缓冲液(pH4.0)中和含有不同体积分数有机溶剂(包括甲醇、乙醇、丙酮、四氢呋喃)的磷酸氢二钠-柠檬酸缓冲液(pH4.0)中,55℃水浴预保温5min,加入0.1mL PG和COS-PG,并使反应体系中有机溶剂的终体积分数达到2%,参照1.2.2节方法,在磷酸氢二钠-柠檬酸缓冲液(pH4.0)中,55℃条件下测定其酶活力,以底物质量浓度的倒数(1/[S])为横坐标,以酶促反应速率的倒数(1/V)为纵坐标,绘制Lineweaver-Burk曲线,计算出Km值和Vmax值。果胶的质量浓度设置为0.2、0.4、0.6、0.8、1.0、1.2、1.4mg/mL和1.6mg/mL。
2 结果与分析
2.1 缓冲液中PG和COS-PG的动力学

图1 PG和COS-PG在缓冲液中的Lineweaver-Burk曲线Fig.1 Lineweaver-Burk curves of PG and COS-PG in buffers
经在缓冲液中保温1h后测定,PG和COS-PG的Lineweaver-Burk曲线见图1,根据双倒数作图法计算求出PG的Km为3.68mg/mL,Vmax为526.32U/mg pro。COS-PG的Km为2.80mg/mL,Vmax为555.56U/mg pro。修饰后,COS-PG的Km下降,Vmax上升,可见,修饰后酶对底物的亲和力和最大反应速率都上升。
2.2 PG和COS-PG在2%甲醇中的动力学

图2 PG和COS-PG在2%甲醇中的Lineweaver-Burk曲线Fig.2 Lineweaver-Burk curves of PG and COS-PG in 2% methanol
在2%甲醇中PG和COS-PG的Lineweaver-Burk曲线如图2所示。根据双倒数作图法计算求出PG的Km为2.17mg/mL,Vmax为434.78U/mg pro。COS-PG的Km为2.50mg/mL,Vmax为500.00U/mg pro。与缓冲液中相比,在2%甲醇中,PG和COS-PG的Km和Vmax下降。可见,在2%的甲醇中,PG和COS-PG与底物的亲和力上升,最大反应速率下降。
2.3 PG和COS-PG在2%乙醇中的动力学

图3 PG和COS-PG在2%乙醇中的Lineweaver-Burk曲线Fig.3 Lineweaver-Burk curves of PG and COS-PG in 2% ethanol
在2%乙醇中PG和COS-PG的Lineweaver-Burk曲线见图3。根据双倒数作图法计算求出PG的Km为3.25mg/mL,Vmax为294.12U/mg pro。COS-PG的Km为2.17mg/mL,Vmax为434.79U/mg pro。与缓冲液中相比,在2%乙醇中,PG和COS-PG的Km和Vmax下降。可见,在2%的乙醇中,PG和COS-PG与底物的亲和力上升,最大反应速率下降。
2.4 PG和COS-PG在2%丙酮中的动力学
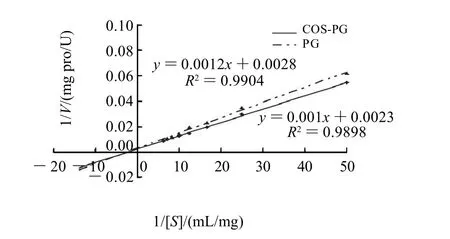
图4 PG和COS-PG在2%丙酮中的Lineweaver-Burk曲线Fig.4 Lineweaver-Burk curves of PG and COS-PG in 2% acetone
在2%丙酮中PG和COS-PG的Lineweaver-Burk曲线见图4。根据双倒数作图法计算出PG的Km为4.28mg/mL,Vmax为357.14U/mg pro。COS-PG的Km为4.34mg/mL,Vmax为434.78U/mg pro。与缓冲液中相比,在2%丙酮中,PG和COS-PG的Km上升,而Vmax下降。可见,在2%的丙酮中,PG和COS-PG与底物的亲和力下降,最大反应速率下降。
2.5 PG和COS-PG在2%四氢呋喃中的动力学
在2%四氢呋喃中PG和COS-PG的Lineweaver-Burk曲线见图5。根据双倒数作图法计算求出PG的Km为5.00mg/mL,Vmax为625.00U/mg pro。COS-PG的Km为3.75mg/mL,Vmax为625.00U/mg pro。与缓冲液中相比,在2%四氢呋喃中,PG和COS-PG的Km和Vmax均上升。可见,在2%的四氢呋喃中,PG和COS-PG与底物的亲和力下降,最大反应速率上升。
3 讨论与结论
Km值是酶的特征性常数,一般只与酶的性质有关,而与酶的浓度无关。Km值的大小反映了酶和底物亲和力的强弱,如果修饰Km值变大,说明酶与作用底物的亲和力减小,Km值变小,说明酶与底物的亲和力增强。
本实验结果表明,COS-PG的Km值有所下降,Vmax有较大幅度的上升,可见,修饰后酶活性的提高主要是由于酶的最大反应速率和酶分子对底物的亲和力增加共同作用而引起的。这可能是由于一方面偶联到蛋白质表面的壳寡糖与蛋白质分子上的-OH基团形成氢键,使维持蛋白质高级结构的氢键受到部分的破坏,使亚基肽链结构趋于松散,从而降低了酶催化反应过程中酶分子构象改变所需要的化学能[21],因此表现为Vmax大幅度上升;另一方面,壳寡糖引入酶蛋白表面后,增加酶分子表面的-,从而影响了整个酶活性中心的电荷分布,更有利于酶分子结合底物分子,因而表现为Km值有所下降,酶对底物的亲和力上升。
在有机溶剂中,酶的动力学参数受有机溶剂的制约,与有机溶剂的浓度以及底物溶剂化有很大关系。有机溶剂可以通过改变底物和产物在有机溶剂与酶活性部位微水相之间的分配来影响酶的活力。这种分配效应可以用来解释当酶从水溶液转移到有机溶剂中时引起的表观Km值增大。酶的催化效率与底物(疏水性与电荷性质)和溶剂(疏水性与极性)的理化性质有关[23-24]。本实验结果表明,在2%的甲醇中,PG和COS-PG的Km和Vmax均下降。在2%的四氢呋喃中,PG和COS-PG的Km和Vmax均上升。说明2%的甲醇引起PG和COS-PG酶活力上升主要是通过酶对底物的亲和力上升实现的,而2%的四氢呋喃引起PG和COS-PG酶活力上升主要是通过Vmax上升实现的。由此可以推断,在2%的甲醇和四氢呋喃处理后,增加了酶分子的柔性,改变了酶催化中心的微环境,从而使底物更加容易进入酶的活性中心,并导致表观的酶活性提高。在2%的乙醇处理后,PG和COS-PG的Km和Vmax下降,表明2%的乙醇引起PG和COS-PG酶活力下降主要是通过最大反应速率下降实现的,并且其反应机制类似于反竞争性抑制。在2%的丙酮处理后,PG和COS-PG的Km上升,而Vmax下降,表明2%的丙酮引起PG和COS-PG酶活力下降主要是通过酶对底物亲和力下降和最大反应速率下降共同作用实现的,并且其反应机制类似于混合竞争性机制。
[1] de VRIES R P, VISSER J.Aspergillusenzymes involved in degradation of plant cell wall polysaccharides[J]. Microbiol Mol Biol R, 2001, 65(4): 497-522.
[2] COOK B, CLAY R, BERGMANN C, et al. Fungal polygalacturonases exhibit different substrate degradation patterns and differ in their susceptibilities to polygalacturonase inhibiting proteins[J]. Mol Plant-Microbe Interact, 1999, 12(8): 703-711.
[3] HADFIELD K A, BENNETT A B. Polygalacturonases: many genes in search of a function[J]. Plant Physiol, 1998, 117(2): 337-343.
[4] SCOTT-CRAIG J S, CHENG Yiqiang, CERVONE F, et al. Targeted mutants ofCochliobolus carbonumlacking the two major extracellular polygalacturonases[J]. Appl Environ Microb, 1998, 64(4): 1497-1503.
[5] BRUMMELL D A, HARPSTER M H, CIVELLO P M, et al. Modification of expansin protein abundance in tomato fruit alters softening and cell wall polymer metabolism during ripening[J]. The Plant cell, 1999, 11(11): 2203-2216.
[6] di PIETRO A, MADRID M P, CARACUEL Z, et al.Fusarium oxysporum: exploring the molecular arsenal of a vascular wilt fungus[J]. Molecular Plant Pathol, 2003, 4(5): 315-325.
[7] YADAV G D, LATHI P S. Synthesis of citronellol laurate in organic media catalyzed by immobilized lipases: kinetic studies[J]. Journal of molecular catalysis B: Enzymatic, 2004, 27(2/3): 113-119.
[8] KARBOUNE S, ARCHELAS A, BARATTI J. Properties of epoxide hydrolase fromAspergillus nigerfor the hydrolytic kinetic resolution of epoxides in pure organic media[J]. Enzyme and Microbial Technology, 2006, 39(2): 318-324.
[9] ZHANG Tingzhou, YANG Lirong, ZHU Ziqiang. Determination of internal diffusion limitation and its macroscopic kinetics of the transesterification of CPB alcohol catalyzed by immobilized lipase in organic media[J]. Enzyme and Microbial Technology, 2005, 36(2/3): 203-209.
[10] 赵晓燕, 刘正坪. 真菌多聚半乳糖醛酸酶研究进展[J]. 菌物研究, 2007, 5(3): 184-186.
[11] 张弢, 曹家树. 多聚半乳糖醛酸酶基因家族的分子进化[J]. 农业生物技术学报, 2010, 18(1): 174-180.
[12] 郝青南, 马超, 马兵钢. 草莓多聚半乳糖醛酸酶基因RNAi植物表达载体的构建及表达鉴定[J]. 石河子大学学报: 自然科学版, 2009, 27 (4): 423-427.
[13] 谢妤. 核盘菌多聚半乳糖醛酸酶基因的克隆及hpRNAi载体的构建[J]. 宜春学院学报, 2008, 30(6): 121-122.
[14] 孙沈鲁, 梁国珍, 陈锦权. 高压脉冲电场对多聚半乳糖醛酸酶活性及构象影响[J]. 河南科技大学学报: 自然科学版, 2008, 29(2): 83-98.
[15] 程桂平, 段学武, 蒋跃明, 等. pH值、温度和金属离子对endo-PG降解香蕉果胶多糖的影响[J]. 热带亚热带植物学报, 2010, 18(1): 21-26.
[16] 刘小林, 伍志权, 卓怡, 等. EDTA和金属离子对多聚半乳糖醛酸酶酶活力的影响及其动力学研究[J]. 江西农业大学学报, 2010, 32(1): 153-158.
[17] BRADFORD M M. A rapid and sensivive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J]. Anal Biochem, 1976, 72: 248-254.
[18] 王小敏, 吴文龙, 闾连飞, 等. 分光光度计法测定果胶酶活力的方法研究[J]. 分析检测, 2007, 28(5): 227-229.
[19] GOMEZ L, RAMIREZ H L, VILLALONGA R. Stabilization of invertase by modification of sugar chains with chitosan[J]. Biotechnology Letters, 2000, 22(5): 347-350.
[20] 林建成, 杨文杰, 朱丽华, 等. 商品果胶酶(Aspergillus niger)的催化动力学研究[J]. 甘肃农业大学学报, 2006, 41(4): 81-85.
[21] JENE Q, PEARSON J C, LOWE C R. Surfactant modified enzymes: solubility and activity of surfactant-modified catalasein organic solvents [J]. Enzyme Microb Technol, 1997, 20(1): 69-74.
[22] CHOI B K, KIM K Y, YOO Y J, et al.in vitroantimicrobial activity of a chitooligosaccharide mixture againstActinobacillus actinomycetemcomitansandStreptococcus mutans[J]. Int J Antimicrobial Agents, 2001, 18(6): 553-557.
[23] KRISHNA S H. Developments and trends in enzyme catalysis in nonconventional media[J]. Biotechnology Advances, 2002, 20(3/4): 239-267.
[24] 罗贵民. 酶工程[M]. 北京: 化学工业出版社, 2003: 156-184.
Effect of Organic Solvent on Catalytic Kinetics of Polygalacturonase
LIU Xiao-lin1,2,LI Xiao-ting1,GONG Guo-yong1,HUANG Lei3,HUANG Zhuo-lie2,WU Zhi-quan2,LI Chun-yi2
(1. College of Life Sciences, Yichun University, Yichun 336000, China;2. College of Life Sciences, South China Agricultural University, Guangzhou 510642, China;3. Yichun Middle School, Yichun 336000, China)
Water-soluble chitosan with low molecular weight was employed to modify polygalacturonase (PG). After modification, the catalytic kinetics of PG and modified polygalacturonase (COS-PG) were investigated in buffer, methanol, ethanol, acetone and tetrahydrofuran solution using pectin as substrate. The results indicated thatKm of COS-PG revealed a slight decline, butVmax revealed an increase.Km andVmax of PG and COS-PG declined both in 2% methanol and 2% ethanol.Km andVmax of PG and COS-PG increased in 2% tetrahydrofuran solution. Conversely, in 2% acetone solution,Km increased butVmax declined.
polygalacturonase;organic solvents;dynamics
Q643.132
A
1002-6630(2012)05-0134-04
2011-04-14
刘小林(1966—),男,副教授,博士,研究方向为生物化学与分子生物学。E-mail:LXL7519@yahoo.com.cn
——α-葡萄糖醛酸酶的研究进展*

