单亲灭活德氏乳杆菌和乳酸乳球菌原生质体融合条件优化
李 丽,房 杰,黄洁洁,付瑞燕*
(安徽农业大学茶与食品科技学院,安徽 合肥 230036)
单亲灭活德氏乳杆菌和乳酸乳球菌原生质体融合条件优化
李 丽,房 杰,黄洁洁,付瑞燕*
(安徽农业大学茶与食品科技学院,安徽 合肥 230036)
利用单亲灭活原生质体技术对德氏乳杆菌FQ菌株和乳酸乳球菌FL菌株的原生质体进行融合,考察原生质体制备、再生和融合条件的影响因素。结果表明:制备德氏乳杆菌FQ菌株原生质体最适条件为温度37℃,在含有10μg/mL变溶菌素和1mg/mL溶菌酶溶液中超声处理90min。在此条件下,原生质体再生率可达6.36%。乳酸乳球菌FL菌株添加1mg/mL甘氨酸处理后,用10mg/mL溶菌酶37℃恒温酶解90min,原生质体形成率可达99.97%。65℃处理乳酸乳球菌FL菌株原生质体120min,原生质体灭活率可达96.89%。融合实验结果表明,在PEG6000 400g/L(含0.02mol/L MgCl2和0.01mol/L CaCl2)、融合时间5min、融合温度20℃、pH6.5的条件下促融,德氏乳杆菌FQ菌株和乳酸乳球菌FL菌株原生质体的融合率可达2.72×10-6。
单亲灭活;德氏乳杆菌;乳酸乳球菌;原生质体融合
乳酸是世界上公认的三大有机酸之一,在食品、医药和生物材料等诸多领域具有良好的应用前景[1-2]。另外,乳酸经过聚合生成的直链或环状聚乳酸,是一种无毒、无刺激性、强度高、可塑性好、生物相容性优良、具有良好生物可降解性的新型生物,已引起世界各国浓厚的兴趣。因此,国内外对乳酸的生产研究非常重视[3]。
乳酸发酵的生产菌种主要为乳酸菌和根霉菌。与根霉菌发酵相比,乳酸菌发酵的产酸量高,并且对糖的利用率高,发酵不需要通氧气,动力消耗小。但是,这种厌氧或微耗氧发酵的周期较长,造成生产效率偏低。究其原因,是因乳酸菌对氧的耐受能力不足,在接触氧的过程中所产生的氧自由基对细胞活性造成损伤,从而降低菌株的最大生长速率和碳源利用程度。德氏乳杆菌是工业生产乳酸最常用的菌种[4-6],因此,选育耐氧型德氏乳杆菌具有重要的现实意义。与传统诱变相比,原生质体融合具有集中双亲本优良性状等优势[7]。通过原生质体融合方法选育具有优良性状融合菌株的方法已经成功应用于提高嗜酸乳杆菌耐酸及耐胆盐能力[8]等诸多方面的研究。本实验对德氏乳杆菌FQ菌株原生质体再生条件、乳酸乳球菌FL菌株原生质体温度灭活条件及原生质体融合条件进行优化研究,对单亲灭活原生质体技术融合选育耐氧乳酸菌进行探索,为耐氧型乳酸菌基因工程菌的构建提供基础。
1 材料与方法
1.1 菌株与试剂
德氏乳杆菌FQ菌株和乳酸乳球菌FL菌株由安徽农业大学茶与食品科技学院微生物学实验室保藏。
MRS、M17培养基和变溶菌素 美国Sigma公司;溶菌酶、聚乙二醇(PEG6000) 合肥博美生物科技有限责任公司;其他试剂均为国产分析纯。
1.2 方法
1.2.1 生长培养基配方
德氏乳杆菌FQ菌株:MRS培养基,补充0.5mol/L蔗糖,简称SMRS;乳酸乳球菌FL菌株:M17培养基,补充10g/L葡萄糖,简称GM17。
1.2.2 再生培养基(RM)配方
再生固体培养基Ⅰ(RMⅠ):MRS培养基(不含Tween-80)组成成分,另外再补充0.5mol/L蔗糖、20mmol/L MgCl2、10mmol/L CaCl2、25g/L明胶、5g/L牛血清白蛋白(BSA)、15g/L琼脂。再生半固体培养基琼脂成分为6g/L。
再生固体培养基Ⅱ(RMⅡ):MRS培养基(含Tween-80)组成成分,另外再补充0.5mol/L蔗糖、20mmol/L MgCl2、10mmol/L CaCl2、25g/L明胶、15g/L琼脂。
再生固体培养基Ⅲ(RMⅢ):MRS培养基(含Tween-80)组成成分,另外再补充0.5mol/L蔗糖、20mmol/L MgCl2、10mmol/L CaCl2、15g/L 琼脂。
再生固体培养基Ⅳ(RMⅣ)[9]:MR S培养基(含Tween-80)组成成分,另外再补充0.5mol/L蔗糖、15g/L琼脂。
再生固体培养基Ⅴ(RMⅤ)[10]:25mmol/L葡萄糖、5g/L胰蛋白胨、5g/L酵母提取物、2mmol/L L-半胱氨酸盐酸盐、18mmol/L磷酸二氢钾、122mmol/L醋酸钠、25mmol/L MgCl2、45mmol/L CaCl2、0.25mol/L 棉子糖、15g/L琼脂。
再生固体培养基Ⅵ(RMⅥ)[11]:改良Chamers培养基组成成分,另外再补充0.7mol/L KCl、0.5mol/L蔗糖、0.75mol/L甘露醇、15g/L琼脂。
1.2.3 原生质体稳定液(PB)的配制
Tris-HCl缓冲液[9,12]:10mmol/L Tris-HCl、0.5mol/L蔗糖和20mmol/L MgCl2,用超纯水配制,用4mol/L HCl溶液调节pH值至6.5,115℃高压灭菌20min,冷却至室温后4℃保存备用。
1.3 德氏乳杆菌FQ菌株原生质体的制备及再生
将变溶菌素和溶菌酶用灭菌原生质稳定液配制成100μg/mL和100mg/mL贮备液,滤膜过滤除菌,备用。取SMRS液体培养基培养至对数末期的菌液15mL,4℃、4000r/min离心5min,去上清液。用5mL PB反复洗涤两次,去上清液。最后用1mL PB悬浮即得菌体悬浮液,最终浓度为1×109~4×109CFU/mL。悬浮液加入终质量浓度分别为1μg/mL变溶菌素、5μg/mL变溶菌素、10μg/mL变溶菌素、10μg/mL变溶菌素+1mg/mL溶菌酶、3mg/mL溶菌酶,37℃恒温酶解,同时进行超声处理120min。再利用最适酶质量浓度酶解不同时间(30、60、90、120mim),得到原生质体最大再生率。酶解后的菌液用PB洗涤两次,用1mL PB悬浮得到原生质体液。将菌体悬浮液和原生质体液分别用0.85g/100mL生理盐水、无菌水和PB梯度稀释后涂布于MRS双层培养基和6种双层再生培养基,37℃恒温培养5~7d,测定德氏乳杆菌FQ菌株原生质体的形成率和再生率。

式中:A为酶解前的总菌落数(MRS培养基)/(CFU/mL);B为未形成原生质体菌落数(即未被酶裂解的剩余细胞数,MRS培养基)/(CFU/mL);C为酶解后的再生菌落数(RM培养基)/(CFU/mL)。
1.4 乳酸乳球菌FL菌株原生质体制备及形成
取GM17液体培养基培养至对数末期的菌液10mL,4℃、4000r/min离心5min,用PB反复洗涤两次,用1mL PB悬浮得到菌体悬浮液,最终浓度为6×109~9×109CFU/mL。取1mL悬浮液加入终质量浓度分别为1、5、10mg/mL溶菌酶,37℃恒温酶解30、60、90min。酶解后的菌液用PB洗涤两次,用1mL PB悬浮得到原生质体液。取部分悬浮液和原生质体液,用0.85g/100mL生理盐水和无菌水梯度稀释后涂布在GM17单层培养基,30℃培养5d,测定乳酸乳球菌FL菌株原生质体形成率。
1.5 甘氨酸对乳酸乳球菌FL菌株原生质体形成率的影响
在GM17培养基中添加1、10、20、30mg/mL甘氨酸培养至对数期,以未添加甘氨酸为对照组。菌体悬浮液中加入终质量浓度为10mg/mL溶菌酶,37℃恒温酶解90min,考察甘氨酸处理对乳酸乳球菌FL菌株细胞光密度(OD600nm)值、菌落数及原生质体形成率的影响。
1.6 乳酸乳球菌FL菌株原生质体温度灭活条件的确定
将制备好的乳酸乳球菌FL菌株原生质体液等量分装于编号分别为0、1、2、3、4、5的无菌离心管内,每管均设3个平行样,分别在60、65、70℃的恒温水浴锅中热灭活。同一温度下的灭活时间间隔为30min。0编号管为对照管(未灭活管)。最后将各管原生质体液适当稀释后涂布于单层再生培养基中,30℃培养5~7d后,计算原生质体灭活率。同时,用血球计数板观察细胞是否破裂。
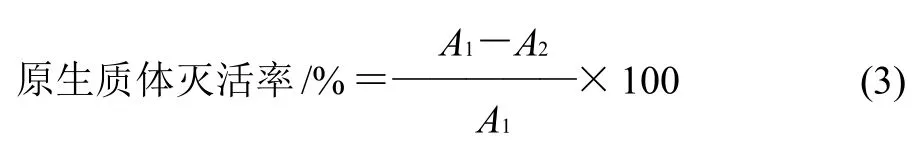
式中:A1为未被处理菌体长出的菌落数/(CFU/mL);A2为被处理菌体长出的菌落数/(CFU/mL)。
1.7 原生质体融合
亲本菌株德氏乳杆菌FQ菌株在含有氯霉素再生培养基上不生长,另一亲本乳酸乳球菌FL菌株在含有氯霉素再生培养基上可以生长,融合子如果能够结合两亲本的特性,应该可以抗氯霉素,因此,在含有氯霉素的再生培养基上长出的菌落初步认为其是融合子。
分别取等量德氏乳杆菌FQ菌株原生质体液和灭活乳酸乳球菌FL菌株原生质体液混和(取样稀释涂布再生平板和MRS平板),离心,重悬于0.5mL PB中,加4.5mL 400g/L PEG6000(含 0.01mol/L CaCl2、0.02 mol/L MgCl2),混匀,于4、20、37℃条件下分别放置5、10、30min。最后用5mL PB洗涤两次,适当稀释后涂布于含氯霉素的最适双层再生培养基,37℃培养7d后计数。以未经PEG6000处理的两种原生质体再生菌株作为对照组。
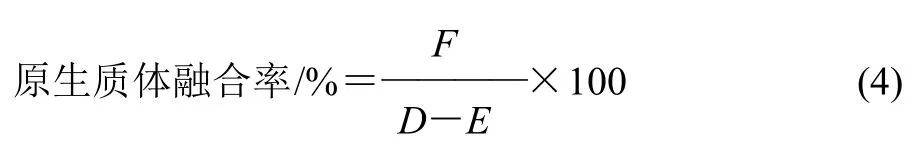
式中:F为融合子数/(CFU/mL);D为两亲本菌株在再生平板菌落数/(CFU/mL);E为两亲本菌株在MRS平板菌落数/(CFU/mL)。
1.8 融合子和两亲本菌株对氧耐受性的比较
将融合子、亲本德氏乳杆菌FQ菌株和乳酸乳球菌FL菌株按体积分数5%接种量,融合子和亲本乳酸乳球菌FL菌株接入含终质量浓度为10μg/mL氯霉素的MRS培养基,亲本德氏乳杆菌FQ菌株接入不含氯霉素的MRS培养基,37℃条件下150r/min振荡和静置培养。在不含氯霉素的培养基中振荡培养作为对照,定时测量其OD600nm值,比较它们对氧的耐受性。
2 结果与分析
2.1 德氏乳杆菌FQ菌株原生质体形成率和再生率
2.1.1 酶种类及其质量浓度对德氏乳杆菌FQ菌株原生质体形成率和再生率的影响
制备细菌原生质体主要采用溶菌酶,但乳杆菌细胞壁致密,对溶菌酶具有很强的抗性,所以在乳杆菌原生质体的制备过程中,采用质量浓度适合的溶菌酶和变溶菌素共同作用,以有效提高原生质体的形成率和再生率[13]。

图1 不同酶种类及其质量浓度对德氏乳杆菌FQ菌株原生质体形成率及再生率的影响Fig.1 Effects of types and concentration of enzymes on formation and regeneration rate of protoplast of Lactobacillus delbrueckii FQ
由图1可知,采用不同质量浓度的溶菌酶和变溶菌素于37℃恒温酶解及超声处理菌液,其原生质体的形成率和再生率随着变溶菌素质量浓度的增加,逐渐增大,变溶菌素和溶菌酶终质量浓度分别为10μg/mL和1mg/mL时,得到最大的形成率和再生率,分别为99.99%和4.93%。其原因可能是酶解过程中,酶质量浓度升高,增加了酶分子与细胞壁接触的机会,使得细胞壁被水解的几率增大,且原生质体具有较高活性。当溶菌酶终质量浓度为3mg/mL时,原生质体不能再生。可能是溶菌酶质量浓度过高,水解完细胞壁后,会再水解细胞膜上的部分蛋白成分从而导致细胞的死去,甚至破裂,致使原生质体不能再生。
2.1.2 酶解时间对德氏乳杆菌FQ菌株原生质体再生率的影响
酶解时间过短会导致细胞壁水解不充分,原生质体不能充分释放,形成率较低;酶解时间过长又将导致原生质体皱缩,而且会损害细胞质膜导致再生率急剧下降[14],不利于原生质体的再生。本实验用最适酶质量浓度为10μg/mL变溶菌素和1mg/mL溶菌酶,37℃恒温水浴超声处理3 0、6 0、9 0、1 2 0 m in,研究不同酶解时间对德氏乳杆菌FQ菌株原生质体再生率的影响。

图2 酶解时间对德氏乳杆菌FQ菌株原生质体再生率的影响Fig.2 Effect of enzymolysis time on protoplast regeneration rate of Lactobacillus delbrueckii FQ
如图2所示,德氏乳杆菌FQ菌株用最适酶质量浓度于37℃恒温水浴超声处理,原生质体形成率为99.99%,没有随酶解时间的增加而增大。处理90min,达到最大再生率6.36%。究其原因,可能是适当酶质量浓度和酶解时间使酶分子与细胞壁充分接触,细胞壁得到水解,原生质体能保持较高的活性,所以原生质体再生率较高。当酶解时间为120min时,可能是酶解时间太长导致部分原生质体皱缩,再生率降低。
2.2 再生培养基种类对德氏乳杆菌FQ菌株再生率的影响
融合子细胞壁合成、重建和融合子的再生,具体过程和一般原生质体再生一样,酶解脱壁后的原生质体应该具有再生能力,这是原生质体融合育种的必要条件[7]。所以,德氏乳杆菌FQ菌株最适原生质体再生培养基,同样适合于融合子的再生。本实验在最适酶解条件下,研究6种再生培养基对德氏乳杆菌FQ菌株原生质体再生率的影响。

图3 再生培养基对德氏乳杆菌FQ菌株原生质体再生率的影响Fig.3 Effect of regeneration medium on protoplast regeneration rate of Lactobacillus delbrueckii FQ
由图3可知,再生培养基Ⅱ(RMⅡ)是德氏乳杆菌FQ菌株原生质体的最适再生培养基,再生率可达到10.59%,再生率大小为:RMⅡ>RMⅠ>RMⅢ>RMⅣ,而RMⅤ和RMⅥ上原生质体不能再生,其原因可能是其渗透压达不到德氏乳杆菌FQ菌株原生质体再生的水平,导致原生质体无法再生。再生培养基中含有明胶、Ca2+和Mg2+有利于德氏乳杆菌FQ菌株原生质体再生。因此,选择R MⅡ作为融合子的再生培养基。
2.3 酶质量浓度及酶解时间对乳酸乳球菌FL菌株原生质体形成率的影响
乳酸乳球菌FL菌株细胞壁因含大量肽聚糖而比较致密,而且可以在再生培养基上生长,为了得到纯的融合子,要尽可能的使其酶解。

图4 酶质量浓度及酶解时间对乳酸乳球菌FL菌株原生质体形成率的影响Fig.4 Effect of lysozyme concentration and enzymolysis time on protoplast formation rate of Lactococcus lactis FL
由图4可知,乳酸乳球菌FL菌株原生质体的形成率随着溶菌酶质量浓度的升高和酶解时间的增加逐渐升高。酶质量浓度升高,酶分子与细胞壁充分接触,增大了细胞壁被水解的几率;适当的酶解时间使细胞壁充分水解,从而得到较高的原生质体形成率。结果表明,用10mg/mL溶菌酶37℃恒温处理90min,得到最大的原生质体形成率99.95%。
2.4 甘氨酸对乳酸乳球菌FL菌株原生质体形成率的影响

图5 甘氨酸质量浓度对乳酸乳球菌FL菌株原生质体形成率的影响Fig.5 Effect of glycine concentration on protoplast formation rate of Lactococcus lactis FL
乳酸乳球菌FL菌株细胞壁相对于德氏乳杆菌FQ菌株比较致密,在其生长培养基中添加适当的化学物质可以影响细胞壁的生长,进而影响细胞壁的密度及厚度[15]。常用的细胞壁处理剂如甘氨酸,可以增加菌体对溶菌酶的敏感程度,提高原生质体的制备率。由图5可知,与对照组相比,实验组OD600nm及菌落数随着甘氨酸质量浓度的增加逐渐减小,但原生质体的形成率都略有增加,加入过高质量浓度甘氨酸后,可能是渗透压过高对细胞壁造成了过度破坏,致使细菌生长非常缓慢。综合考虑三者,选择在生长培养基中添加1mg/mL甘氨酸制备原生质体,原生质体的形成率可达到99.97%。
2.5 乳酸乳球菌FL菌株原生质体温度灭活条件的确定微生物原生质体灭活是利用物理或化学方法使其某一小部位的生理结构受到损伤,造成原生质体丧失独立的再生活性,但决不是被彻底杀死,原生质体的染色体仍然保持复制与重组能力,融合后原生质体的细胞核和线粒体等仍具有转化和互补功能。目前认为,温度灭活原生质体的作用主要在细胞质中,使核糖体或核糖体RNA受到损伤,结果使细胞内的功能蛋白、酶蛋白的合成受到影响或使其变性失活,产生致死作用[16]。在
60℃条件下,大多数细菌都即可死亡,温度超过65℃,原生质体容易黏结成团,不利于原生质体的融合[17]。

图6 乳酸乳球菌FL菌株原生质体灭活温度及时间对灭活率的影响Fig.6 Effect of inactivated time and temperature on inactivation rate of Lactococcus lactis FL protoplast
由图6可知,在原生质体融合前,65℃对乳酸乳球菌FL菌株原生质体进行灭活120min,使其丧失再生的能力,同时用血球计数板观察其没有破裂,也没有黏结成团。此灭活条件下,原生质体的灭活率最大可达到96.89%。被灭活的原生质体实际上起了遗传物质的载体作用,与德氏乳杆菌FQ菌株融合后,融合菌株可能会具备双亲的优良性状。
2.6 不同融合条件对原生质体融合率的影响
影响原生质体融合的因素有PEG6000处理时间、融合温度和无机离子等。一般认为细菌原生质体融合处理时间为1~10min,融合温度4、20℃比37℃好,同时融合过程中含有一定量的Ca2+和Mg2+会促进融合[18-19]。
由图7可知,最适融合条件为:融合温度为20℃,融合时间为5min,此条件下可得到最大的融合率2.72×10-6,相比文献[20]单亲灭活融合率2.74×10-7,融合率提高10倍左右。融合温度为20℃时,细胞膜在较高温度下流动性增加,PEG6000黏度下降,有利于原生质体的融合。随着融合时间的增加,融合率逐渐降低,这可能是PEG6000处理时间过长,对原生质体有一定的毒性,从而导致其失活。

图7 融合温度和融合时间对原生质体融合率的影响Fig.7 Effects of temperature and time on protoplast fusion rate between Lactobacillus delbrueckii FQ and Lactococcus lactis FL
2.7 德氏乳杆菌FQ菌株、乳酸乳球菌FL菌株及融合子镜检结果

图8 德氏乳杆菌FQ菌株(a)、乳酸乳球菌FL菌株(b)及融合子(c)的显微镜观察图(×400)Fig.8 Micrographs of Lactobacillus delbrueckii FQ (a), Lactococcus lactis FL (b) and their fusants (c) (×400)
用光学显微镜观察亲本菌株德氏乳杆菌FQ菌株、乳酸乳球菌FL菌株和融合子的细胞形态(图8)可知,融合子的形态上发生了明显的改变,变成短粗杆菌。
2.8 融合子和亲本菌株对氧耐受性的比较
连续传代5代后,筛选得到一株耐氧性融合子QL10。将融合子QL10和亲本菌株在含终质量浓度为10μg/mL氯霉素的培养基中静置和振荡培养,在不含氯霉素的培养基振荡培养作为对照,比较三者细胞密度的变化。由图9可知,融合子QL10在3种培养方式下所得的细胞密度均高于亲本德氏乳杆菌FQ菌株的细胞密度,且融合子能抗氯霉素,表明融合子的耐氧性能得到一定的改善。

图9 融合子和两亲本菌株细胞密度的比较Fig.9 Comparison of cell density among Lactobacillus delbrueckii FQ,Lactococcus lactis FL and their fusants under different incubation conditions
3 结 论
3.1 酶种类、酶质量浓度与德氏乳杆菌FQ菌株原生质体形成率及再生率密切相关。使用适当浓度的变溶菌素和溶菌酶进行酶解,可以促进酶解的进程,提高原生质体活性和再生率。制备德氏乳杆菌FQ菌株原生质体的最适酶解条件为:温度37℃,在含有10μg/mL变溶菌素和1mg/mL溶菌酶的溶液中超声处理90min,在此条件下原生质体形成率为99.99%,再生率为6.36%。德氏乳杆菌FQ菌株原生质体的最适再生培养基是RMⅡ。
3.2 乳酸乳球菌FL菌株生长培养基中添加1mg/mL甘氨酸,用终质量浓度为10mg/mL溶菌酶液37℃恒温酶解处理90min,在此条件下原生质体形成率为99.97%。乳酸乳球菌FL菌株原生质体温度灭活最适条件为65℃,灭活120min。
3.3 德氏乳杆菌FQ菌株和乳酸乳球菌FL菌株最适融合条件为:融合温度20℃,融合时间5min,PEG6000 400g/L(含 0.02mol/L MgCl2和 0.01mol/L CaCl2),在此条件下融合率为2.72×10-6,该融合率是其他同类研究的10倍左右。
[1] GIVRY S, PREVOT V, DUCHIRON F. Lactic acid production from hemicellulosic hydrolyzate by cells of Lactobacillus bifermentans immobilized in Ca-alginate using response surface methodology[J]. World J Microbiol Biotechnol, 2008, 24(6): 745-752.
[2] WEE Y J, YUN J S, KIM D, et al. Batch and repeated batch production of L(+)-lactic acid by Enterococcus faecalis RKY1 using wood hydrolyzate and corn steep liquor[J]. J Ind Microbiol Biotechnol, 2006, 33(6):431-435.
[3] 杨登峰, 关妮, 潘丽霞, 等. 微生物发酵L-乳酸的研究进展[J]. 中国酿造, 2009(5): 1-3.
[4] CALABIA B P, TOKIWA Y. Production of D-lactic acid from sugarcane molasses, sugarcane juice and sugar beet juice by Lactobacillus delbrueckii[J]. Biotechnol Lett, 2007, 29(6): 1329-1332.
[5] WEE Y J, KIM J N, RYU H W. Biotechnological production of lactic acid and its recent applications[J]. Food Technol Biotechnol, 2006, 44(2): 163-172.
[6] VERINGA H A. Procedure for the preparation of D-lactic acid with Lactobacillus bulgaricus: US, 5322781[P]. 1994-06-21.
[7] 张兰英, 刘娜, 孙立波, 等. 现代环境微生物技术[M]. 北京: 清华大学出版社, 2005: 45-69.
[8] 王玉华, 张桂荣, 刘景圣. 原生质体融合提高嗜酸乳杆菌耐酸及耐胆盐能力[J]. 食品科学, 2006, 27(3): 96-99.
[9] SINGHVI M, JOSHI D, GAIKAIWARI S, et al. Protoplast formation and regeneration in Lactobacillus delbrueckii[J]. Indian J Microbiol,2010, 50(1): 97-100.
[10] 张莉滟, 陈林, 张德. 保加利亚乳杆菌原生质体的制备与回复研究[J]. 中国微生态学杂志, 2004, 16(2): 73-74.
[11] 曾献春, 孟冬丽, 葛风伟. 乳酸菌原生质体融合筛选[J]. 中国酿造,2008(3): 26-28.
[12] 韩璞, 田洪涛, 苑社强. 罗伊氏乳杆菌原生质体的制备与再生条件的研究[J]. 中国食品学报, 2010, 10(1): 10-18.
[13] 王立梅, 齐斌. 基因组改组技术对L-乳酸产生菌耐热性的影响[J]. 食品科学, 2008, 29(10): 395-398.
[14] 邱静, 罗水忠, 姜绍通, 等. 高产L-乳酸米根霉的原生质体制备与再生条件研究[J]. 食品科学, 2011, 32(9): 174-178.
[15] 崔艳华, 张旭, 张兰威. 德氏乳杆菌保加利亚亚种电转化平台的构建和优化[J]. 生物信息学, 2010, 8(3): 267-270.
[16] 陈志刚. 抗酸奶后酸化乳酸菌株的选育[D]. 乌鲁木齐: 新疆农业大学, 2009.
[17] 裴晓林. 应用基因组改组技术选育L-乳酸高产菌株及其发酵工艺研究[D]. 长春: 吉林大学, 2007.
[18] 郑重谊, 谢达平, 谭周进, 等. 影响微生物原生质体融合技术的因素[J]. 湖南农业科学, 2006(4): 35-38.
[19] 王登宇, 臧威, 孙剑秋, 等. 细菌原生质体融合育种技术及其应用进展[J]. 中国酿造, 2008(7): 1-6.
[20] 任柏林, 谢水波, 刘迎久, 等. 单亲灭活柠檬酸杆菌与奇球菌原生质体融合[J]. 微生物学通报, 2010, 37(7): 975-980.
Optimization of Conditions for Protoplast Fusion between Single Inactivated Lactobacillus delbrueckii and Lactococcus lactis
LI Li,FANG Jie,HUANG Jie-jie,FU Rui-yan*
(College of Tea & Food Science and Technology, Anhui Agricultural University, Hefei 230036, China)
Single inactivated protoplast fusion technique was used for the fusion of Lactobacillus delbrueckii FQ with Lactococcus lactis FL. The protoplast formation, regeneration and fusion conditions were examined in this study. Results showed that the optimal enzymolysis conditions for L. delbrueckii FQ were ultrasound treatment for 90 min at 37 ℃ in the presence of 10 μg/mL mutanolysin and 1 mg/mL lysozyme. Under these conditions, the protoplast regeneration rate reached 6.36%. The protoplast formation rate of L. lactis FL was up to 99.97% after 90 min of treatment with 10 mg/mL lysozyme in the presence of 1 mg/mL glycine. L. lactis FL protoplasts showed an inactivated rate of 96.89% after 120 min of exposure to 65 ℃. The fusion rate between Lactobacillus delbrueckii FQ and Lactococcus lactis FL reached 2.72 × 10-6after 5 min of infusion at pH 6.5 in the presence of 400 g/L PEG 6000 (included 0.02 mol/L MgCl2 and 0.01 mol/L CaCl2).
single inactivation;Lactobacillus delbrueckii;Lactococcus lactis;protoplast fusion
Q813.2;Q939.117
A
1002-6630(2012)05-0193-06
2011-11-14
国家“973”计划项目(2007CB707803);安徽农业大学稳定和引进人才科研资助项目
李丽(1987—),女,硕士研究生,主要从事乳品微生物生理方面的研究。E-mail:liliwxd312@163.com
付瑞燕(1976—),女,副教授,博士,主要从事食品微生物和生物技术研究。E-mail:fry@ahau.edu.cn

