野生番石榴果醋加工工艺条件的优化
唐卿雁,林 奇,李永平
(1.云南农业大学食品科技学院,云南昆明 650201;2.云南省农业技术推广总站,云南昆明 650032)
野生番石榴果醋加工工艺条件的优化
唐卿雁1,林 奇1,李永平2,*
(1.云南农业大学食品科技学院,云南昆明 650201;2.云南省农业技术推广总站,云南昆明 650032)
以野生番石榴为原料,开发营养丰富的保健果醋,研究番石榴果醋的加工工艺,为番石榴的深加工提供一定的理论依据。野生番石榴果实经分选、清洗、破碎打浆、成分调整后进行酒精发酵和醋酸发酵,再经过陈酿、过滤澄清,在60~70℃下杀菌10min,冷却后可生产出具有浓郁野生番石榴香味和醋酸味的番石榴果醋。通过单因素实验和正交实验,对番石榴果醋的酒精发酵、醋酸发酵生产工艺参数进行优化。实验结果表明,酒精发酵的最佳工艺条件为:酵母菌接种量0.15%,糖度18%,发酵温度32℃;醋酸发酵的最佳工艺条件为:醋酸菌接种量10%,初始酒精度7%vol,发酵温度38℃。
野生番石榴,果醋,酒精发酵,醋酸发酵
番石榴(Psidium guajava L.),桃金娘科番石榴属植物,又称番稔、那拔、芭乐、鸡矢果等[1]。番石榴原产于美洲热带,在我国热带、亚热带地区均有分布[2]。番石榴果实清甜微酸,营养成分丰富。本实验所用原料野生番石榴果肉为红色,糖度11.688%,总酸度0.384%,维生素C 122.5mg/100g,还原糖含量3.85%。此外,还含有多种矿物质及微量元素,如钙、磷、铁、硒等。通过番石榴提取物的临床实验研究,发现番石榴具有较好的医疗保健作用,在抗菌止泻、治疗痤疮、抗过敏、防癌抗癌、降血糖、降血压以及促进伤口愈合等方面都有一定的效果[3]。果醋除了具有水果的营养外,还具有食醋的保健功效,更有利于人体健康[4]。通过研制番石榴果醋,既能丰富果醋品种,满足消费者的需求,又能充分利用野生植物资源,提高其综合利用价值,为野生番石榴深加工提供新的途径。
1 材料与方法
1.1 材料与仪器
野生番石榴 购于云南省丽江市华坪县,八九成熟;白砂糖 市售;果胶酶 天津利华酶制剂厂;碳酸钙、葡萄糖、无水乙醇、柠檬酸 天津风船化学试剂科技有限公司,均为分析纯;亚硫酸氢钠、氢氧化钠 天津福辰化学试剂厂,均为分析纯;琼脂粉 北京奥博星生物技术有限责任公司;酵母浸出汁 上海天鹅啤酒有限公司;酚酞试剂,淀粉指示剂等;葡萄酒高活性干酵母 安琪;醋酸菌 自制菠萝果醋醋醪中分离。
BS210S型电子天平 北京赛多利斯科学仪器有限公司;HPX-9272ME数显电热培养箱 上海博迅实业有限公司医疗设备厂;立式自动电热压力蒸汽灭菌器 上海申安医疗器械厂;恒温水浴锅 国华电器有限公司;722可见分光光度计 上海菁华科技仪器有限公司;SW-CJ-1C型双人单面净化工作台 苏州净化设备有限公司;AnKe TDL-5-A离心机 上海安亭科学仪器厂;HR1707搅拌机 飞利浦;WYT 0~80%手持糖度计,玻璃发酵罐等。
1.2 实验方法
1.2.1 工艺流程

1.2.2 操作要点
1.2.2.1 原料的选择 挑选无破损、无霉烂的新鲜番石榴,清洗去皮,并将果蒂切掉。尽量不用果皮深绿、质硬的果实,因为成熟度不够,含单宁成分较多,酸度高,糖度低,不利于果汁的发酵[5]。
1.2.2.2 打浆 原料切块后与0.01%亚硫酸氢钠溶液按1∶1的比例加入打浆机,打浆至果肉均匀无块状。番石榴籽粒中含有大量的单宁,在榨汁过程中易破碎,导致单宁进入果汁带来苦涩味,并且氧化生成不愉快的棕褐色[6],因此要尽量保持番石榴籽粒完整。
1.2.2.3 酶处理 加入果胶酶(添加量为0.05%),于40℃左右处理2h[7]。果胶酶使果实中的糖分溶解在果汁中,同时可以使果汁的色泽优化,提高果汁产量和缩短加工时间[8]。
1.2.2.4 成分调整 可发酵糖是酵母菌生长繁殖和酒精发酵的必要物质条件,糖浓度为2%以上时酵母菌活动旺盛,当糖分超过25%时则会抑制酵母菌活动[9]。为了达到发酵的酒精度,有必要对发酵果汁的糖度和酸度进行调整。理论上一般是按照1.7%的蔗糖溶液经酵母发酵产生1%vol的酒精度来计算蔗糖添加量[10],而果酒的酒精度一般为7%vol~18%vol[11]。因此调整糖度在13%~15%,酸度在0.2%~0.4%,85℃加热15min灭菌后,冷却至室温备用。
1.2.2.5 酵母活化 将5%的白砂糖溶液煮沸后冷却至室温,以5%的浓度将活性干酵母加入白砂糖溶液,搅拌均匀后在30~35℃下活化2h,每20min搅拌一次[12]。
1.2.2.6 酒精发酵 将调整好成分的果汁倒入发酵罐中,然后加入已活化的葡萄酒酵母,混合均匀,放入恒温培养箱中进行酒精发酵,酵母的接种量、发酵温度、初始糖度设置梯度见表1。定时取样测定可溶性固形物含量、总糖和酒精度,酒精度达到6%vol以上,残糖控制在0.5%~0.8%时可转入醋酸发酵。酒化完成,进行高温灭菌处理(95℃下灭菌15s)。
1.2.2.7 醋酸菌的分离、培养和保藏[13]醋酸菌的分离采用固体培养基(葡萄糖1%、酵母膏1%、碳酸钙2%、无水乙醇3%、琼脂2%)在37℃下分离并恒温培养48h;扩大培养采用液体培养基(葡萄糖1%、酵母膏1%、碳酸钙2%、无水乙醇3%)在37℃培养48h;保藏采用斜面培养基(葡萄糖1%、酵母膏1%、无水乙醇3%、碳酸钙1%、琼脂2%)。
1.2.2.8 醋酸发酵 接入经过扩大培养的醋酸菌进行醋酸发酵,醋酸菌接种量、发酵温度、发酵时间和初始酒精度设置梯度见表2。发酵时要不时搅拌并通入空气,并每天检查发酵品温及酒精、醋酸含量,直至醋酸含量连续2次测定不再增加时为止。
1.2.2.9 后处理 醋酸发酵结束后,将其静置于阴凉避光处,过滤澄清,60~70℃下杀菌10min,装瓶保藏[14]。
1.2.3 酒精发酵的单因素实验 分别以初始糖度、发酵温度、酵母接种量作为影响因子,用上述方法进行酒精发酵,以酒精度为指标,进行单因素实验,确定各影响因子对酒精发酵效果的影响。
1.2.4 酒精发酵的工艺优化 在单因素实验的基础上,以初始糖度、发酵温度、酵母接种量为因素,以酒精度为考察指标,采用三因素三水平进行正交实验,确定最佳的酒精发酵工艺参数,酒精发酵时间为7d。正交实验因素水平,见表1。
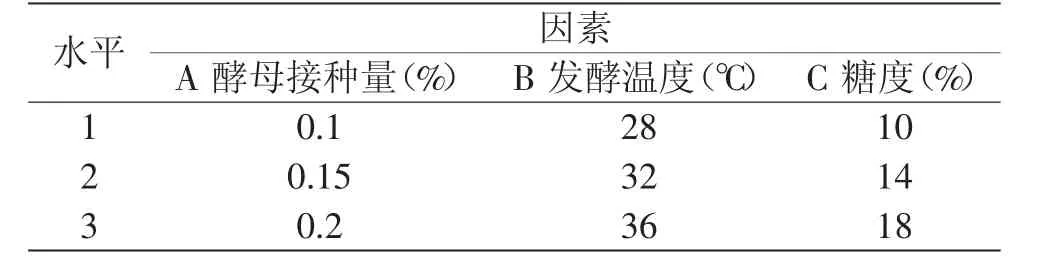
表1 酒精发酵正交实验因素与水平Table 1 Factors and levels of orthogonal experiment for optimizing the alcohol fermentation
1.2.5 醋酸发酵的单因素实验 分别以发酵醪酒精含量、发酵温度、醋酸菌接种量作为影响因子,用前述方法进行醋酸发酵,以酸度为指标,进行单因素实验,确定各影响因子对醋酸发酵的影响。
1.2.6 醋酸发酵的工艺优化 在单因素实验的基础上,以发酵醪酒精含量、发酵温度、醋酸菌接种量为因素,以产酸量为考察指标,采用三因素三水平进行正交实验,确定最佳的醋酸发酵工艺参数,醋酸发酵时间为8d。正交实验因素水平,见表2。
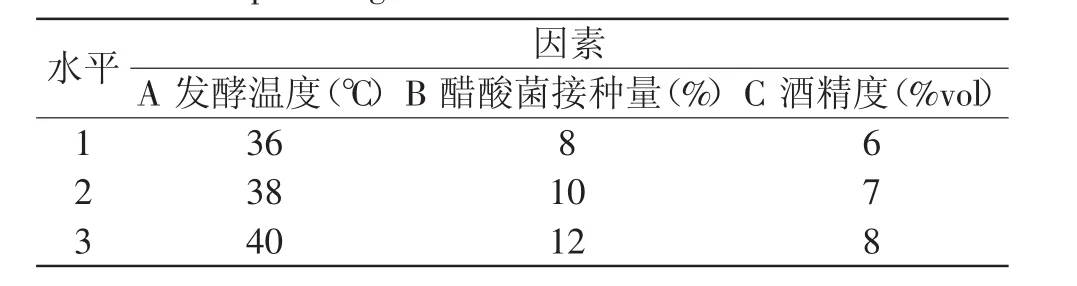
表2 醋酸发酵正交实验因素与水平Table 2 Factors and levels of orthogonal experiment for optimizing the acetic acid fermentation
1.2.7 检测方法
1.2.7.1 感官评定 由20名人员组成评价小组,从色泽、气味、质地、酸度、甜度几个方面对产品进行评分,满分为100分[15]。评定标准见表3。
1.2.7.2 理化分析[16-17]总酸的测定(以醋酸计):酸碱滴定法;还原糖的测定(以葡萄糖计):斐林试剂法;可溶性固形物:折光仪法;pH的测定:酸度计法;酒精度的测定:重铬酸钾比色法。
1.2.7.3 微生物检验 按GB/T2746-1985食品卫生微生物检验方法测定。

表3 番石榴发酵果醋的感官质量评定标准(100分)Table 3 Sensory quality evaluation standards of guava fruit vinegar fermentation(100)
2 结果与分析
2.1 酒精发酵
2.1.1 不同酵母菌接种量对酒精发酵的影响 酵母菌接种量分别为0.1%、0.15%、0.2%、0.25%,发酵温度为32℃,初始糖度为18%,发酵结束测定酒精度,实验结果如图1所示。
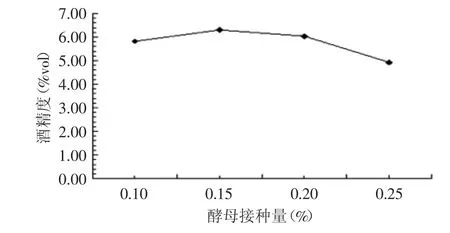
图1 不同酵母菌接种量对酒精发酵的影响Fig.1 Effect of different inoculation sizes of yeast on alcoholic fermentation
在其他条件不变的情况下,酵母菌接种量在0.1%~0.15%之间产生的酒精量随接种量的增加上升趋势明显,接种量大于0.2%时,酒精度相差不大,且有下降的趋势,在0.15%时酒精度相对较高,更利于后续的醋酸发酵,为最佳的接种量。酵母菌接种量过大时,发酵液中的营养物质主要用于菌体细胞增殖上,并且有大量的代谢废物生成,不利于获得所需的发酵产物[18]。
2.1.2 不同发酵温度对酒精发酵的影响 发酵温度分别为24、28、32、36℃,酵母接种量为0.15%,糖度为18%,发酵结束测定酒精度,结果如图2所示。
在24~32℃时,发酵产生的酒精量呈增长趋势,32~36℃时呈下降趋势。在一定范围内微生物的生长繁殖随着温度的上升而增加,而当温度升高到一定程度时,微生物的生长代谢开始受阻,进一步升高会导致菌体细胞内酶蛋白和核酸等发生不可逆变性或细胞受损而死亡[18]。32℃时产生的酒精含量较高,为酒精发酵的最适温度。
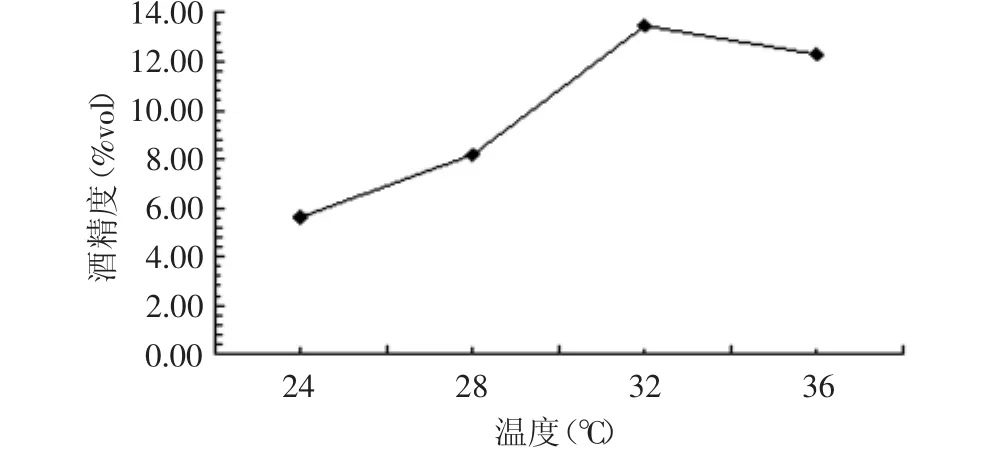
图2 不同温度对酒精发酵的影响Fig.2 Effect of different temperature on alcoholic fermentation
2.1.3 不同糖度对酒精发酵的影响 糖度分别为10%、14%、18%、22%,酵母接种量为0.15%,发酵温度为32℃,发酵结束测定酒精度,结果见图3。
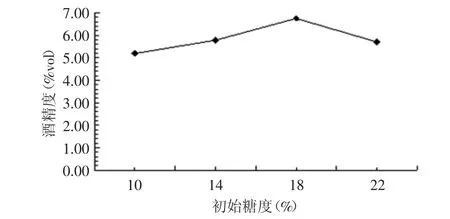
图3 不同糖度对酒精发酵的影响Fig.3 Effect of different sugar degree on alcoholic fermentation
初始糖度在10%~18%之间酒精含量呈增加趋势,在14%~18%之间增加明显,初始糖度在18%后呈下降趋势。糖度高时产生的酒精度也相对较高,但糖度过高会抑制酵母菌的生长繁殖,因此确定18%为最适初始糖度。
2.1.4 正交实验优化酒精发酵工艺参数 采用三因素三水平正交实验考察酵母接种量、发酵温度、糖度对酒精发酵的影响,以酒精发酵结束的酒精含量为评价指标,从而优化番石榴果醋酒精发酵工艺条件参数。实验结果见表4。
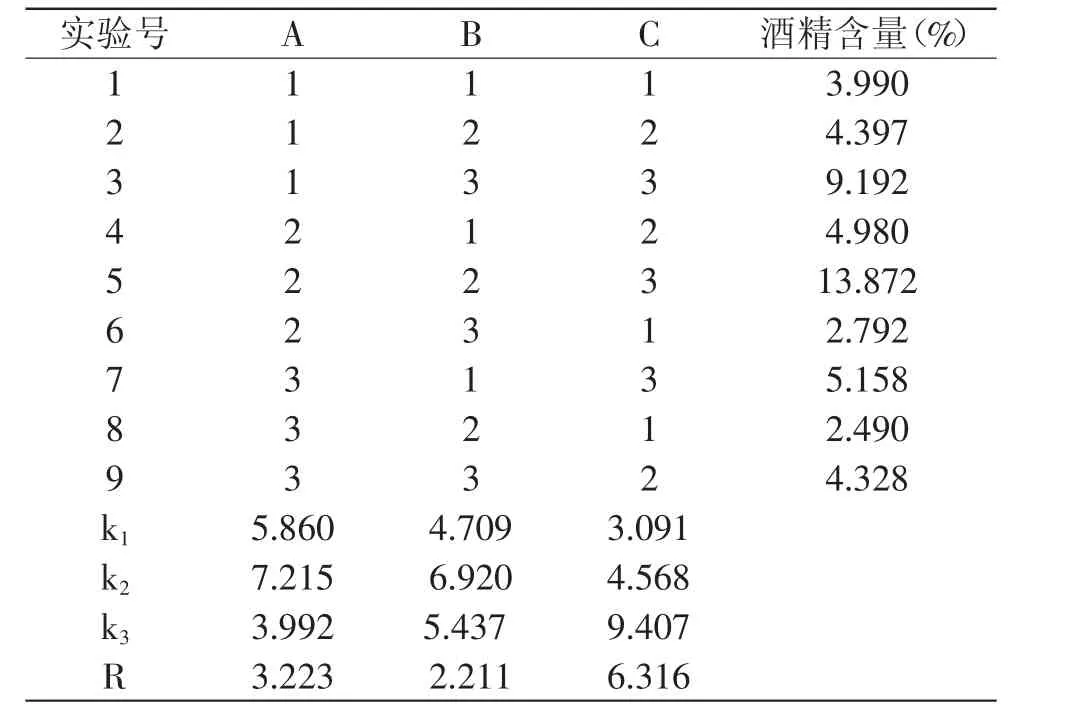
表4 酒精发酵正交实验结果与分析Table 4 Results and analysis of orthogonal experiment for the alcohol fermentation
通过直观分析法,得出最佳组合为A2B2C3,即酵母接种量为0.15%,发酵温度为32℃,糖度为18%,该条件下产生的酒精量最多。各因素对酒精生成量的影响主次顺序为初始糖度>酵母接种量>发酵温度。
2.2 醋酸发酵
2.2.1 发酵温度对产酸的影响 选取30、32、34、36、38、40℃共6个不同温度,对酒精含量为7%的酒精醪进行发酵,接种量为10%。醋酸发酵产酸量随时间的变化情况见图4。
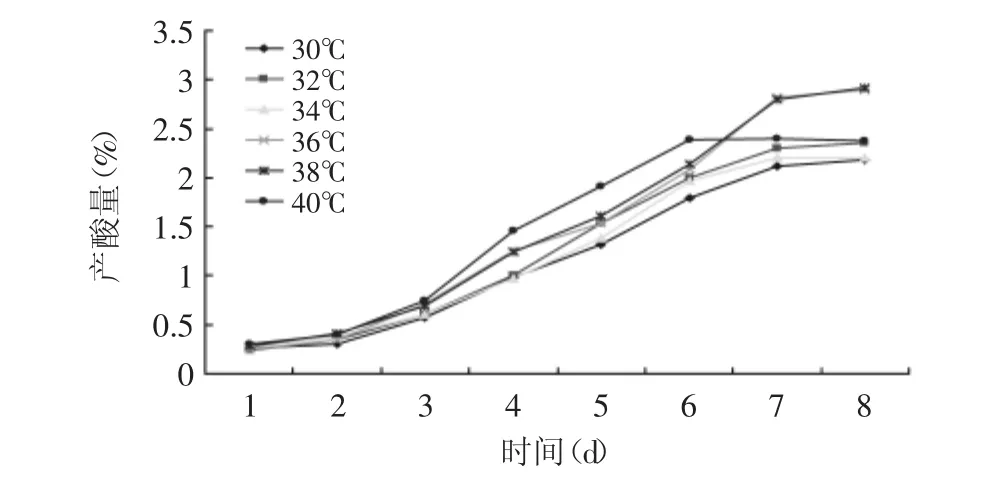
图4 不同温度条件下产酸量随时间的变化Fig.4 Acid output changes over time under different temperatures
在38℃的温度变化范围内,总产酸量的变化过程从逐渐升高最后到变化不明显,而在40℃的温度条件下产酸量先是逐渐升高然后呈下降趋势最后保持稳定。醋酸发酵温度过高,会造成菌体老化加快,温度过低不利于醋酸菌的生长,产酸也低[19],因此确定醋酸发酵的最适温度为38℃。
2.2.2 醋酸菌接种量对产酸的影响 醋酸菌接种量分别为7%、8%、9%、10%、11%、12%,发酵温度为38℃。醋酸发酵产酸量随时间的变化情况见图5。
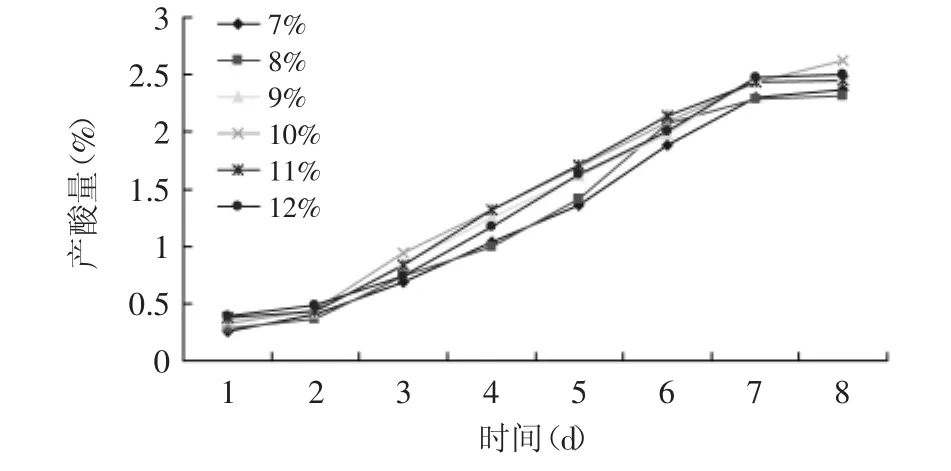
图5 不同接种量条件下产酸量随时间的变化Fig.5 Acid output changes over time with different inoculation
由图5可知,醋酸菌接种量在10%以下时,总产酸量呈逐渐升高最后到变化不明显,而在11%、12%的接种量条件下产酸量先是逐渐升高然后呈下降趋势最后保持稳定。接种量大时发酵体系中菌体浓度高,发酵速率较快,但当接种量过大时,发酵体系中的营养物质较多地消耗在菌体细胞的生长繁殖上,使得用于生成醋酸的底物量减少,最终的醋酸产量也减少,而且由于营养物质的迅速消耗和较多代谢产物的生成,使得菌体细胞所处的环境恶化,菌体细胞较早的衰老并发生老化、自溶等现象[20]。接种量为10%时产酸量最大,所以确定醋酸菌的最适接种量为10%。
2.2.3 酒精度对产酸的影响 取番石榴酒精发酵醪分别调整酒精含量为5%vol、6%vol、7%vol、8%vol、9%vol、 10%vol,接入10%的醋酸菌进行发酵,发酵温度为38℃。醋酸发酵产酸量随时间的变化情况见图6。
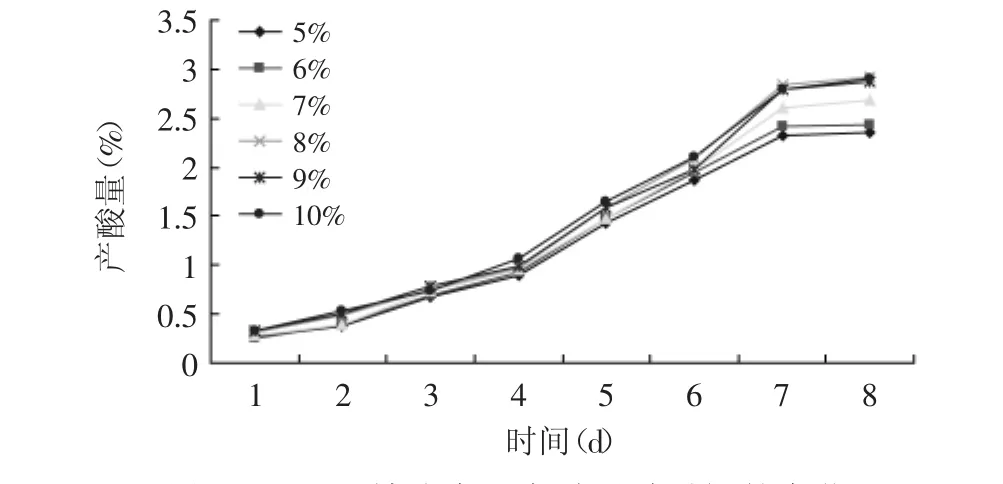
图6 不同酒精浓度下产酸量随时间的变化Fig.6 Acid output changes over time with different alcohol
由图6可知,发酵液初始酒精度在10%vol范围内总产酸量呈逐渐升高的变化趋势,酒精度为8%vol时产酸量最大,酒精含量继续升高,醋酸得率反而降低,因为在发酵初期,高浓度酒精会抑制醋酸菌的生长和代谢,使产酸量下降,并且使发酵周期延长。所以最佳初始酒精度为8%vol。
2.2.4 最佳醋酸发酵工艺参数确定 野生番石榴果醋醋酸发酵正交实验结果见表5。
由表5分析得知:考虑酸度值:从K值可以得出醋酸发酵实验最佳组合为A2B2C1,即温度38℃、醋酸菌接种量10%、初始酒精度为6%vol;比较实验中A、B、C极差R值的大小,RA>RB>RC,得出3个因素的主次关系是:醋酸发酵温度>醋酸菌接种量>酒精度。对感官评定K值进行分析可以得出醋酸发酵实验最佳组合为A1B3C2,即温度36℃、醋酸菌接种量12%、酒精度为7%vol;比较实验中A、B、C极差R值的大小,RC>RB>RA,得出3个因素的主次关系是:酒精度>醋酸菌接种量>醋酸发酵温度。
醋酸发酵正交实验结果的方差分析情况见表6。
由表6方差分析得出结论。对酸度值的方差分析结果:FA>F0.01(2,2);F0.05(2,2)<FB<F0.01(2,2);FC<F0.05(2,2)。说明醋酸发酵温度对产酸量影响最大,差异极显著;醋酸菌接种量对产酸量影响次之,差异显著;酒精度对醋酸含量影响差异不显著,对产酸的影响相对于其他因素而言较弱。因此影响番石榴醋酸发酵的各因素中,依次为醋酸发酵温度>醋酸菌接种量>酒精度。对感官评定值的方差分析结果:FA<F0.05(2,2);FB<F0.05(2,2);FC<F0.05(2,2)。说明醋酸发酵温度、醋酸菌接种量和酒精度对醋酸含量影响都不大,差异不显著,主要是由于感官评定受很多因素的影响,如时间、地点、温度、鉴评人员的身体状况等;影响番石榴醋酸发酵的各因素中,依次为酒精度>醋酸菌接种量>醋酸发酵温度。结合酸度值和感官评定值的R值和方差分析结果综合考虑,得出以下结论:即醋酸发酵实验最佳组合为A2B2C2,即温度38℃、醋酸菌接种量10%、酒精度为7%vol。
2.3 产品质量和标准
2.3.1 感官指标 产品色泽为浅黄色;滋味酸甜可口,浓郁醇厚;具有野生番石榴特有的芳香,以及酿造果醋所产生的醋酸味;组织状态无杂质,无沉淀。
2.3.2 理化指标 总酸度(以醋酸计):2.94g/100mL;可溶性固形物:2.56g/100mL;还原糖(以葡萄糖计):1.30g/100mL;乙醇体积分数:0.53g/100mL;pH:3.64。
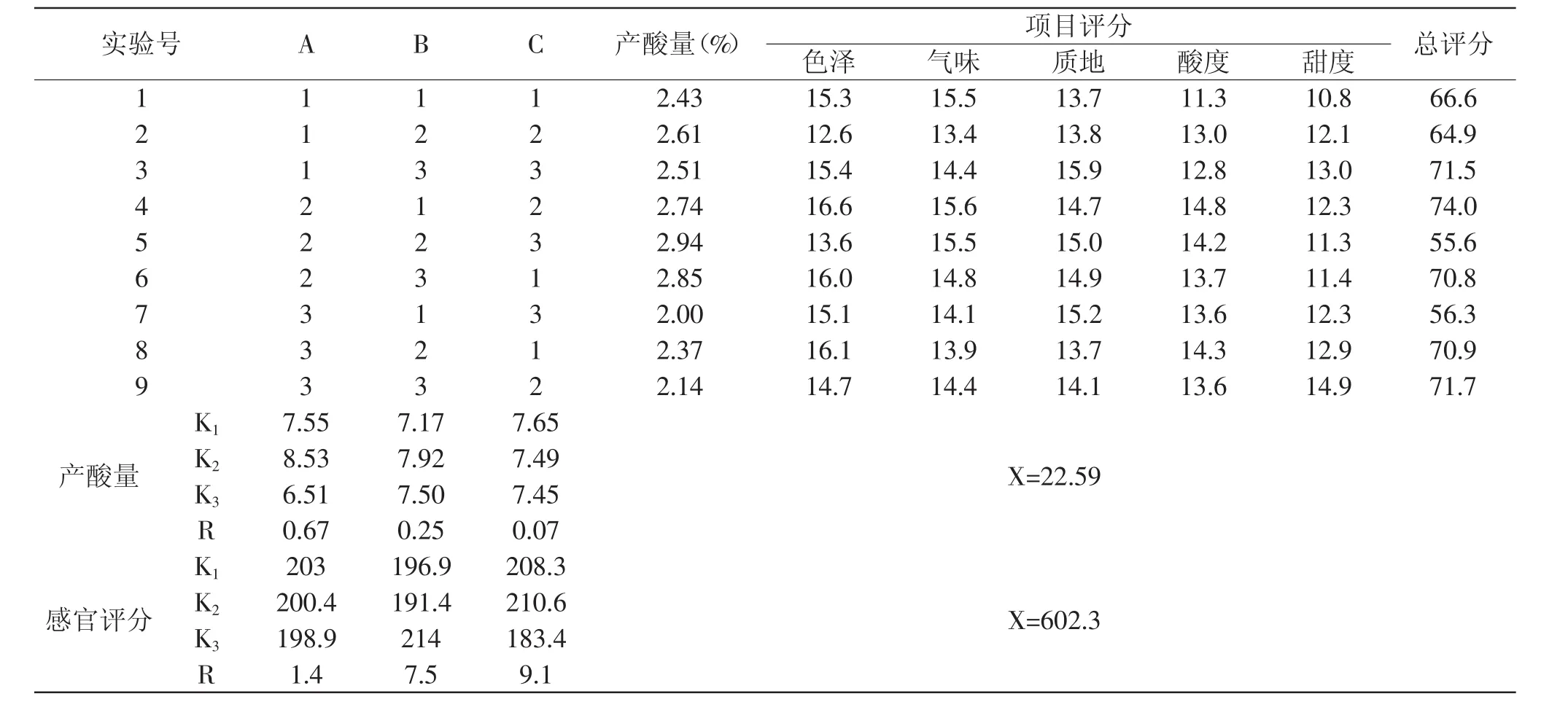
表5 醋酸发酵正交实验结果Table 5 Result of orthogonal experiment for optimizing the acetic acid fermentation
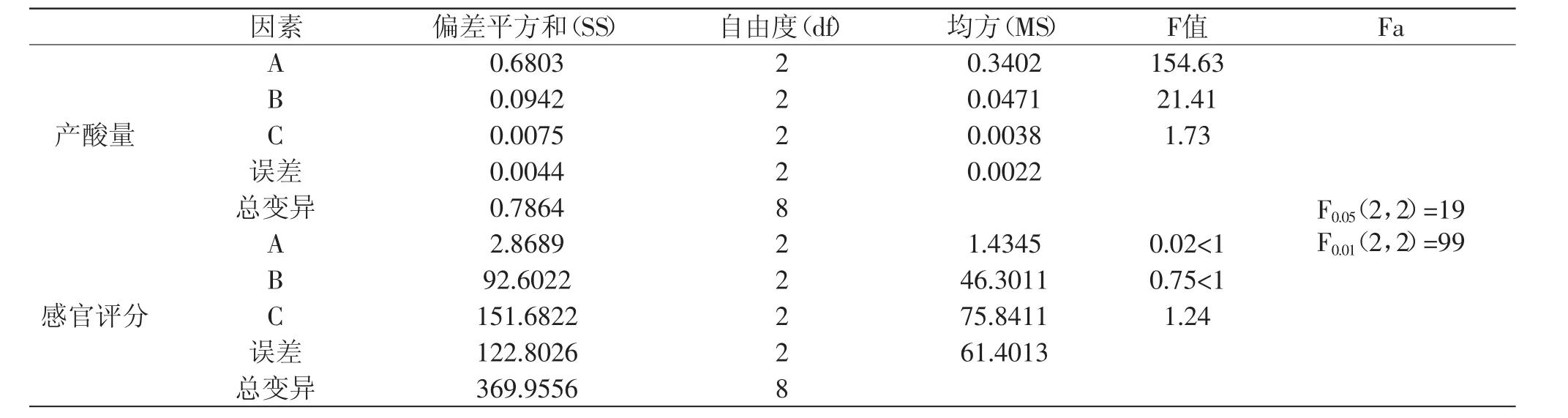
表6 醋酸发酵正交实验结果的方差分析Table 6 Analysis of variance in orthogonal experiment of acetic fermentation
2.3.3 微生物指标 菌落总数≤100cfu/mL;大肠杆菌≤3MPN/dL;致病菌:不得检出。
3 结论
3.1 为了提高野生番石榴的经济价值,对其进行深加工,研发生产具有保健功能的特色产品。以野生番石榴果实为原料,经分选、清洗、破碎打浆、成分调整后进行酒精发酵和醋酸发酵,再经过陈酿、过滤澄清,然后在60~70℃下杀菌10min,冷却后即可生产出番石榴果醋。
3.2 酒精发酵和醋酸发酵过程的单因素实验和正交实验表明,酒精发酵的最佳工艺条件为:酵母菌接种量0.15%,糖度18%,发酵温度32℃;醋酸发酵的最佳工艺条件为:醋酸菌接种量10%,初始酒精度7%vol,发酵温度38℃。
番石榴果醋既具有野生番石榴特有的风味和营养价值,又有醋的营养成分和保健功能,因此不仅可以用作食醋,还可以根据需要将番石榴原醋经过调配后制成风味独特、酸甜适口的醋饮料,为番石榴野生资源的开发利用和丰富果醋市场提供参考。
[1]杨少桧.番石榴—热带水果保鲜技术[J].保鲜与加工,2005,5(4):47-48.
[2]阮贤聪,罗金棠.我国南亚热带地区番石榴产业发展现状和对策[J].中国园艺文摘,2010,26(9):51-52,57.
[3]Rosa Martha P G,Sylvia M,Rosario V S.Psidium guajava:A review of its traditional uses,phytochemistry and pharmacology [J].Journal of Ethnopharmacology,2008,117:1-27.
[4]吴国卿,王文平,陈燕.果醋开发意义、工艺研究及果醋类型[J].饮料工业,2010,13(4):14-17.
[5]于辉,钟显昌.番石榴果酒的研制[J].中国酿造,2008,13(7):98-100.
[6]许文江,林清洪,林杰,等.番石榴原浆及饮料生产工艺研究(简报)[J].亚热带植物科学,2006,34(5):62,65.
[7]黄大川.富硒猕猴桃发酵果醋生产工艺优化研究[J].食品工业科技,2007,28(8):153-156.
[8]武运,周建中,李凯君,等.葡萄果醋酒精发酵过程工艺的研究[J].中国酿造,2010,216(3):113-115.
[9]赵丽芹,张子德.园艺产品贮藏加工学[M].北京:中国轻工业出版社,2011.
[10]曹雪丹,方修贵.柑橘果醋研究进展[J].浙江柑橘,2009,26(1):32-35.
[11]朱宝镛.葡萄酒工业手册[M].北京:中国轻工业出版社,1995.
[12]崔彩云,陈国刚,王兴应,等.哈密瓜果醋发酵工艺的研究[J].中国农学通报,2010,26(20):86-89.
[13]张赞,梁美霞,席超,等.优势醋酸菌株QA-9号选育及其初步鉴定[J].中国酿造,2010,216(3):46-48.
[14]罗云波,蔡同一.园艺产品贮藏加工学(加工篇)[M].北京:中国农业大学出版社,2001.
[15]宁恩创,刘小玲,林钦,等.火龙果果醋及其醋饮料的工艺研究[J].中国酿造,2008,180(3):82-84,94.
[16]曹建康,姜微波,赵玉梅.果蔬采后生理生化实验指导[M].北京:中国轻工业出版社,2007.
[17]魏冬梅,张艳芳,张予林.利用比色法测定葡萄酒的酒精度[J].食品工业,2001(4):45-46.
[18]陈丽.李子保健果醋饮料的工艺研究[J].中国酿造,2009,205(4):164-166.
[19]董贝森.梨汁醋酸菌发酵饮料的研究[J].西南农业大学学报,1998,20(3):239-242.
[20]贺江,樊明涛,包飞.多菌种共固定化技术酿造苹果醋研究[J].中国食物与营养,2008(11):35-38.
Optimization on processing technology of wild guava vinegar
TANG Qing-yan1,LIN Qi1,LI Yong-ping2,*
(1.Faculty of Food Science and Technology,Yunnan Agricultural University,Kunming 650201,China;2.Yunnan Agro-technological Extension General Station,Kunming 650032,China)
The basis and reference for the industrialization of wild guava vinegar were provided through the research on the technical condition of processing.Wild guava was used as raw material to produce nutrient vinegar in the experiment,through alcoholic fermentation and acetic acid fermentation after selecting,washing,pulping,composition adjustment,then filtering,sterilizing at 60~70℃ for 10min,and filling in the bottles and so on.The process and parameters of alcoholic fermentation and acetic acid fermentation were optimized by single factor test and orthogonal experiment.The results showed that the optimum alcoholic fermentation conditions were as follows:the inoculation ratio 0.15%,the initial sugar concentration 18%,fermentation temperature 32℃;the optimum acetic acid fermentation was that the inoculating acetic acid bacillus 10%,alcohol content 7%vol,fermentation temperature 38℃.
wild guava;fruit vinegar;alcoholic fermentation;acetic acid fermentation
TS275.5
B
1002-0306(2012)07-0211-06
2011-07-11 *通讯联系人
唐卿雁(1980-),女,硕士,讲师,研究方向:园艺产品贮藏及深加工。
云南省教育厅科学研究基金(A3006593)。

