二氢苯骈[c]菲啶类生物碱的制备及其抗乙肝病毒的活性
吴颖瑞,方 宏,牙始康,何瑞杰
(1.中国科学院广西植物研究所 广西植物功能物质研究与利用重点实验室,广西 桂林541006;2.广西中医药研究院,广西 南宁530022)
二氢苯骈[c]菲啶类生物碱的制备及其抗乙肝病毒的活性
吴颖瑞1*,方 宏1,牙始康2,何瑞杰1
(1.中国科学院广西植物研究所 广西植物功能物质研究与利用重点实验室,广西 桂林541006;2.广西中医药研究院,广西 南宁530022)
二氢苯骈[c]菲啶类生物碱是自然界中一类重要的生物活性成分,但含量很低.利用硼氢化还原方法,对博落回粗提物中的血根碱和白屈菜红碱混合物进行还原、分离,得到了二氢血根碱和二氢白屈菜红碱;并初步评价了其抗乙肝病毒活性.结果表明,利用硼氢化还原方法制备二氢苯骈[c]菲啶类生物碱的产率较高,还原产物具有一定的抗乙肝病毒活性.
二氢苯骈[c]菲啶类生物碱;二氢血根碱;二氢白屈菜红碱;制备;抗乙肝病毒活性
苯骈[c]菲啶类生物碱是一类重要的天然有机物,其中完全芳香化苯骈[c]菲啶类生物碱是一个平面型的分子,分子中季铵离子的亲电性使它能与反转录酶形成三维复合物,据推测,这是它关键的活性点位[1].苯骈[c]菲啶类生物碱可以嵌入DNA,通过抑制DNA、RNA聚合酶的活性从而抑制蛋白质的合成[2-3].目前这一类型的化合物已有合成(如NK109)并作为抗癌药物进入了临床研究.从植物中分离得到的二氢苯骈[c]菲啶类生物碱具有抗 HIV[4],抗菌[5-6]、杀虫[7]、抗白血病[8]等活性,但是报道的文献不多;另一方面,自然界中这类化合物含量低,通过分离这类化合物进行活性研究,存在一定的困难,需要找到一个便捷、产量高的制备方法.
博落回为罂粟科植物Macleayacordata(Willd)R.B.,为我国广泛分布的野生植物品种,其主要成分为血根碱(sanguinarine)和白屈菜红碱(chelerythrine)等,这是完全芳香化的苯骈[c]菲啶生物碱,可以作为制备二氢苯骈[c]菲啶类生物碱的原料.另外,人们在合成苯骈[c]菲啶类生物碱时,也探讨了这类化合物的还原方法[9].作者通过使用硼氢化还原法,还原博落回提取物,制备了二氢血根碱和二氢白屈菜红碱,并对还原产物进行了抗乙肝病毒的活性实验.血根碱、白屈菜红碱及其还原产物的结构见图1.
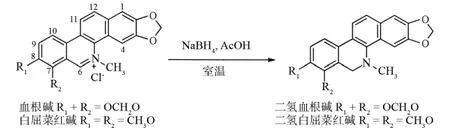
图1 血根碱、白屈菜红碱及其还原产物Fig.1 Structures of sanguinarine,chelerythrine and their reduced products
1 实验部分
1.1 试剂与仪器
XRC-1型熔点仪;VG Auto spec-3000,Bruker AM-400(400MHz/100MHz)核磁共振仪,TMS 为内标.柱色谱硅胶(100~200、200~300目)、薄层色谱硅胶G和GF 254型硅胶为青岛海洋化工厂产品;改良碘化铋钾试剂为实验室自配,所用试剂均为分析纯.乙肝表面抗原(HbsAg)和表面e抗原(HBeAg)检测试剂盒为上海科华生物工程股份有限公司产品.
1.2 血根碱、白屈菜红碱的提取
博落回植物采自广西植物研究所后山,由广西植物研究所分类学专家韦发南教授鉴定为罂粟科植物Macleayacordata(Willd.)R.B.取植物地上根茎5kg,阴干后粉碎,用0.5% 盐酸8.0L溶液热浸泡3次,每次3h.合并浸出液,用NH3·H2O调pH到10,搅匀,静止48h后,过滤,沉淀于50℃烘干,得到灰色状的生物碱粗品198g,,得率约为4%.
1.3 二氢血根碱、二氢白屈菜红碱的制备与分离
在通风柜里室温条件下,取制备得到的博落回生物碱粗品50g,在甲酸中搅拌溶解,分少量多次加入约600g左右的硼氢化钠,以TLC检测反应进程.反应结束后,继续在室温下搅拌30min,冷却后的反应混合物用10%的NaOH水溶液调pH到10左右,然后使用氯仿萃取,有机层用无水Na2SO4脱水后,减压回收溶剂,得到灰色的胶状物37g,收率为74%.
取还原产物10g,氯仿溶解后以适量的硅胶拌样,使用硅胶为分离材料,减压柱层析,使用石油醚/乙酸乙酯(体积比25∶1~5∶1)进行梯度洗脱,分别得到化合物(1)1.2g,化合物(2)1.4g,得率分别为12%与14%.
化合物(1).白色晶体(氯仿-甲醇),mp 169~171 ℃.[C20H16NO4]+;FAB-MSm/z:334([M]+,100).1H NMR(C5D5N,400MHz)δ:7.87(1H,d,J=8.0Hz,H-11),7.85(1H,s,H-4),7.62(1H,d,J=8.0Hz,H-12),7.45(1H,d,J=8.0Hz,H-10),7.30(1H,s,H-1),6.98(1H,d,J=8.0Hz,H-9),4.28(2H,s,H-6),6.06(2H,s,OCH2O-2,3),6.03(2H,s,OCH2O-7,8),2.56(3H,s,-NCH3).13C NMR (C5D5N,100MHz)δ:104.8(C-1),148.8(C-2),148.2(C-3),101.1(C-4),127.0(C-14),142.9(C-15),48.7(C-6),113.9(C-17),145.2(C-7),147.8(C-8),107.7(C-9),116.8(C-10),124.9(C-18),127.5(C-16),120.9(C-11),124.5(C-12),131.5(C-13),41.5(NCH3),101.8(OCH2O-2,3),102.0(OCH2O-7,8).以上数据与文献报道一致[10],故鉴定化合物(1)为二氢血根碱.
化合物(2).无色晶体(氯仿-甲醇),mp 169~171℃.[C21H20NO4]+,FAB-MSm/z:350(100).1HNMR (C5D5N,400MHz)δ:7.92(1H,d,J=8.5Hz,H-11),7.89(1H,s,H-1),7.70(1H,d,J=8.4Hz,H-10),7.65(1H,d,J=8.5Hz,H-12),7.38(1H,s,H-4),7.05(1H,d,J=8.4 Hz,H-9),6.06(2H,s,OCH2O-2,3),4.42(2H,s,H-6),3.86(3H,s,OCH3-8),3.78(3H,s,OCH3-7),2.60(3H,s,NCH3),2.64(1H,dd,J=15.9,3.6Hz,H-1′a),2.38(1H,brm,H-1′b),2.07(3H,s,H-3′).13C NMR(C5D5N,100MHz)δ:104.9(C-1),148.7(C-2),148.4(C-3),101.1(C-4),127.0(C-14),143.2(C-15),49.2(C-6),126.5(C-17),146.7(C-7),153.0(C-8),111.9(C-9),119.2(C-10),126.4(C-18),124.2(C-16),120.8(C-11),124.4(C-12),131.5(C-13),55.8(OCH3-7),60.9(OCH3-8),101.8(OCH2O-2,3),41.1(NCH3),46.6(C-1′),206.3(C-2′),30.2(C-3′).以上数据与文献报道一致[11],故鉴定化合物(2)为二氢白屈菜红碱.
1.4 二氢血根碱、二氢白屈菜红碱的生物活性
药物用DMSO溶解为母液,临用前用细胞培养液将母液稀释,处于对数生长期的HepG2 2.2.15细胞在96孔细胞培养板中培养48h后,加入不同浓度含药培养液,继续培养9d,以MTT法检测,(1)和(2)均未发现细胞毒性;HepG2 2.2.15细胞在96孔细胞培养板中培养48h后,加入所配不同浓度含药培养液,继续培养9d(每3d换液一次),收集上清液,用HBsAg诊断试剂盒(ELISA)检测HBsAg,实验结果见表1.结果显示,化合物二氢血根碱和二氢白屈菜红碱均有抑制HBV s抗原的作用.

表1 二氢血根碱、二氢白屈菜红碱抗乙肝病毒的活性Table 1 Inhibitory activities of dihydrosanguinarine and dihydrochelerythrine against HBsAg and HBeAg secretions in Hep G2.2.15cell line
2 结果与讨论
2.1 反应原料的制备
使用先分离后还原的方法,制备反应产物,过程复杂,产率低[12].博落回生物碱中的血根碱与白屈菜红碱都属于苯骈菲啶的衍生物,以季铵盐的形式存在,结构相似,极性大,使用一般的分离材料,难分离出单体化合物.文献报道,反复使用重结晶和化学方法转化,分离血根碱与白屈菜红碱单体化合物,得率低于万分之一.使用先还原原料混合物后分离目标产物的方法,产率大于0.3%.
2.2 还原方法的应用
还原反应常用的有金属还原剂,如锂,钠、锌和铁粉等,在实验中也尝试了使用锌粉与盐酸的还原方法,但是还原不完全,产率低.使用硼氢化钠还原法,在室温就可以完成,条件温和,产率高,是制备二氢苯骈[c]菲啶类生物碱较理想的方法.
结论:使用硼氢化钠还原的方法,对植物中完全芳香化的苯骈[c]菲啶生物碱进行了还原,反应产物容易分离,产率高,可以满足活性实验的要求.另一方面,活性的研究结果表明,二氢苯骈[c]菲啶类生物碱具有抗乙肝病毒的活性,民间利用博落回治疗肝炎,可能与这类生物碱有关.
感谢复旦大学药学院周珮教授在化合物活性测定方面给予的大力支持.
[1]KERRY M A,DUVAL O,WAIGH R D,et al.The role of the iminium bond in the inhibition of reverse transcriptase by quaternary benzophenanthridines[J].J Pharm Pharmacol,1998,50(11):1307-1315.
[2]TORRES C A,BÁEZ A.Effects of the antitumor drugs 3-nitrobenzothiazolo[3,2-alpha]quinolinium and fagaronine on nucleic acid and protein synthesis[J].Biochem Pharmac,1986,35(4):679-685.
[3]SETHI V S.Inhibition of mammalian and oncornavirus nucleic acid polymerase activities by alkoxybenzophenanthridine alkaloids[J].Cancer Res,1976,35:2390-2395.
[4]CHANG Y C,HSIEH P W,CHANG F R,et al.Two new protopines argemexicaines A and B and the anti-HIV alkaloid,6-acetonyldihydrocherythrine,from formosan argemone mexicana[J].Planta Medica,2003,69(2):148-152.
[5]TARUS P K,COOMBES P H,CROUCH N R,et al.Benzo[c]phenanthridine alkaloids from stem bark of the forest knobwood,zanthoxylum davyi(rutaceae)[J].South Afric J Botany,2006,72(4):555-558.
[6]SANCHEZ A E,HERNANDEZ M L R,SANCHEZ S J L,et al.Alkaloids from bocconia frutescens and biological activity of their extracts[J].Pharmac Biolog,2006,44(7):540-543.
[7]冯 岗,张 静,冯俊涛,等.小果博落回中2种杀虫活性成分的分离及鉴定[J].西北植物学报,2008,28(1):179-182.
[8]VRBA J,DOLEZEL P,VICAR J V,et al.Chelerythrine and dihydrochelerythrine induce G1phase arrest and bimodal cell death in human leukemia HL-60cells[J].Toxicol Vitro,2008,22(4):1008-1017.
[9]ISHII H,ISHIKAWA T,ICHIKAWA Y,et al.Studies on the chemical constituents of rutaceous plants.LV.The development of a versatile method for the synthesis of antitumor-active benzo[c]phenanthridine alkaloids.(5).A new method for quaternization of the benzo[c]phenanthridine nucleus[J].Chem Pharmac Bull,1984,32(8):2984-2994.
[10]HALBSGUTH C,MEISSNER O,HÄBERLEIN H,Positive cooperation of protoberberine type 2alkaloids from corydalis cava on the GABAA binding site[J].Planta Medica,2003,69:305-309.
[11]OECHSLIN S M K,OECHSLIN M K,WRIGHT A D,et al.An NMR study of four benzophenanthridine alkaloids[J].J Nat Prod,1991,54:519-524.
[12]胡之璧,徐 垠,冯胜初,等,博落回果实中有效成分的研究[J].药学学报,1979,14(9):535-540.
Preparation of dihydrobenzo[c]phenanthridine alkaloids and evaluation of their anti-hepatitis B virus activity
Dihydro-benzo[c]phenanthridine alkaloids are a kind of bioactive constituents,but their contents are very low in natural plants.Thus the mixture of sanguinarine and chelerythrine primarily extracted from Macleaya cordata (Willd)R B were reduced by sodium borohydride and separated into dihydrosanguinarine and dihydrochelerythrine.The anti-hepatitis B virus(HBV)activity of as-obtained dihydrosanguinarine and dihydrochelerythrine was evaluated.It has been found that phenanthridine alkaloids can be obtained in a high yield viathe reduction of sanguinarine and chelerythrine by borohydride.As-obtained dihydrosanguinarine and dihydrochelerythrine products have some inhibitory effect against HBV(HBsAg secretions in Hep G2.2.15cell line).
dihydro-benzo[c]phenanthridine alkaloids;dihydrosanguinarine;dihydrochelerythrine;preparation;anti-HBV activity
O 063.2
A
1008-1011(2012)04-0056-04
2011-12-25.
广西自然科学基金资助项目(0832021).
吴颖瑞(1966-),男,副研究员,博士,主要从事抗病毒、抗菌的植物活性成分研究.E-mail:wyrui@yanhoo.com.

