不同游离方式辣椒小孢子的胚胎发生
成 妍 ,巫东堂,马蓉丽,魏学红,焦彦生 ,吴海涛
(1.山西大学生命科学学院,山西太原030006;2.山西省农业科学院蔬菜研究所,山西太原030032;3.山西大学化工学院,山西太原030006)
辣椒(Capsicum annuum L.)原产于中美洲和美洲的热带地区,在世界各地普遍种植,是人们广为熟知的一种蔬菜和调料品,营养价值极高[1]。辣椒种质资源变异丰富,根据其果实形态的不同,可以划分为甜椒、牛角椒、羊角椒、线椒和朝天椒等类型。由于辣椒是常异花授粉植物,杂种优势十分明显。因此,进行辣椒单倍体培养技术的研究,对于选育具有突出优点的亲本品系、加速育种进程、培育强优势辣椒组合具有非常重要的意义[2]。
目前,花药培养已经成为获取辣椒单倍体较成熟的技术,已被应用于辣椒的遗传育种工作中[3-5]。游离小孢子培养与花药培养相比,具有不可比拟的优势,不仅能避免愈伤组织和体细胞胚的产生,而且单倍体再生率较高[6]。同时,小孢子的单倍性和单细胞特性可以为遗传转化提供好的机会[7]。然而,目前有关辣椒游离小孢子培养的成功报道较少,远远没有达到建立起完善的、高频的小孢子培养再生体系的程度,还不能应用于遗传育种或基础性研究[8],因此,非常有必要对辣椒游离小孢子培养技术进行深入细致的探索研究。
在前人研究的基础上,本试验以甜椒、牛角椒、羊角椒、线椒和朝天椒5个不同类型的10个辣椒品种为试材,研究直接机械游离、看护培养自然游离和先花药预培养再机械游离3种不同的小孢子游离方式下辣椒小孢子的胚胎发生情况,旨在为推动辣椒游离小孢子培养的实用化研究奠定基础。
1 材料和方法
1.1 试验材料
试验共采用10个辣椒品种(表1)。2010年12月下旬播种于山西省农业科学院蔬菜研究所辣椒课题组北营菜地,2011年2月下旬定植于试验地温室内,开花期间及时整理花枝,常规水肥管理,并注意控制病虫害的发生。

表1 供试10个辣椒品种及其类型和来源
1.2 方法
于盛花期开始,每天 7:00—8:00 或 17:00以后从各品种健壮植株上摘取花药尖端呈微紫色的花蕾(此时花蕾的小孢子大多处于单核靠边期)[9-10]放入自封袋中,装入冰盒带回实验室,置于4℃冰箱中预处理2 d。每次取3~5株的花蕾混合,以消除可能的单株间差异。
在超净工作台上,将花蕾放在70%的酒精中浸泡30 s后,用无菌水冲洗1次,再用0.1%升汞消毒8 min,然后用无菌水冲洗4次,每次5 min。用无菌滤纸吸干花蕾表面水分后,进行3种游离方式处理。
1.2.1 直接机械游离 在Y培养基(即蔗糖饥饿培养基,含有0.37 mol/L麦芽糖,10 mmol/LCaCl2,1 mmol/LMgSO4·7H2O,1 mmol/LKNO3,200 μmol/L KH2PO4,1 μmol/LKI,100 nmol/LCuSO4·5H2O,pH值为5.8)[11]中,采用挤压法使小孢子游离出来,并且依次经75,38 μm的细胞筛过滤。滤液经400 r/min离心4 min,弃上清液,再用Y培养基悬浮小孢子并离心,重复3次至上清液无色透明,弃上清液,沉淀即为纯化的小孢子。最后用Y培养基悬浮小孢子,并用血球计数板计数,调整小孢子密度约为1.0×105个/mL。每个培养皿(60 mm×15 mm)中分装2 mL小孢子悬浮液,接种后用Parafilm膜封口。32℃下暗培养2 d后,回收小孢子,并用NLN液体培养基(含9%蔗糖)清洗,然后更换为NLN培养基,在25℃下悬浮暗培养。
1.2.2 看护培养自然游离 在无菌滤纸上,用消毒后的镊子和解剖刀从花蕾中剥出花药(除净花丝),接种于固液双层培养基(下层固体培养基为:NLN+2%麦芽糖+1%活性炭+0.6%琼脂,pH值为5.8;上层液体培养基为:NLN+2%麦芽糖+2.5 μmol/LZT+5 μmol/LIAA,pH 值为 5.8)[12]中,每瓶接种20~24个花药,将接种了花药的培养瓶放入35℃的恒温培养箱中黑暗预培养7 d,后转入25℃下进行暗培养。
1.2.3 先花药预培养再机械游离 同1.2.2方法,将花药接种于盛有固体培养基(KM+1 mg/L NAA+2 mg/L KT+1 mg/L BA+0.6%琼脂+10%葡萄糖,pH值为5.8)的培养瓶中。每瓶接种20~24个花药。在33℃下暗培养7 d后,选取无污染无褐化且膨大的花药进行机械游离。小孢子的游离、纯化和密度调整方法同1.2.1,游离的小孢子仅经过75 μm细胞筛过滤。所用洗液为:MS+3%蔗糖,pH值5.8;培养基为:KM+1 mg/L NAA+2 mg/L KT+1 mg/L BA+10%葡萄糖,pH值为5.8。将分装好小孢子悬浮液的培养皿置于25℃下进行暗培养。
3种游离方式处理的液体培养基均采用过滤灭菌(依次通过0.45,0.22 μm的微孔滤膜),固体培养基均采用高压灭菌。各处理每品种接种5个培养瓶或皿,重复3次。
1.2.2和1.2.3方法接种7 d后统计褐化率(发生褐化的花药占接种花药总数的百分率);接种35 d后统计和分析各处理胚状体产量(平均每瓶或皿获得的胚状体个数,包括球形胚、心形胚和子叶形胚等各时期的胚状体)和子叶形胚状体产量(平均每瓶或皿获得的子叶形胚胚状体个数)。
1.3 数据分析
采用Microsoft Excel软件处理数据,用DPS软件进行显著性检验。
2 结果与分析
2.1 直接机械游离小孢子的胚胎发生情况
直接机械游离小孢子接种后20 d,肉眼可见大小不均的球形胚出现,呈乳白色。供试的10份材料中,仅3号产生了大小不均的球形胚(表2),但获得的球形胚不能进一步发育形成子叶形胚,因此,再生植株比较困难。其余材料中有部分基因型的游离小孢子或出现膨大,或已启动分裂,但最终未能继续分裂形成胚状体。
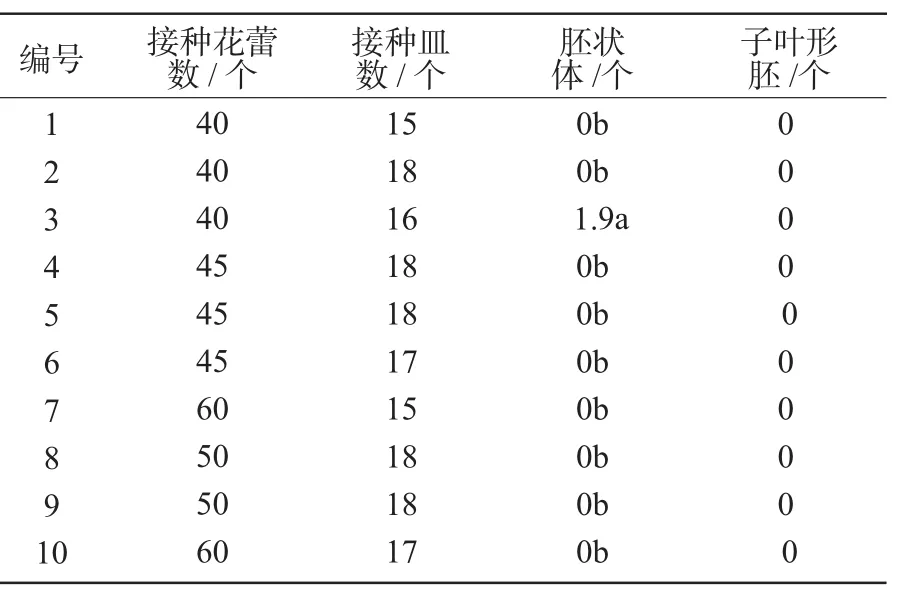
表2 直接机械游离小孢子的胚胎发生情况
2.2 看护培养自然游离小孢子的胚胎发生情况
看护培养的花药接种后漂浮在上层液体培养基表面。培养1 d后,花药沉到下层固体培养基上。培养7 d后,部分花药发生褐化死亡。培养2~3周时,未褐化的花药正常开裂,释放出小孢子进入培养基。培养4周后,可以看到球形胚和心形胚。培养5周后,球形胚和心形胚发育到鱼雷形和子叶形胚。大多数胚状体来自释放的小孢子而不是来自黏附于花药壁的小孢子。
在10份试验材料中,分别从2,3,5号中获得了胚状体(表3)。其中,产量最高的是3号,为每瓶2.2个,最低的是2号,为每瓶0.4个。仅3,5号获得子叶形胚,2号获得的球形胚很难再生植株。各材料之间褐化率存在明显差异,7号褐化率高达79.9%,胚胎发生较好的3号褐化率最低,为36.5%。诱导胚胎发生的3份材料的褐化率均低于50%,说明在看护培养中花药褐化严重影响小孢子的胚胎发生。
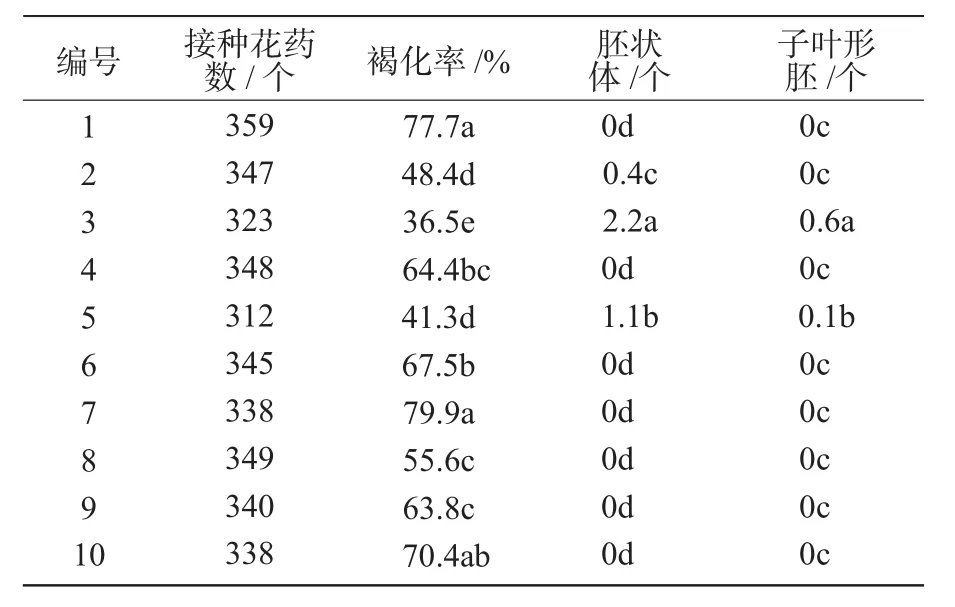
表3 看护培养自然游离小孢子的胚胎发生情况
2.3 先花药预培养再机械游离小孢子的胚胎发生情况
花药在高温预培养过程中,部分发生褐化变黑。经过7 d的预培养后,反应的花药体积膨大,大小增大到原来体积的1.5倍左右。通过选取无污染无褐化且膨大的花药进行机械游离小孢子,聚集了已启动雄核发育的小孢子,因此,胚胎发生效果好于前2种游离方式(表4)。不仅在看护培养中有胚状体产生的2,3,5号材料有子叶形胚产生,而且在看护培养中没有胚胎发生的4,8号材料也获得了胚状体,其中,8号材料还有子叶形胚形成。但是,各材料花药预培养后的褐化率均高于看护培养,这可能是由于看护培养中的花药在浅层液体培养基中既能保持通气,又能与培养基充分接触,从而延缓了花药褐化。
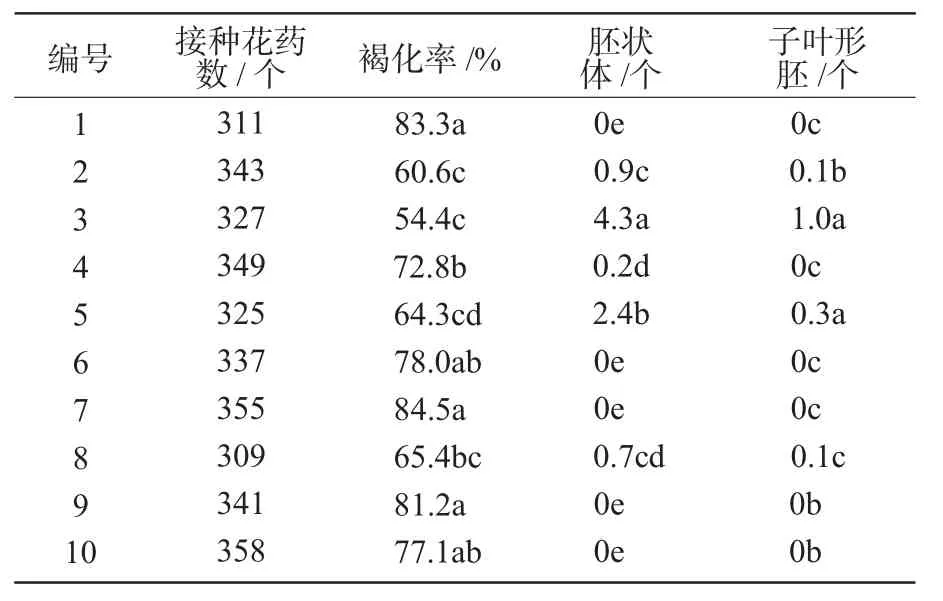
表4 先花药预培养再机械游离小孢子的胚胎发生情况
3 结论与讨论
通过直接机械游离小孢子的方式诱导胚胎发生,在十字花科芸薹属和禾本科作物上都取得了较大成功[13]。本试验中,供试的10份不同基因型材料通过直接机械游离小孢子的方式仅有1份启动雄核发育,获得了球形胚,但这些球形胚从此停止发育,不能进一步形成再生能力较强的子叶形胚。辣椒小孢子直接机械游离后很难存活[14],可见,不同作物种类对小孢子游离方式的适应能力有明显差异。
然而,Kim等[11]采用相同的小孢子分离方法,每皿胚产量高达54个,平均子叶形胚产量可达5.5个。培养效果差异如此之大,从一个角度证明了基因型的重要影响;另一方面可能是由于其采用Percoll密度梯度离心聚集了已启动雄核发育的小孢子。可见,分离过程中的每一个细节都会影响辣椒小孢子的胚胎发生能力,有关直接机械游离进行小孢子培养的技术还需进一步探索研究。
本试验通过看护培养自然游离小孢子和先花药预培养再机械游离小孢子的胚胎发生情况好于直接机械游离小孢子,说明辣椒小孢子最初的脱分化对花药壁有依赖作用。花药壁组织在小孢子培养前期作用十分重要,不但能保持适当的渗透压,还能从培养基中吸收营养,供小孢子进一步生长发育。
相比先花药预培养再机械游离小孢子方式,看护培养自然释放方式不会对小孢子造成损伤,但培养效果不佳。这可能是由于高温预培养后,花药壁组织处于衰老状态,不仅不能从培养基中吸收营养,而且本身的营养物质也被耗尽,影响花粉胚状体的形成和完全发育。通过机械游离使花药壁及时破裂,有利于多核花粉和球形胚吸收营养并继续发育。就花药预培养过程中的褐化问题,可参考辣椒花药培养研究,在培养基中添加一定量的AgNO3或Vc,抑制乙烯产生,从而降低花药的褐化率[15-16]。
[1]Kothari S L,Joshi A,Kachhwaha S,et al.Chilli peppers-a review on tissue culture and transgenesis[J].Biotechnol Adv,2010,28:35-48.
[2]王玉英,郭敬三,王敬驹.小黑麦和辣椒花粉植株的诱导[J].中国科学,1973(1):104-105.
[3]陈肖师.甜椒花药培养及“塞花一号”的育成[J].中国蔬菜,1988(3):5-7.
[4]李春玲,蒋仲仁.甜椒花培新品种“海花三号”的育成[J].园艺学报,1990,17(1):39-44.
[5]邢永萍,张树根,张军民,等.保护地甜椒新品种海丰26号选育初报[J].辣椒杂志,2003(3):22-23.
[6]Bal U,Abak K.Haploidy in tomato(Lycopersicon esculentum Mill.):a critical review[J].Euphytica,2007,158:1-9.
[7]陈斌,耿三省,张晓芬,等.辣椒单倍体培养研究进展[J].长江蔬菜,2007(12):36-41.
[8]成妍,马蓉丽,焦彦生,等.辣椒游离小孢子培养研究进展[J].山西农业科学,2012,40(3):288-291.
[9]张菊平,巩振辉,刘珂珂,等.辣椒小孢子发育时期与花器形态的相关性 [J].西北农林科技大学学报,2007,35(3):153-158.
[10]张芳,李海涛,张馨宇.不同基因型辣椒相同花器外部形态小孢子发育时期的差异[J].中国蔬菜,2009(10):23-27.
[11]Kim M,Jang I C,Kim J A,et al.Embryogenesis and plant regeneration of hot pepper(Capsicum annuum L.)through isolated microspore culture[J].Plant Cell Rep,2008,27(3):425-434.
[12]Supena E D J,Suharsono S,Jacobsen E,et al.Successful development of a shed-microspore culture protocol for doubled haploid production in Indonesian hot pepper(Capsicum annuum L.)[J].Plant Cell Rep,2006,25:1-10.
[13]成妍,班青宇,王倩,等.不结球白菜游离小孢子培养及再生植株的倍性鉴定 [J].南京农业大学学报,2009,32(2):25-29.
[14]王烨,张宝玺,连勇,等.不同预处理对辣椒小孢子存活率的影响[J].中国蔬菜,2004(4):4-6.
[15]Santana-Buzzy N,Canto-Flick A,Iglesias-Andreu L G,et al.Improvement of in vitro culturing of Habanero pepper by inhibition ofethylene effects[J].Hort Science,2006,41:405-409.
[16]刘广霞,张晓伟,蒋武生,等.温度及培养基中添加物对辣椒花药培养胚状体诱导的影响 [J].河南农业科学,2009(5):97-100.

