莫沙必利改善夜间消化不良症状的随机、双盲、安慰剂平行对照研究
颜秀娟 冯晨晨 刘宗亮 季洁如 陈胜良*
上海交通大学医学院附属仁济医院消化内科 上海市消化疾病研究所(200001)
功能性消化不良(functional dyspepsia,FD)是常见的功能性胃肠病,表现为反复发作的上腹部疼痛和(或)其他不适,如恶心呕吐、嗳气、饱胀等,但缺乏能解释症状的器质性疾病和代谢性异常[1]。FD症状产生的机制尚不明确,通常认为与胃黏膜物理化学刺激增加、胃肠动力紊乱和(或)患者对胃腔内刺激的超敏感反应有关[2~4]。胃窦和上段小肠的协调运动紊乱,导致胃排空障碍,影响胃肠黏膜的分泌功能,并导致十二指肠内容物向胃的反流,从而参与FD上腹部症状的发生[5]。
部分FD患者可伴有夜间症状,严重影响患者的生活质量。文献报道莫沙必利能明显改善FD患者的消化不良症状,如腹痛、嗳气和饱胀[6,7],但对夜间FD症状的作用尚未见相关前瞻性研究。本研究采用前瞻性、随机、双盲和安慰剂平行对照研究设计,通过观察莫沙必利对夜间FD症状的疗效,并结合治疗前后夜间胃内pH值和胆红素联合检测结果,旨在探讨莫沙必利改善夜间FD症状的可能机制。
对象与方法
一、研究对象
连续选取2008年12月~2010年12月上海仁济医院有夜间症状的门诊FD患者,诊断符合罗马ⅢFD标准。入选者的消化不良症状存在12周以上,每周发作2 d或以上,经上消化道内镜和常规血液生化检查排除能解释症状的器质性疾病或血液生化异常。以13C-呼气试验和内镜活检标本的快速尿素酶试验均阴性判断为幽门螺杆菌阴性。排除严重心、肺、肾脏和神经系统等疾病患者、妊娠以及其他影响本研究结果或观察的情况。
本研究程序符合赫尔辛基声明,并经上海仁济医院伦理委员会审核通过。受试者均签署知情同意书。
二、研究方案和流程
入选者先行单盲安慰剂治疗筛选,给予安慰剂(与莫沙必利分散片包装、外形、赋形剂成分以及口感相同,由成都康弘药业集团提供)1片tid治疗一周,治疗后症状积分下降<50%者进入随机、双盲、安慰剂平行对照研究。随后受试者随机分为莫沙必利组和安慰剂组,分别给予枸橼酸莫沙必利分散片(商品名:新络纳,成都康弘药业集团)5 mg tid或安慰剂治疗,疗程2周。治疗前和治疗后分别评估夜间FD症状积分,并行夜间胃内pH值和胆红素联合监测。
三、FD症状积分
选取三种常见的夜间FD上腹部症状,即上腹部疼痛、饱胀、嗳气行症状积分。症状严重程度评分标准:0分,无症状;1分,经提醒方能回忆起有症状出现;2分,有症状主诉,但不影响日常生活和工作;3分,影响日常生活和工作。过去一周内出现的天数为症状频度。各症状积分为症状严重程度评分与症状频度之积。
四、夜间胃内pH值和胆红素联合监测
所有患者晚餐均为标准餐(200 g面食),餐后禁食2 h,将pH监测电极(Digitrapper MKⅢpH监测仪)和胆红素监测微型分光光度计采样头(Bilitec 2000,Medtronic Synectics公司)置于下食管括约肌(lower esophageal sphincter,LES)下缘 8~10 cm 处(食管测压确定),动态记录夜间胃内pH值和胆红素吸收值>0.14的时间百分比[8]。监测时间为22:00 PM~6:00 AM。
五、统计学分析
结 果
一、一般临床资料
共纳入43例有夜间症状且幽门螺杆菌阴性的FD患者,其中男20例,女23例,年龄23~65岁,平均(36.7±6.5)岁。经1周安慰剂筛选后,15例患者对安慰剂治疗有效而终止研究。其余28例患者[男13 例,女 15 例,年龄 23~65 岁,平均(33.5±6.6)岁]进入随机、双盲对照研究,随机分为莫沙必利组和安慰剂组,每组各14例。莫沙必利组中,男6例,女8 例;年龄 23~61 岁,平均(34.2±6.8)岁;体重指数(BMI)18.2~26.6 kg/m2,平均(21.2±6.8) kg/m2;吸烟2例(14.3%),饮酒2例(14.3%)。安慰剂组中,男7例,女 7 例;年龄 25~65 岁,平均(32.8±6.5)岁;BMI 18.1~25.7 kg/m2,平均(21.7±8.1) kg/m2;吸烟 1 例(7.1%),饮酒 2例(14.3%)。
二、症状积分
治疗前,两组夜间症状(包括上腹部疼痛、饱胀和嗳气)积分无明显差异。治疗后,莫沙必利组各种症状积分均显著降低(P<0.05)(见图1),而安慰剂组无明显改变(见图2)。莫沙必利组各种夜间FD症状积分治疗后改善幅度均明显优于安慰剂组(P<0.05)(见表 1)。


表1 两组夜间FD症状积分改善幅度比较()

表1 两组夜间FD症状积分改善幅度比较()
*与安慰剂组比较,P<0.05
三、夜间胃内pH值和胆红素联合监测
20例(71.4%)患者存在夜间胃十二指肠反流。两组治疗前夜间胃内pH值和胆红素吸收值>0.14的时间百分比的中位数和平均值均无明显差异。治疗后,莫沙必利组夜间胃内pH值、胆红素吸收值>0.14的时间百分比均明显降低(P<0.05),而安慰剂组无明显差异。莫沙必利组治疗后夜间胃内pH值和胆红素吸收值>0.14的时间百分比均显著低于安慰剂组(P<0.05)(见表 2、表 3)。

表2 莫沙必利对夜间胃内pH值和胆红素吸收值的影响(M)
四、相关性分析
治疗后,莫沙必利组夜间症状积分改善幅度与夜间胃内pH值降低程度和胆红素吸收值>0.14的时间百分比降低幅度之间均存在明显相关性(P<0.05)(见表 4)。
表3 莫沙必利对夜间胃内平均pH值和胆红素吸收值的影响()
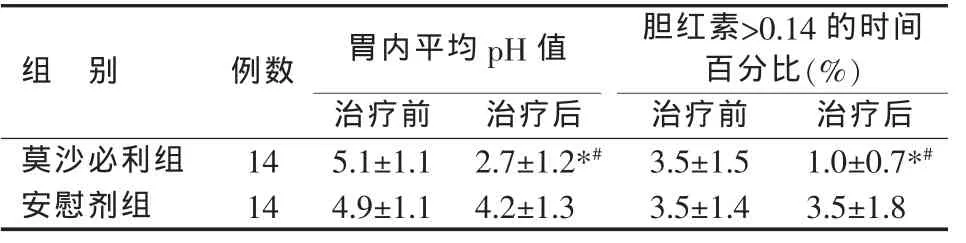
表3 莫沙必利对夜间胃内平均pH值和胆红素吸收值的影响()
*与同组治疗前比较,P<0.05;#与安慰剂组治疗后比较,P<0.05

表4 莫沙必利组症状积分改善与胃内环境改变的相关性
讨 论
胃肠动力障碍是FD症状产生的重要病理生理学环节之一,约30%的FD患者存在胃排空延迟[4,9,10]。FD的最佳药物治疗方案目前尚无明确的指导或共识。临床研究[11~13]显示,促动力药能一定程度地改善部分FD患者的上腹部症状。莫沙必利为5-羟色胺(5-HT)4受体激动剂,具有促全胃肠动力作用,能改善胃排空,增加小肠和结肠传输,可用于治疗胃肠动力障碍疾病包括FD[6,7]。然而,莫沙必利对夜间FD症状的疗效尚未见报道。
夜间FD症状的确切病理生理学机制目前尚未完全明确。已知夜间胃食管反流症状可能与夜间酸突破(抑酸剂规律治疗期间,仍有部分正常人或胃食管反流病患者夜间胃内pH值异常降低)机制有关。但以往研究[14]发现,夜间FD症状患者夜间胃内pH值并未降低,反而高于非夜间症状FD患者,推测胃十二指肠反流可能是其原因之一。本研究中有夜间症状的FD患者的夜间胃内pH值高于正常值,且一定比例的患者存在夜间胃十二指肠反流,胃内胆红素吸收值>0.14的时间百分比较高。
总体而言夜间进食或其他活动较白天减少,夜间胃内pH值和胆红素吸收值的影响因素相对减少,监测结果较为客观、可靠。以往研究[14]结果显示,约36%的FD患者存在夜间症状,其中约70%存在夜间胃内pH值升高(>4),且多数患者胆红素吸收值>0.14的时间百分比升高,提示夜间FD症状可能与胃十二指肠胆汁反流有关。
本研究中,莫沙必利5 mg tid治疗两周后,夜间FD症状上腹部疼痛、饱胀和嗳气积分均显著降低,夜间胃内pH值、胆红素吸收值>0.14的时间百分比亦明显降低,而安慰剂组上述指标均无明显差异。证实莫沙必利对FD患者夜间症状具有较好的疗效。莫沙必利治疗后夜间FD症状的改善幅度与胃内pH值降低幅度和胆红素吸收值>0.14的时间百分比降低幅度之间存在明显相关性,提示莫沙必利的治疗作用可能与改善胃排空、减轻胃十二指肠胆汁反流有关。
鉴于FD患者的病因复杂,心理因素和(或)内脏敏感等因素亦参与部分患者症状的产生,可导致FD患者对安慰剂有较高的治疗反应率[15]。故本研究在受试者进入随机双盲对照研究程序之前,先进行1周安慰剂治疗筛选期,以期滤过安慰剂效应,使治疗药物的疗效观察更具客观性和准确性。
总之,本研究结果显示莫沙必利5 mg tid治疗两周对夜间FD症状具有较明显的改善作用,这种治疗作用可能与改善胃排空、减少夜间胃十二指肠胆汁反流有关。
1 Geeraerts B,Tack J.Functional dyspepsia:past,present,and future[J].J Gastroenterol,2008,43(4):251-255.
2 Tack J,Masaoka T,Janssen P.Functional dyspepsia[J].Curr Opin Gastroenterol,2011,27(6):549-557.
3 Sha W,Pasricha PJ,Chen JD.Correlations among electrogastrogram,gastric dysmotility,and duodenal dysmotility in patients with functional dyspepsia[J].J Clin Gastroenterol,2009,43(8):716-722.
4 Miwa H,Watari J,Fukui H,et al.Current understanding of pathogenesis of functional dyspepsia[J].J Gastroenterol Hepatol,2011,26 Suppl 3:53-60.
5 Mearin F,De Ribot X,Balboa A,et al.Duodenogastric bile reflux and gastrointestinal motility in pathogenesis of functional dyspepsia.Role of cholecystectomy[J].Dig Dis Sci,1995,40(8):1703-1709.
6 Curran MP,Robinson DM.Mosapride in gastrointestinal disorders[J].Drugs,2008,68(7):981-991.
7 Hiyama T,Yoshihara M,Matsuo K,et al.Treatment of functional dyspepsia with serotonin agonists:a metaanalysis of randomized controlled trials[J].J Gastroenterol Hepatol,2007,22(10):1566-1570.
8 Koek GH,Vos R,Sifrim D,et al.Mechanisms underlying duodeno-gastric reflux in man[J].Neurogastroenterol Motil,2005,17(2):191-199.
9 Sarnelli G,Caenepeel P,Geypens B,et al.Symptoms associated with impaired gastric emptying of solids and liquids in functional dyspepsia[J].Am J Gastroenterol,2003,98(4):783-788.
10 Talley NJ,Locke GR 3rd,Lahr BD,et al.Functional dyspepsia,delayed gastric emptying,and impaired quality of life[J].Gut,2006,55(7):933-939.
11 Hiyama T,Yoshihara M,Matsuo K,et al.Meta-analysis of the effects of prokinetic agents in patients with functional dyspepsia[J].J Gastroenterol Hepatol,2007,22(3):304-310.
12 Ang TL,Fock KM,Teo EK,et al.Helicobacter pylori eradication versus prokinetics in the treatmentof functional dyspepsia:a randomized,double-blind study[J].J Gastroenterol,2006,41(7):647-653.
13 Passos Mdo C,Duro D,Fregni F.CNS or classic drugs for the treatment of pain in functional dyspepsia?A systematic review and meta-analysis of the literature[J].Pain Physician,2008,11(5):597-609.
14 Chen SL,Ji JR,Xu P,et al.Effect of domperidone therapy on nocturnal dyspeptic symptoms of functional dyspepsia patients[J].World J Gastroenterol,2010,16(5):613-617.
15 Talley NJ,Locke GR,Lahr BD,et al.Predictors of the placebo response in functional dyspepsia[J].Aliment Pharmacol Ther,2006,23(7):923-936.

