胆汁酸对胃癌细胞株MKN-28生长的影响*
王学伟 曹 勤
上海中医药大学附属普陀医院消化内科(200062)
胆汁反流入胃甚至食管的现象十分常见[1~3],可造成胃黏膜肠化生、反流性食管炎、Barrett食管甚至食管腺癌等[4~17]。但胆汁反流致胃部疾病的具体机制仍未阐明。本研究以胃癌细胞株MKN-28为研究对象,体外观察脂溶性胆汁酸牛磺石胆酸钠(taurolithocholate,TLC)和水溶性胆汁酸甘氨鹅脱氧胆酸钠(glycochenodeoxycholate,GCDC)对其生长的影响,旨在明确不同胆汁酸对胃癌细胞生长的直接作用。
材料与方法
一、细胞株、主要试剂与仪器
胃癌细胞株MKN-28购自上海市消化疾病研究所。RPMI-1640培养基、牛血清白蛋白购自Gibco公司;TLC、GCDC、DMSO购自Sigma公司;MTT购自北京鼎国昌盛生物技术有限责任公司。ELIZA MAT 3000全自动比色仪购自DRG公司。
二、方法
1.细胞培养:将处于对数生长期的MKN-28细胞置于培养箱(36.5℃、含5%CO2)。细胞以1500个/孔接种于96孔板,每孔加入100 μL含血清的RPMI-1640培养基。24 h后弃培养液,PBS洗涤3次,加入200 μL无血清培养基。TLC 组加入不同浓度 TLC(6 μmol/L、60 μmol/L、100 μmol/L和 300 μmol/L), 连续培养 6 d;GCDC 组加入 300 μmol/L GCDC,培养24 h。对照组加入等体积无血清培养基,培养时间相同。
2.MTT测定:每孔加入20 μL MTT溶液,孵育2 h。弃培养液,加入100 μL DMSO,室温摇晃5 min。 ELIZA Mat-3000全自动比色仪于570 nm处测定吸光度A值,并于630 nm处测定吸光度A值进行校正,以此反应细胞的生长情况。
三、统计学分析
应用SAS 6.12统计软件,组间比较采用t检验,P<0.05为差异有统计学意义。
结 果
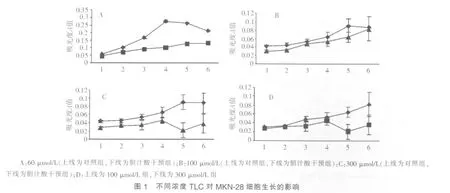
从第 1~6 d,6 μmol/L TLC对 MKN-28细胞的生长无显 著 影 响 。 干预至第 4 d 起 ,60 μmol/L、100 μmol/L 和300 μmol/L TLC均显示对MKN-28细胞生长有抑制作用;至第5 d时,抑制作用最显著。第6 d时,抑制作用稍减弱(见图 1A~1C,P<0.05)。 进一步比较 100 μmol/L 与 300 μmol/L TCL对MKN-28细胞生长的抑制作用,结果示至干预的第5~6 d,300 μmol/L TCL组MKN-28细胞生长的抑制程度明显强于 100 μmol/L 组(见图 1D,P<0.05)。 以上结果表明,TLC对MKN-28细胞生长的抑制作用与剂量相关。
300 μmol/L GCDC干预24 h,GCDC干预组的吸光度A值明显高于对照组,差异有统计学意义(0.0469±0.0059对0.0103±0.0014,P<0.05)。 由此提示 300 μmol/L GCDC 可明显抑制MKN-28细胞生长。
讨 论
以往研究发现,胃大部切除术易致胆汁反流入胃,是引起胃小凹上皮增生的重要原因,亦可能与残胃癌等的发生有关。近年,随着胆汁反流监测技术广泛应用于临床,研究[1~3]发现即使无上消化道手术史,胆汁反流入胃甚至食管的现象亦十分常见,并可能与胃黏膜肠化生、反流性食管炎、Barrett食管甚至食管腺癌等的发生有关[4~17]。因此,胆汁反流不仅是一种术后并发症,且生理状况下的过度反流,亦可能参与某些胃和食管疾病的发生和发展,因此具有潜在致病作用。Dresner等[10]的研究亦支持上述观点。但目前胆汁反流致胃部疾病的具体机制尚未完全阐明,本研究观察脂溶性TLC和水溶性GCDC对体外培养的胃癌细胞株MKN-28生长的影响,旨在明确胆汁反流致胃部疾病的可能机制。
脂溶性胆汁酸TLC和水溶性胆汁酸GCDC是胆汁酸家族的两大重要成分。其中TLC的水溶性较差,在无血清RPMI-1640培养基中的浓度>25 μmol/L即会析出,为保持其水溶性,本研究以牛血清白蛋白按4∶1的摩尔比配置TLC溶液,按照预实验结果将TLC浓度设置为6 μmol/L、60 μmol/L、100 μmol/L 和 300 μmol/L。 GCDC 的水溶性较好,可直接溶于RPMI-1640无血清培养基。本课题组的预实验发现,100 μmol/L 和 200 μmol/L GCDC 对 MKN-28 细胞生长的影响均不显著,遂将GCDC剂量增至300 μmol/L,结果示干预24 h即可明显抑制MKN-28细胞生长。
MTT比色法检测细胞死亡率的原理为活细胞线粒体中的琥珀酸脱氢酶可将外源性MTT还原为不溶于水的蓝紫色结晶并沉积于细胞内,DMSO可溶解此结晶,通过酶联免疫检测仪测定吸光度A值,可间接反映活细胞的数量。因此本研究采用MTT比色法检测细胞死亡,结果示60 μmol/L、100 μmol/L和300 μmol/L TLC干预至第4 d起,可明显抑制MKN-28细胞生长。至第5 d时,抑制作用最显著;第6 d时,抑制作用稍减弱;300 μmol/L TCL干预第5~6 d时,对MKN-28细胞生长的抑制作用明显强于100 μmol/L。GCDC 300 μmol/L干预24 h亦可显著抑制MKN-28细胞生长。由此提示无论是脂溶性还是水溶性胆汁酸,均可在体外直接抑制胃癌细胞生长。
近年研究发现,胆汁酸可诱导肝细胞凋亡。GCDC诱导肝细胞凋亡的过程中,Fas(CD95)可发生不依赖配体的寡聚化激活,通过结合Fas相关死亡功能体激活凋亡蛋白酶8,激活一系列下游凋亡蛋白酶,包括组织蛋白酶B,使其从胞质转移至胞核并发挥蛋白水解酶活性,从而参与细胞的凋亡[18,19]。推测本研究中GCDC抑制胃癌细胞生长与其通过CD95途径诱导胃癌细胞的凋亡有关,但还需进一步研究证实。
牛磺石胆酸-3-硫酸(TLCS)是TLC的脂溶性硫酸化产物[20],可诱导肝细胞凋亡,其机制可能与活性氧产物激活Src激酶家族成员Yes,后者进一步激活JNK和PKC并活化CD95,由此诱导细胞凋亡有关[20~22]。上述研究提示TLC可能通过Yes-JNK/PKC-CD95途径促进胃癌细胞凋亡。
体内研究[10]提示长期胆汁反流可致胃小凹上皮增生和反流性食管炎鳞状上皮增生,并可能与肠化生甚至癌变有关。与此处TLC和GCDC抑制胃癌细胞生长,促进胃癌细胞凋亡的作用不符,由此提示长期胆汁反流可能存在间接作用机制,通过克服胆汁酸对胃上皮细胞生长的直接抑制作用而促进其增生,但目前其中的机制尚不明确,还需进一步研究证实。
1 Fein M,Freys SM,Sailer M,et al.Gastric bilirubin monitoring to assess duodenogastric reflux[J].Dig Dis Sci,2002,47(12):2769-2774.
2 Vaezi MF, Richter JE. Role of acid and duodenogastroesophageal reflux in gastroesophageal reflux disease[J].Gastroenterology,1996,111(5):1192-1199.
3 Kauer WK,Peters JH,DeMeester TR,et al.Mixed reflux of gastric and duodenal juices is more harmful to the esophagus than gastric juice alone.The need for surgical therapy re-emphasized[J].Ann Surg,1995,222(4):525-533.
4 Dixon MF,Mapstone NP,Neville PM,et al.Bile reflux gastritis and intestinal metaplasia at the cardia[J].Gut,2002,51(3):351-355.
5 Dixon MF,Neville PM,Mapstone NP,et al.Bile reflux gastritis and Barrett’s oesophagus:further evidence of a role for duodenogastro-oesophageal reflux[J]?Gut,2001,49(3):359-363.
6 Sobala GM,O’Connor HJ,Dewar EP,et al.Bile reflux and intestinal metaplasia in gastric mucosa[J].J Clin Pathol,1993,46(3):235-240.
7 Oberg S,Peters JH,DeMeester TR,et al.Determinants of intestinal metaplasia within the columnar-lined esophagus[J].Arch Surg,2000,135(6):651-656.
8 Martinez de Haro L,Ortiz A,Parrilla P,et al.Intestinal metaplasia in patients with columnar lined esophagus is associated with high levels of duodenogastroesophageal reflux[J].Ann Surg,2001,233(1):34-38.
9 Campos GM,DeMeester SR,Peters JH,et al.Predictive factors of Barrett esophagus:multivariate analysis of 502 patients with gastroesophageal reflux disease[J].Arch Surg,2001,136(11):1267-1273.
10 Dresner SM,Griffin SM,Wayman J,et al.Human model of duodenogastro-oesophageal reflux in the development of Barrett’s metaplasia[J].Br J Surg,2003,90(9):1120-1128.
11 Caldwell MT,Lawlor P,Byrne PJ,et al.Ambulatory oesophageal bile reflux monitoring in Barrett’s oesophagus[J].Br J Surg,1995,82(5):657-660.
12 Shirvani VN,Ouatu-Lascar R,Kaur BS,et al.Cyclooxygenase 2 expression in Barrett’s esophagus and adenocarcinoma:Ex vivo induction by bile salts and acid exposure[J].Gastroenterology,2000,118(3):487-496.
13 Kaur BS,Ouatu-Lascar R,Omary MB,et al.Bile salts induce or blunt cell proliferation in Barrett’s esophagus in an acid-dependent fashion[J].Am J Physiol Gastrointest Liver Physiol,2000,278(6):G1000-G1009.
14 Kaur BS,Triadafilopoulos G.Acid-and bile-induced PGE (2)release and hyperproliferation in Barrett’s esophagus are COX-2 and PKC-epsilon dependent[J].Am J Physiol Gastrointest Liver Physiol,2002,283(2):G327-G334.
15 O’Riordan JM,Tucker ON,Byrne PJ,et al.Factors influencing the development of Barrett’s epithelium in the esophageal remnant postesophagectomy[J].Am J Gastroenterol,2004,99(2):205-211.
16 Tselepis C,Morris CD,Wakelin D,et al.Upregulation of the oncogene c-myc in Barrett’s adenocarcinoma:induction of c-myc by acidified bile acid in vitro[J].Gut,2003,52(2):174-180.
17 Fitzgerald RC,Abdalla S,OnwuegbusiBA,etal.Inflammatory gradient in Barrett’s oesophagus:implications for disease complications[J].Gut,2002,51(3):316-322.
18 Roberts LR,Kurosawa H,Bronk SF,et al.Cathepsin B contributes to bile salt-induced apoptosis of rat hepatocytes[J].Gastroenterology,1997,113(5):1714-1726.
19 Faubion WA,Guicciardi ME,Miyoshi H,et al.Toxic bile saltsinduce rodenthepatocyte apoptosisvia direct activation of Fas[J].J Clin Invest,1999,103(1):137-145.
20 Graf D,Kurz AK,Fischer R,et al.Taurolithocholic acid-3 sulfate induces CD95 trafficking and apoptosis in a c-Jun N-terminal kinase-dependent manner[J].Gastroenterology,2002,122(5):1411-1427.
21 Reinehr R,Graf D,Häussinger D.Bile salt-induced hepatocyte apoptosis involves epidermal growth factor receptor-dependent CD95 tyrosine phosphorylation[J].Gastroenterology,2003,125(3):839-853.
22 Reinehr R,Becker S,Wettstein M,et al.Involvement of the Src family kinase yes in bile salt-induced apoptosis[J].Gastroenterology,2004,127(5):1540-1557.

